По составу Б. делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами ( липопротеины), нуклеиновыми к-тами ( нуклеопротеиды), а также ковалентно связывать остаток фосфорной к-ты (фосфопротеиды), углевода (гликопротеины )или нуклеиновой к-ты (геномы нек-рых вирусов). В соответствии с формой молекул Б. подразделяют на глобулярные и фибриллярные. Молекулы первых свернуты в компактные глобулы сферич. или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных Б., в отличие от фибриллярных, растворимы в воде. Особую группу составляют мембранные (амфипатические) Б., характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков в молекуле: погруженная в биол. мембрану часть глобулы состоит преим. из липофильных аминокислотных остатков, а выступающая из мембраны - из гидрофильных.
Историческая справка. Первые работы по выделению и изучению белковых препаратов были выполнены еще в 18 в., однако в тот период исследования Б. носили описательный характер. В нач. 19 в. были сделаны первые анализы элементного состава Б. (Ж. Л. Гей-Люссак, Л. Ж. Тенар, 1810), положившие начало систематич. аналит. исследованиям, в результате к-рых было установлено, что все белковые в-ва близки не только по внеш. признакам и св-вам, но и по элементному составу. Важное следствие этих работ - создание первой теории строения белковых в-в (Г. Я. Мульдер, 1836), согласно к-рой все Б. содержат общий гипотетич. радикал - "протеин", имеющий эмпирич. ф-лу C40H62N10O12 и связанный в разл. пропорциях с атомами серы и фосфора. Получив вначале всеобщее признание, эта теория привлекла интерес к аналит. исследованиям Б., совершенствованию препаративных методов белковой химии. В этот период были разработаны простейшие приемы выделения Б. путем экстракции р-рами нейтральных солей и осаждения, получены первые кристаллич. Б. (гемоглобин, нек-рые растит. Б.), для анализа Б. стали использовать кислотный и щелочной гидролиз.
Создание теории протеина совпало по времени с формированием представлений о функции Б. в организме. В 1835 Й. Я. Бёрцедиус высказал идею о важнейшей ф-ции Б.- биокаталитической. Вскоре были открыты первые протеолитич. ферменты - пепсин (Т. Шмнн._1836) и трипсин (Л. Корвизар, 1856). Открытие протеаз стимулировало интерес биохимиков к физиологии пищеварения, а следовательно, и к продуктам переваривания Б. К сер. 19 в. было показано, что под действием протеолитич. ферментов Б. распадаются на близкие по св-вам фрагменты, получившие назв. пептонов (К. Леман, 1850).
Важное событие в изучении Б. - выделение из белкового гидролизата аминокислоты глицина (А. Браконно, 1820). К кон. 19 в. было изучено большинство аминокислот, входящих в состав Б., синтезирован аланин (А. Штреккер, 1850). В 1894 А. Косеелъ высказал идею о том, что осн. структурными элементами Б. являются аминокислоты.
В нач. 20 в. значит. вклад в изучение Б. был внесен Э. Фишером, .впервые применившим для этого методы орг. химии. Путем встречного синтеза Э. Фишер доказал, что Б. построены из остатков 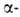 аминокислот, связанных амидной (пептидной) связью. Он также выполнил первые аминокислотные анализы Б., дал правильное объяснение протеолизу.
аминокислот, связанных амидной (пептидной) связью. Он также выполнил первые аминокислотные анализы Б., дал правильное объяснение протеолизу.
В 20-40-е гг. получили развитие физ.-хим. методы анализа Б. Седиментационными и диффузионными методами были определены мол. массы многих Б., получены данные о сферич. форме молекул глобулярных Б. (Т. Сведберг, 1926), выполнены первые рентгеноструктурные анализы аминокислот и пептидов (Дж. Д. Бернал, 1931), разработаны хроматографич. методы анализа (А. Мартин, Р. Синг, 1944). Существенно расширились представления о функциональной роли Б.: был выделен первый белковый гормон - инсулин (Ф. Бантинг, Ч. Г. Бест, 1922), антитела были идентифицированы как фракция 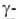 глобулинов (1939) и тем самым обнаружена новая ф-ция Б. - защитная. Важным этапом явилось открытие ферментативной ф-ции мышечного миозина (В. А. Энгельгардт, М. Н. Любимова, 1939) и получение первых кристаллич. ферментов (уреазы-Дж. Б. Салшер, 1926; пепсина - Дж.X. Нортроп, 1929; лизоцима - Э. П. Абрахам, Р. Робинсон, 1937).
глобулинов (1939) и тем самым обнаружена новая ф-ция Б. - защитная. Важным этапом явилось открытие ферментативной ф-ции мышечного миозина (В. А. Энгельгардт, М. Н. Любимова, 1939) и получение первых кристаллич. ферментов (уреазы-Дж. Б. Салшер, 1926; пепсина - Дж.X. Нортроп, 1929; лизоцима - Э. П. Абрахам, Р. Робинсон, 1937).
В нач. 50-х гг. была выдвинута идея о трех уровнях организации белковых молекул (К. У. Линдерстрём-Ланг, 1952) - первичной, вторичной и третичной структурах. Определены первичные структуры инсулина (Ф. Сенгер, 1953) и рибонуклеазы (К. Анфинсен, С. Мур, К. Хёрс, У. Стайн, 1960). По данным рентген йструктурного анализа были построены трехмерные модели миоглобина (Дж. Кендрю, 1958) и гемоглобина (М, Перуц, 1958) и, т. обр., доказано существование в Б. вторичной и третичной структур, в т. ч.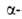 спирали, предсказанной Л. Допингом и Р. Кори в 1949-51.
спирали, предсказанной Л. Допингом и Р. Кори в 1949-51.
В 60-е гг. в химии Б. интенсивно развивалось синтетич. направление: были синтезированы инсулин (X. Цан, 1963, П. Кадоянис, 1964, Ю. Ван и др., 1965) и рибонуклеаза А (Б. Меррифидд, 1969). Дальнейшее развитие получили аналит. методы: стал широко использоваться автоматич. аминокислотный анализатор, созданный С. Муром и У. Стайном в 1958, существенно модифицированы хроматографич. методы, до высокой степени совершенства доведен рентгеноструктурный анализ, сконструирован автоматич. прибор для определения последовательности аминокислотных остатков в Б. - секвенатор (П. Эдман, Г. Бэгг, 1967). Благодаря созданию прочной методич. базы стало возможным проводить широкие исследования аминокислотной последовательности Б. В эти годы была определена структура неск. сотен сравнительно небольших Б. (до 300 аминокислотных остатков в одной цепи), полученных из самых разл. источников как животного, так и растит., бактериального, вирусного и др. происхождения. Среди них Ч протеолитич. ферменты (трипсин, химотрипсин, субтилизин, карбоксипептидазы), миоглобины, гемоглобины, цитохромы, лизоцимы, иммуноглобулины, гистоны, нейротоксины, Б. оболочек вирусов, белково-пептидные гормоны и др. В результате были созданы предпосылки для решения актуальных проблем энзимологии, иммунологии, эндокринологии и др. областей физ.-хим. биологии.
В 70-80-е гг. наиб. прогресс был достигнут при изучении Б. - регуляторов матричного синтеза биополимеров (в т. ч. Б. рибосом), сократительных, транспортных и защитных Б., ряда мембранных Б. (в т. ч. Б. биоэнергетич. систем), рецепторных Б. Большое внимание уделялось дальнейшему совершенствованию методов анализа Б. Значительно повышена чувствительность автоматич. анализа аминокислотной последовательности Б. (Б. Витман-Либольд, Л. Худ). Широкое применение нашли новые методы разделения Б. и пептидов (жидкостная хроматография высокого давления, биоспецифич. хроматография). В связи с разработкой эффективных методов анализа нуклеотидной последовательности ДНК (А. Максам и У. Гилберт, Ф. Сенгер) стало возможным использовать полученную при таком анализе информацию и при определении первичной структуры Б. В результате установлена структура ряда Б., доступных в ничтожно малых кол-вах (интерферон, ацетилхолиновый рецептор), а также Б. большой мол. массы (фактор элонгации G, гликогенфосфорилаза,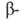 галактозидаза, коллаген,
галактозидаза, коллаген,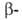 и
и 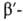 субъединицы РНК-полимеразы, содержащие соотв. 701, 841, 1021, 1028, 1342 и 1407 аминокислотных остатков). Успехи структурного анализа позволили вплотную приступить к определению пространств, организации и молекулярных механизмов функционирования надмолекулярных комплексов, в т. ч. рибосом, хроматина (нуклеосом), митохондрий, фагов и вирусов. Существ, результаты получены в эти годы советскими учеными: определена первичная структура аспартатаминотрансферазы (1972), бактериородопсина (1978), животного родопсина (1982), нек-рых рибосомальных Б., фактора элонгации G (1982), важнейшего фермента-РНК-полимеразы (1976-82), нейротоксинов и др.
субъединицы РНК-полимеразы, содержащие соотв. 701, 841, 1021, 1028, 1342 и 1407 аминокислотных остатков). Успехи структурного анализа позволили вплотную приступить к определению пространств, организации и молекулярных механизмов функционирования надмолекулярных комплексов, в т. ч. рибосом, хроматина (нуклеосом), митохондрий, фагов и вирусов. Существ, результаты получены в эти годы советскими учеными: определена первичная структура аспартатаминотрансферазы (1972), бактериородопсина (1978), животного родопсина (1982), нек-рых рибосомальных Б., фактора элонгации G (1982), важнейшего фермента-РНК-полимеразы (1976-82), нейротоксинов и др.
Строение белковых молекул. Практически все Б. построены из 20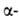 аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и
аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и 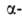 аминогруппами соседних аминокислотных остатков (см. ф-лу I):
аминогруппами соседних аминокислотных остатков (см. ф-лу I): 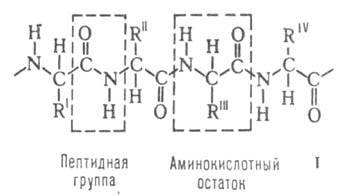
Белковая молекула может состоять из одной или неск. цепей, содержащих от 50 до неск. сотен (иногда - более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков, часто относят к пептидам. В состав мн. молекул входят остатки цистина, дисульфидные связи к-рых ковалентно связывают участки одной или неск. цепей.
В нативном состоянии макромолекулы Б. обладают специфич. конформацией. Характерная для данного Б. конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также гидрофобными и электростатич. взаимодействиями. Большое влияние на конформацию оказывают взаимод. Б. с компонентами среды (вода, липиды и др.), в к-рой они функционируют.
Различают четыре уровня организации белковых молекул. Последовательность аминокислотных остатков в полипептидной цепи наз. первичной структурой. Все Б. различаются по первичной структуре; потенциально возможное их число практически неограничено. Термин "вторичная структура" относится к типу укладки полипептидных цепей. наиб. часто встречающиеся типы-правая 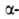 спираль и
спираль и 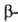 структура. Первая характеризуется планарностью пептидной группы; водородные связи между СО-и NH-группами пептидной цепи замыкают циклы из 13 атомов (рис. 1). На 1 виток
структура. Первая характеризуется планарностью пептидной группы; водородные связи между СО-и NH-группами пептидной цепи замыкают циклы из 13 атомов (рис. 1). На 1 виток 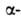 спирали приходится 3,6 остатка аминокислот, шаг спирали -0,544 нм. Значительно менее энергетически выгодны правые 310- и
спирали приходится 3,6 остатка аминокислот, шаг спирали -0,544 нм. Значительно менее энергетически выгодны правые 310- и 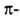 спирали, содержащие соотв. 3 и 4,4 аминокислотных остатка на 1 виток, а также 10 и 16 атомов в циклах, образованных водородными связями. 310 -Спирали встречаются сравнительно редко и образуют только очень короткие участки, к-рые обычно располагаются на концах
спирали, содержащие соотв. 3 и 4,4 аминокислотных остатка на 1 виток, а также 10 и 16 атомов в циклах, образованных водородными связями. 310 -Спирали встречаются сравнительно редко и образуют только очень короткие участки, к-рые обычно располагаются на концах 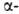 спиралей. Предсказанные теоретически правые
спиралей. Предсказанные теоретически правые 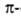 спирали, а также левые
спирали, а также левые 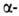 310- и
310- и 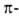 спирали в Б. не обнаружены.
спирали в Б. не обнаружены.
В случае 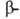 структуры, или структуры складчатого листа, полипептидные цепи растянуты, уложены параллельно друг другу и связаны между собой водородными связями. Остов цепи не лежит в одной плоскости, а вследствие небольших изгибов при
структуры, или структуры складчатого листа, полипептидные цепи растянуты, уложены параллельно друг другу и связаны между собой водородными связями. Остов цепи не лежит в одной плоскости, а вследствие небольших изгибов при 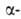 углеродных атомах образует слегка волнистый слой. Боковые группы располагаются перпендикулярно плоскости слоя. В Б. обнаружены два вида
углеродных атомах образует слегка волнистый слой. Боковые группы располагаются перпендикулярно плоскости слоя. В Б. обнаружены два вида 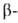 структуры: с параллельным и антипараллельным направлениями цепей (рис. 2). Частный случай
структуры: с параллельным и антипараллельным направлениями цепей (рис. 2). Частный случай 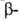 структуры-
структуры-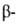 изгиб, обеспечивающий поворот пептидной цепи на угол ок. 180
изгиб, обеспечивающий поворот пептидной цепи на угол ок. 180
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.