Основными компонентами Ф. с. являются кровеносные системы матери и плода и объединяющая их Плацента. В состав Ф. с. входят также надпочечники матери и плода, в которых синтезируются предшественники стероидных гормонов плаценты, печень плода и печень матери, участвующие в метаболизме гормонов плаценты; почки матери, выводящие продукты метаболизма плаценты.
Одним из основных факторов, определяющих функцию Ф. с., является проницаемость плаценты, обеспечивающая все виды обмена между матерью и плодом. Нарушение проницаемости плаценты является основной причиной повреждений плода при осложнениях беременности. Проницаемость плаценты зависит от строения ее ворсин, химических свойств веществ и величины перфузии плаценты. Проницаемость облегчается за счет наличия в местах расположения трофобласта над капиллярами плодовой части плаценты особых синцитиокапиллярных мембран, лишенных микроворсин. Вещества с молекулярной массой менее 100 легко проникают через плаценту, переход через нее веществ с молекулярной массой более 1000 затруднен. Вещества, растворимые в жирах (например, стероиды), легче проходят через плаценту, чем водорастворимые вещества той же молекулярной массы. В последнем триместре беременности кровоток в матке увеличивается до 750 мл/мин, давление крови в спиральных артериях матки составляет 80 мм рт. ст., в венах — 10 мм рт. ст., перфузионное давление (разница между давлением в артериях и венах матки), обеспечивающее обмен крови матери и плода в межворсинчатом пространстве, достигает 70 мм рт. ст., т.е. примерно такое же, как в капиллярах органов матки.
Молекулы воды, кислорода и двуокиси углерода свободно проходят через плаценту. Переход кислорода через плаценту к плоду обеспечивается более высокой концентрацией гемоглобина в крови плода и большой способностью гемоглобина плода поглощать кислород. Концентрация кислорода в крови плода выше, чем у матери. Давление его в тканях плода составляет 7,6 мм рт. ст., во внеклеточной жидкости — 2,3 мм рт. ст. Двуокись углерода в крови матери и плода диссоциирует одинаково. Глюкоза легко проникает через плаценту благодаря образованию с белком комплекса, легко растворимого в жирах. Плацента поглощает много глюкозы, в ранние сроки беременности она используется для синтеза гликогена, в поздние сроки основное количество глюкозы идет на процессы гликолиза и образование энергии. Обмен белка у плода происходит в 10 раз активнее, чем у матери, и плацента выводит аминокислоты значительно быстрее, чем материнская печень. Высокий уровень свободных аминокислот у плода является свидетельством анаболического метаболизма, концентрация аминокислот в крови плода примерно в 5 раз выше, чем в крови матери. Свободные жирные кислоты легко проникают через плаценту, и уровень их у плода и матери примерно одинаков. Высока проницаемость плаценты для железа, поэтому уровень гемоглобина у плода может быть нормальным даже при железодефицитной анемии у матери. Легко переходят через плаценту также кальций и йод.
Важное значение имеет эндокринная функция Ф. с. Основными гормонами этой системы являются эстрогены, прогестерон, плацентарный лактоген и α-фетопротеин. Среди них ведущая роль принадлежит стероидным гормонам — эстрогенам и прогестерону. От них зависят интенсивность кровотока в Ф. с., рост матки, накопление в миометрин гликогена и ДТФ, необходимых для активизации анаболических процессов у плода, его роста и развития, разрыхление тканей влагалища и лобкового симфиза; гиперплазия секреторной ткани молочных желез и подготовка их к лактации; подавление сократительной активности мышц матки; определенные изменения метаболизма и иммунодепрессия, необходимые для нормального развития плода.
Источником образования эстрогенов и прогестерона является прегненолон, синтезирующийся из холестерина в печени матери и с током крови поступающий в плаценту. Большая часть прегненолона переходит через плаценту в надпочечники плода, где превращается в дегидроэпиандростеронсульфат: меньшая часть прегненолона под влиянием определенных ферментов превращается в прогестерон, поступающий обратно в организм матери. Дегидроэпиандростеронсульфат из надпочечников плода поступает в его печень, где превращается в 16 α-дегидроэпиандростерон-сульфат. Это вещество с током крови попадает в плаценту и превращается в ней в эстриол. Затем эстриол переходит в кровь матери, инактивируется в ее печени, соединяясь с глюкуроновой и серной кислотами, в виде эфиров этих кислот экскретируется с мочой. 90% эстриола, синтезирующегося в плаценте, образуется из предшественников, поступающих в нее из надпочечников плода, лишь 10% этого гормона имеет материнское происхождение, поэтому содержание эстриола в крови и моче беременной начиная со II триместра беременности (когда заканчивается созревание плаценты) является одним из показателей состояния плода. Часть дегидроэпиандростерона-сульфата поступает из надпочечников плода обратно в плаценту и превращается под влиянием ее ферментных систем в эстрадиол и эстрон, которые переходят в кровь матери. Схема основных этапов синтеза эстрогенов и прогестерона в фетоплацентарной системе представлена на рисунке.
Содержание эстрогенов в крови и моче беременной резко повышается по мере увеличения срока беременности. Так, количество свободного (не связанного с белками плазмы крови) эстриола возрастает с 2,5 нг/мл на 10-й неделе беременности до 15 нг/мл на 38-й неделе, суточная экскреция эстриола с мочой — с 1 мг на 10-й неделе беременности до 45 мг к 39—40-й неделе. С мочой у беременных выделяется эстриола в 1000 раз больше, эстрадиола и эстрона в сотни раз больше, чем вне беременности. Образование значительного количества эстрогенов, являющихся протекторами беременности и обеспечивающих подготовку организма к родам, возможно только благодаря участию в их синтезе надпочечников плода и ферментных систем плаценты.
Прогестерон секретируется плацентой в значительном количестве (к концу беременности до 250 мг в сутки). На 6-й неделе беременности уровень прогестерона в крови беременной составляет примерно 25 нг/мл, на 38-й неделе достигает 250 нг/мл.
Образующийся в плаценте белковый гормон плацентарный лактоген по своим свойствам сходен с соматотропином (гормоном роста) и пролактином. Содержание его увеличивается во II триместре беременности, достигает максимума к 36-й неделе и снижается к родам. Уровень плацентарного лактогена в крови беременной четко коррелирует с массой плода и плаценты, числом плодов. Этот гормон способствует обеспечению плода глюкозой (так называемое диабетогенное действие беременности), увеличению содержания в крови беременной холестерина — основного предшественника прогестерона и эстрогенов, секретируемых плацентой. Плацентарный лактоген выводится почками беременной, нарушение их функции может привести к понижению его уровня в моче.
Продуктом жизнедеятельности плода является α-фетопротеингликопротеин, синтезирующийся до 12 нед. беременности в желточном мешке плода, а после 12 нед. в его печени. Считают, что α-фетопротеин является белковым носителем стероидных гормонов в крови плода. Его содержание в крови плода достигает максимума к 14—16 нед. беременности, после чего постепенно снижается. По мере увеличения срока беременности трансплацентарный переход α-фетопротеина в кровь беременной возрастает, наиболее высокий уровень его в крови беременной определяется в 32—34 нед. беременности. Повышение уровня α-фетопротеина в крови беременной и околоплодных водах наблюдается при пороках развития плода, особенно часто при нарушении развития центральной нервной системы.
С первых недель беременности в ворсинах хориона начинает синтезироваться хорионический гонадотропин. Секреция его быстро увеличивается, достигая максимума к 12 нед. беременности, а затем снижается и остается на низком уровне до ее окончания.
Методы исследования функционального состояния фетоплацентарной системы в современной акушерской клинике многообразны. Наиболее информативно комплексное обследование и сравнение показателей, полученных разными методами.
Важное значение имеет определение концентрации гормонов Ф. с. в крови и моче беременной. Уровни эстриола и α-фетопротеина расценивают как показатели состояния плода плацентарного лактогена и прогестерона — как показатели функции плаценты. Наибольшее распространение получило определение количества эстриола в крови и моче беременной, снижение его является ранним показателем нарушения состояния плода, обнаруживается за 2—3 нед. до клинических проявлений. Содержание хорионического гонадотропина, строго говоря, не является показателем функции Ф. с., поскольку к моменту формирования плаценты (12—14 нед. беременности) секреция его резко снижается. Уровень этого гормона в крови и моче позволяет судить о развитии плаценты на ранних этапах беременности. В современном акушерстве иммунологический метод определения хорионического гонадотропина используют для ранней диагностики беременности, а также при динамическом наблюдении за результатами терапии трофобластической болезни (Трофобластическая болезнь).
Для изучения маточно-плацентарного кровотока после 32 нед. беременности можно проводить динамическую сцинтиграфию (Сцинтиграфия) плаценты с использованием короткоживущих радионуклидов. При этом оценивают время заполнения радионуклидом сосудов матки и межворсинчатого пространства, объемную скорость кровотока в межворсинчатом пространстве и маточно-плацентарном бассейне, емкость различных отделов этого бассейна.
Исследовать кровоток в сосудах плода, пуповины и в маточных артериях позволяет допплерография.
Важная информация о состоянии плаценты и плода может быть получена с помощью ультразвукового исследования (см. Ультразвуковая диагностика, в акушерстве и гинекологии). На основании исследования величины и структуры плаценты могут быть выявлены ее гипо- и гиперплазия, несоответствие степени зрелости плаценты сроку беременности, кисты, отложения фибрина и кальция, воспалительные изменения. Определение размеров плода с помощью ультразвука лежит в основе диагностики гипотрофии плода. Изучение двигательной активности и дыхательных движений плода помогает судить о его функциональном состоянии. Кроме того, ультразвуковое исследование позволяет обнаружить пороки развития плода, оценить количество околоплодных вод и др. Ультразвуковое исследование рекомендуется проводить не менее трех раз на протяжении беременности (в I, II и III триместрах) с внесением его результатов в обменную карту (Обменная карта).
После 32 нед. беременности необходимым элементом исследования Ф. с. является оценка сердечной деятельности плода с помощью электрокардиографии, фонокардиографии и кардиотокографии (см. Плод). Большое значение для выявления хронической гипоксии плода имеют бесстрессовый тест и функциональные пробы — стрессовые тесты (см. Гипоксия плода).
Нарушение функции фетоплацентарной системы (фетоплацентарная, или плацентарная, недостаточность) — расстройство эндокринной и метаболической функции плаценты, обусловленное патологическими изменениями в организме беременной и приводящее к нарушению жизнедеятельности и развития плода. Различают первичную и вторичную фетоплацентарную недостаточность. К первичной (ранней) относят фетоплацентарную недостаточность, возникающую в первые 14—16 нед. беременности под влиянием различных факторов, нарушающих процессы имплантации и формирования плаценты: гинекологических заболеваний, приводящих к неполноценности эндометрия (эндометрит, гипофункция яичников и др.), наследственной патологии и изменений генетического кода, экстрагенитальных заболеваний, способствующих ухудшению васкуляризации миометрия и децидуальной оболочки матки (заболевания сердечно-сосудистой и эндокринной систем, почек, крови и др.), хронических и острых инфекционных заболеваний, производственных вредностей и др. Первичная фетоплацентарная недостаточность клинически может проявиться угрозой прерывания беременности или самопроизвольным выкидышем (см. Аборт) в ранние сроки беременности, способствует формированию пороков развития плода и его инфицированию, В некоторых случаях первичная фетоплацентарная недостаточность переходит во вторичную.
Вторичная (поздняя) фетоплацентарная недостаточность выявляется во II и III триместрах беременности, причинами ее, помимо перечисленных выше материнских факторов, могут быть акушерские осложнения, например поздние Токсикозы беременных, инфаркты плаценты, Преждевременная отслойка плаценты, Предлежание плаценты.
По клиническому течению выделяют острую и хроническую фетоплацентарную недостаточность. Острая фетоплацентарная недостаточность характеризуется быстро протекающим нарушением маточно-плацентарного кровообращения (преждевременная отслойка или обширный инфаркт плаценты), приводящим, как правило, к гибели плода (см. Внутриутробная смерть плода) вследствие острой гипоксии и к прерыванию беременности. Хроническая фетоплацентарная недостаточность встречается значительно чаще, может возникать во II триместре беременности и протекать длительно. В зависимости от состояния компенсаторно-приспособительных реакций ее делят на относительную и абсолютную. При относительной (компенсированной) хронической фетоплацентарной недостаточности жизнедеятельность плода поддерживается за счет компенсаторно-приспособительных изменений в плаценте на тканевом (увеличение числа резорбционных ворсин и капилляров в концевых ворсинах, образование синцитиальных узелков и др.), клеточном и субклеточном уровнях. При абсолютной (декомпенсированной) недостаточности в плаценте преобладают дегенеративные изменения, компенсаторно-приспособительные реакции на тканевом уровне отсутствуют.
В развитии хронической фетоплацентарной недостаточности основными и нередко первоначальными являются нарушения плацентарного кровотока, обычно сочетанные. К ним относят уменьшение притока крови к плаценте вследствие артериальной гипотензин или спазма маточных сосудов на фоне артериальной гипертензии у беременной; затруднение оттока венозной крови от плаценты при повышении тонуса матки; выключение из кровообращения отдельных участков плаценты в связи с ее инфарктом, отслойкой или отеком; нарушение капиллярного кровотока в ворсинах плаценты вследствие инфицирования, воздействия тератогенных факторов; изменение реологических свойств крови беременной и плода.
Основными клиническими проявлениями хронической фетоплацентарной недостаточности являются, хроническая гипоксия плода и его гипотрофия, или синдром задержки роста. Различают три степени гипотрофии плода: I степень — задержка роста плода не более чем на 2 нед., II степень — на 2—4 нед., Ill степень — более чем на 4 нед. Кроме того, выделяют симметричную и асимметричную гипотрофию плода. При симметричной гипотрофии плода (гармонический тип гипотрофии), которая развивается обычно с ранних сроков беременности, все размеры плода равномерно уменьшены, масса плода снижена пропорционально его длине. При асимметричной гипотрофии (дисгармонический тип гипотрофии), возникающей, как правило, в III триместре беременности, размеры плода уменьшены непропорционально, может быть снижена его масса при нормальной длине.
Диагноз хронической фетоплацентарной недостаточности основывается на выявлении признаков нарушения жизнедеятельности плода (гипоксии) и задержки его роста с помощью перечисленных выше методов исследования Ф. с. Задачей акушера-гинеколога женской консультации является своевременное выявление беременных с высоким риском развития хронической фетоплацентарной недостаточности (угроза прерывания беременности, экстрагенитальные заболевания, изосерологическая несовместимость крови беременной и плода, токсикозы беременных, миома матки, гипотрофия плода при предшествующих беременностях), а также беременных с клиническими проявлениями этой недостаточности, и направление их в специализированные учреждения для уточнения диагноза выработки тактики ведения беременности и проведения лечения.
Основными принципами ведения беременности при хронической фетоплацентарной недостаточности являются комплексное лечебное воздействие, направленное на ведущие звенья ее патогенеза; обеспечение адекватного контроля (Врачебный контроль) за состоянием беременной и плода; своевременное и бережное родоразрешение.
Для улучшения маточно-плацентарного и плодово-плацентарного кровотока применяют β-адреномиметики, сигетин, антитромботические и реологически активные средства, сердечные гликозиды. Лечебный эффект β-адреномиметиков (партусистена, ритодрина) обусловлен снижением тонуса матки и амплитуды (но не частоты) сокращений миометрия; расслаблением и расширением периферических сосудов (артериол и венул) со снижением периферического сосудистого сопротивления и диастолического АД; учащением частоты сердечных сокращений без существенного снижения систолического АД.
Сигетин оказывает слабое эстрогенное действие на матку и сосуды плаценты, стимулирует образование новых сосудов в концевых ворсинах плаценты, усиливает кровоток в ней.
В качестве антитромботических и реологически активных средств используют низкомолекулярные декстраны, гепарин, пентоксифиллин, ксантинола никотинат, дипиридамол. Низкомолекулярные декстраны (реополиглюкин, реоглюман) вводят внутривенно капельно по 200—400 мл ежедневно или через день под контролем АД, диуреза и функциональной активности тромбоцитов. Гепарин, прямой антикоагулянт, применяют для предупреждения повышенного потребления факторов свертывания крови с отложением фибриноида в межворсинчатом пространстве, характерного для фетоплацентарной недостаточности на фоне хронической формы синдрома диссеминированного внутрисосудистого свертывания крови. Пентоксифиллин (трентал) оказывает антиагрегантное действие, повышает энергетический потенциал клеток, увеличивает способность эритроцитов к деформации (благодаря чему они проходят даже через патологически измененные, стенозированные сосуды), снижает вязкость и повышает текучесть крови, при внутривенном введении дает легкий сосудорасширяющий эффект. Ксантинола никотинат (теоникол) — комбинированный препарат теофиллина и никотиновой кислоты — наряду с антиагрегантным оказывает сосудорасширяющее действие. Дипиридамол (курантил) схож по действию с ксантинола никотинатом и пентоксифиллином, однако практически не вызывает сосудистых эффектов, лучше переносится, но обладает меньшим реологическим и антиагрегантным потенциалом.
Сердечные гликозиды (коргликон, дигоксин, дигитоксин) улучшают гемодинамику у матери и плода за счет увеличения ударного объема сердца при снижении частоты сердечных сокращений.
Для улучшения нарушенного маточно-плацентарного кровотока помимо лекарственных средств может быть использована физиотерапия, чрескожная электронейростимуляция в паравертебральной зоне на уровне Х—XII грудных позвонков, воздействие электромагнитными волнами дециметрового диапазона на область проекции плаценты. Эти методы эффективны, как правило, при отсутствии грубых органических изменений в плаценте.
Необходимым компонентом лечения хронической фетоплацентарной недостаточности являются рациональное питание беременной и назначение препаратов преимущественно метаболического действия.
Следует отметить, что возможности фармакотерапии хронической фетоплацентарной недостаточности небезграничны и поэтому даже в случае положительной динамики необходимо родоразрешение при достижении срока доношенной (38 нед.) беременности. При отсутствии эффекта от терапии, тем более при ухудшении состояния плода, родоразрешение показано даже при недоношенной беременности. В связи с высоким риском гибели плода и новорожденного родоразрешение при фетоплацентарной недостаточности должно проводиться в специализированных родовспомогательных учреждениях, имеющих отделения функциональной диагностики, реанимации и интенсивной терапии новорожденных
При недоношенной беременности, гипотрофии плода I—II степени (если отсутствуют другие отягощающие акушерские и экстрагенитальные факторы) предпочитают консервативное родоразрешение с применением в родах лекарственных средств кратковременного действия, улучшающих состояние плода: сигетина, кокарбоксилазы, АТФ, глюкозы. При метаболическом ацидозе вводят растворы гидрокарбоната натрия. Обязателен мониторный контроль за сердечной деятельностью плода (после излития околоплодных вод датчик накладывают на головку плода). В случае ухудшения состояния плода необходимо своевременно решить вопрос об окончании родов путем кесарева сечения (Кесарево сечение) (в I периоде родов) или с помощью акушерских щипцов (Акушерские щипцы) (во II периоде родов). При резко выраженной гипотрофии плода (задержка роста более чем на 6 нед.), а также при недоношенной беременности, если развитие плода соответствует сроку беременности 32 нед. и менее, более бережным является родоразрешение путем кесарева сечения до начала родовой деятельности со вскрытием полости матки в нижнем сегменте продольным разрезом.
Раннее адекватное лечение хронической фетоплацентарной недостаточности и своевременное бережное родоразрешение позволяют существенно снизить перинатальную смертность.
Профилактика фетоплацентарной недостаточности включает санацию очагов инфекции в организме женщины до и во время беременности, исключение вредных воздействий на плод (алкоголь, курение, применение лекарственных средств без рекомендации врача и др.) Важное значение имеет диспансерное наблюдении за беременными с высоким риском развития фетоплацентариой недостаточности в условиях женской консультации и проведение профилактических мероприятий: полноценное питание, богатое белком и витаминами; диатермия околопочечной области и УФ-облучение (по 10 сеансов, процедуры рекомендуется чередовать), назначение лекарственных средств по показаниям (внутривенное вливание 20 мл 40% раствора глюкозы с 0,5 мл 0,06% раствора коргликона, внутримышечные инъекции кокарбоксилазы, внутрь пентоксифиллин, эуфиллин, препараты железа и др.).
Библиогр.: Актуальные проблемы перинатологии, под ред. Е.М. Вихляевой, с. 134, М., 1982; Браун Д. и Диксон Г. Антенатальная охрана плода, пер. с англ., М., 1982; Демидов В.Н. и др. Недостаточность фетоплацентарной системы, М., 1983; Кирюшенков Д.П. и Тараховский М.Л. Влияние лекарственных средств, алкоголя и никотина на плод, М., 1990; Серов В.Н., Стрижаков А.Н. и Маркин С.Д. Практическое акушерство, с. 233, М., 1989.
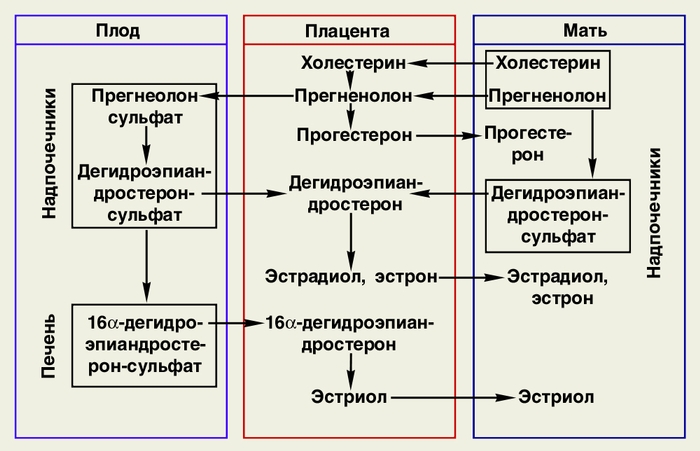
Схема основных этапов синтеза эстрогенов и прогестерона в фетоплацентарной системе.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.