- ОСМОС
-
(от греч. osmos - толчок, давление) - самопроизвольный переход вещества через полупроницаемую перегородку(мембрану), разделяющую два раствора разл. концентрации или раствор и чистыйрастворитель. О. приближает систему к равновесию путём выравнивания концентрацийпо обе стороны перегородки. Он обусловлен понижением химического потенциала в присутствии растворённого вещества. Стремясь к выравниванию хим. потенциалов всех своих частей, система переходит в состояние с более низкимуровнем свободной энергии при осмотпч. переносе вещества.
Наиб. важный случай О. - переход молекулчистого растворителя в раствор через полупроницаемую перегородку, не пропускающуюмолекулы растворённого вещества. В этом случае происходит переход молекулиз чистого растворителя в раствор, концентрация к-рого при этом понижается. В общем случае двух растворов А и В разной концентрации (концентрацияраствора А больше, чем В )возникает поток вещества от А к В. Этот поток можно предотвратить, если повысить давление в растворе В, причём разность давлений по обе стороны перегородки при этих условиях наз. осмотическим давлением, а достигнутое термодинамич. равновесие - осмотич. равновесием. Значение
по обе стороны перегородки при этих условиях наз. осмотическим давлением, а достигнутое термодинамич. равновесие - осмотич. равновесием. Значение 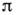 зависит от состава раствора и темп-ры и для разбавленных и идеальных растворовне зависит от растворённых веществ, а определяется лишь числом "кинетич. элементов" - атомов, ионов, молекул - в единице объёма раствора.
зависит от состава раствора и темп-ры и для разбавленных и идеальных растворовне зависит от растворённых веществ, а определяется лишь числом "кинетич. элементов" - атомов, ионов, молекул - в единице объёма раствора.
Если А - чистый растворитель, а В - идеальный раствор неэлектролита (недиссоциирующего вещества),то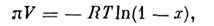
где V - молярный объём растворителя, х - мольная доля растворённого вещества. Для разбавленных растворов( х
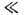 1)неэлектролитов
1)неэлектролитов 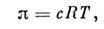
где с - молярность раствора. Изэтого ур-ния (ур-ния состояния Вант-Гоффа), совпадающего по форме с ур-ниемБойля - Мариотта для идеального газа, следует, что
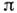 численно равно парциальному давлению, к-рое оказывало бы растворённое веществов состоянии идеального газа при той же темп-ре, занимая объём, равный объёмураствора. Для разбавленных растворов электролитов
численно равно парциальному давлению, к-рое оказывало бы растворённое веществов состоянии идеального газа при той же темп-ре, занимая объём, равный объёмураствора. Для разбавленных растворов электролитов 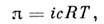
где i= l+
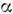 (v- 1),
(v- 1),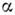 - степень диссоциации, v - число ионов, на к-рое распадается молекулаэлектролита; коэф. i наз. коэффициентом Вант-Гоффа.
- степень диссоциации, v - число ионов, на к-рое распадается молекулаэлектролита; коэф. i наз. коэффициентом Вант-Гоффа.
Растворы с одинаковым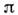 наз. изотоническими (изоосмотическими). Так, кровезаменители и физиологич. растворы должны быть изотоничны по отношению к жидкостям организма. Еслираствор имеет относительно др. раствора более высокое осмотич. давление, то он наз. гипертоническим, при обратном соотношении - гипотоническим.
наз. изотоническими (изоосмотическими). Так, кровезаменители и физиологич. растворы должны быть изотоничны по отношению к жидкостям организма. Еслираствор имеет относительно др. раствора более высокое осмотич. давление, то он наз. гипертоническим, при обратном соотношении - гипотоническим.
Осмотич. давление измеряют с помощью осмометров. Различают статич. и динамич. методы измерений. Первый основан на измеренииизбыточного гидростатич. давления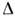 . повысоте столба жидкости Н в трубке осмометра (рис.) после установленияосмотич. равновесия и при равенстве внеш. давлений в камерах А и Б. Второй метод основан на измерении скорости всасывания и выдавливаниярастворителя при разл. значениях
. повысоте столба жидкости Н в трубке осмометра (рис.) после установленияосмотич. равновесия и при равенстве внеш. давлений в камерах А и Б. Второй метод основан на измерении скорости всасывания и выдавливаниярастворителя при разл. значениях 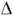 . споследующей интерполяцией полученных данных к v =0 и
. споследующей интерполяцией полученных данных к v =0 и  В качестве мембраны обычно применяют плёнки из целлофана, полимеров, пористыекерамич. и стеклянные перегородки.
В качестве мембраны обычно применяют плёнки из целлофана, полимеров, пористыекерамич. и стеклянные перегородки.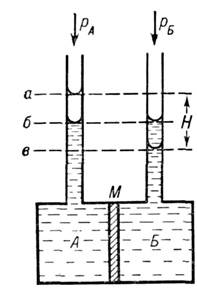
Схема осмометра: А - камера с раствором, Б - камера с растворителем, М- мембрана; уровни жидкостив трубках при осмотическом равновесии: а и в - в условияхравенства внешних давлений в камерах А и Б (столб жидкости Н уравновешивается
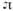 ); б- в условиях, когда
); б- в условиях, когда 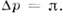
О. играет большую роль в тканях растенийи животных, способствуя оводнению клеток и межклеточных структур, его используютдля очистки высокомолекулярных соединений от низкомолекулярных примесей. Осн. приложеиие осмометрии - определение мол. массы полимеров.
Лит.: Курс физической химии, подред. Я. И. Герасимова, 2 изд., т. 1 - 2, М., 1969 - 73.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.