LITHIUM
Le lithium est un métal blanc et brillant lorsqu’il est fraîchement coupé. Il a été découvert, en 1817, par Johann August Arfvedson dans un silicate d’aluminium naturel: le pétalite. Jöns Jacob Berzelius donna au nouvel élément, de numéro atomique Z = 3, le nom de lithion (du grec晴礼﨟, pierre) pour rappeler son origine minérale. C’est le plus léger de tous les éléments métalliques: sa densité est de 0,534; il fond à 180 0C et bout à 1 330 0C.
Comme l’indique sa structure électronique fondamentale 1 s 2 2 s 1, il appartient au sous-groupe IA de la classification périodique des éléments; il est le premier terme de la famille des métaux alcalins. Les propriétés fondamentales de ces éléments sont liées à la présence d’un seul électron périphérique ns 1 surmontant une couche très stable de type 2 (Li) ou 2-6 (Na, K, Rb, Cs): ce sont tous des éléments monovalents, dotés d’un rayon atomique important, très électropositifs, extrêmement réactifs et qui donnent essentiellement des liaisons ioniques. Le lithium, tout en possédant les propriétés caractéristiques de la famille à laquelle il appartient, se singularise par la position particulière qu’il y occupe et présente, en vertu de la règle des analogies diagonales dans le tableau périodique, de nombreux points communs avec le magnésium et les alcalino-terreux. Ce comportement particulier du lithium est dû au fait que Li+ est, parmi les cations alcalins, celui qui possède le rayon le plus petit, donc le rapport charge-taille le plus élevé, ce qui lui confère un pouvoir polarisant important (tabl. 1). Le pouvoir polarisant du cation Li+ est, entre autres, responsable de l’apparition d’un caractère covalent dans les combinaisons organiques et minérales du lithium – alors que celles des alcalins supérieurs sont typiquement ioniques –, de la formation d’hydrates et de complexes en solution, et des très grandes différences de solubilité des sels de lithium par rapport à ceux de potassium, de rubidium et de césium.
Le lithium s’apparente aussi à certains métaux de transition par la faible valeur de son rayon ionique; il peut ainsi se substituer à ces métaux dans des oxydes mixtes tels que les spinelles, par exemple.
État naturel et extraction
Le lithium n’entre que pour 0,003 à 0,005 p. 100 dans la composition de l’écorce terrestre, et les minéraux titrant plus de 2 p. 100 en oxyde Li2O sont rares: l’extraction du lithium est une opération longue et coûteuse. Les principaux minerais sont des silicates comme le feldspathoïde pétalite
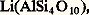
le mica lépidolite
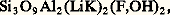
et surtout le pyroxène triphane, ou spodumène

ou des phosphates comme l’amblygonite
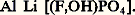
Les principaux gisements de spodumène se trouvent en ex-U.R.S.S., au Zimbabwe et en Chine. Les autres pays producteurs de lithium sont l’Australie, le Chili, le Brésil et différents États africains. Les minerais sont attaqués à chaud par l’acide sulfurique concentré. Le triphane, qui est le minerai le plus abondant, doit être calciné au préalable à 1 100 0C pour être facilement attaqué, la forme naturelle dite 見 se transforme en une phase dite 廓 de structure différente moins dense (d = 2,4 au lieu de 3,2); dans ces conditions, les ions H+ de l’acide se substituent aux ions Li+ du minerai qui passent ainsi en solution sans qu’il soit nécessaire de solubiliser l’aluminium. Le lithium est séparé sous forme de carbonate Li2C3. La purification des sels de lithium se fait soit par précipitation répétée d’une combinaison soluble (carbonate, phosphate, fluorure), soit par dissolution sélective du chlorure dans l’éthanol.
La préparation du métal se fait exclusivement par électrolyse du chlorure de lithium fondu, additionné de chlorure de potassium. Le métal brut qui se dépose sur la cathode de fer est purifié des autres alcalins qu’il contient par distillation moléculaire. Le lithium peut être manipulé à l’air, comme les métaux alcalino-terreux, mais doit être conservé dans une huile minérale.
Propriétés physiques
Le lithium naturel est un mélange des isotopes 6Li et 7Li, contenant environ 12 p. 100 de 6Li. La séparation isotopique, basée sur la différence de mobilité des ions 6Li+, est effectuée par électromigration en contre-courant, dans un bain de bromure de lithium fondu. L’isotope 6Li, associé au deutérium et au tritium, est un élément essentiel pour les réactions de fusion thermonucléaire.
Le lithium cristallise dans le système cubique centré. Son faible poids atomique (M = 6,94) et son rayon atomique relativement important font de lui le plus léger des solides: il flotte sur le pétrole. Le lithium est le plus dur des métaux alcalins; il demeure, toutefois, un métal mou, puisqu’il est rayé par le plomb et se coupe facilement au couteau. Ses propriétés thermiques rapprochent le lithium du magnésium (tabl. 1). Les principales constantes physiques du lithium sont données au tableau 2.
En raison de la très faible valeur de son rayon atomique, le lithium n’est pas miscible aux autres métaux alcalins. Le lithium, comme tous les éléments IA et IIA, est soluble dans l’ammoniac liquide (12 g de Li/100 g NH3 à 漣 45 0C); la solution, qui est instable, laisse dégager peu à peu de l’hydrogène, alors que le métal passe à l’état d’amidure LiNH2. Le lithium se dissout également dans les amines.
Propriétés chimiques
Le lithium possède, vis-à-vis de nombreux corps (oxygène, eau, halogènes), une réactivité plus faible que celle des alcalins supérieurs, alors qu’au contraire il donne des combinaisons plus stables avec certains autres (hydrogène, carbone, azote). Ce comportement chimique n’est pas sans rappeler celui du magnésium.
Le lithium est le seul métal alcalin qui peut être manipulé à l’air sans danger, alors que les autres s’oxydent avec, le plus souvent, inflammation. À l’air sec, le lithium se recouvre lentement d’une pellicule d’oxyde et de nitrure. À l’air humide, l’attaque, catalysée par la vapeur d’eau, est beaucoup plus rapide. Le métal ne s’enflamme dans l’oxygène sec qu’au-dessus de 200 0C en donnant l’oxyde Li2O et non le peroxyde, propriété qui le différencie nettement de ses homologues supérieurs et le rapproche des alcalino-terreux.
La combustion du lithium est très exothermique et s’accompagne de l’émission d’une intense lumière blanche comme le magnésium. Le péroxyde Li22 ne peut être obtenu qu’à partir d’eau oxygénée. Les oxydes de lithium sont de couleur blanche.
Le lithium réduit l’eau à la température ambiante, avec formation d’hydroxyde de lithium ou lithine LiOH et dégagement d’hydrogène, mais la réduction est moins vive que pour les autres alcalins et se fait sans inflammation de l’hydrogène. La lithine fond à 473 0C et se décompose dès la température de 700 0C en Li2O et vapeur d’eau; ce fait différencie à nouveau le lithium de ses homologues supérieurs dont les hydroxydes MOH sont stables jusqu’aux points d’ébullition et le rapproche des éléments IIA. La lithine en solution aqueuse est une base forte.
Le lithium réduit également un grand nombre d’oxydes. La silice est réduite dès la température de fusion du métal; la réaction qui est fortement exothermique interdit la manipulation du lithium liquide dans des appareils en verre.
Comme tous les alcalins, le lithium se combine à l’hydrogène pour donner un hydrure salin LiH à structure du type NaCl, dans lequel l’hydrogène se comporte comme un élément électronégatif. La liaison métal-hydrogène dans LiH, contrairement aux autres hydrures salins, est plus covalente qu’ionique, de plus LiH est très stable thermiquement et fond sans se décomposer vers 700 0C. LiH est un composé très important du lithium; il permet la préparation de nombreux hydrures dont LiAlH4, réducteur puissant très utilisé en chimie organique en raison de son action spécifique sur certaines fonctions.
Au contact du fluor, le lithium s’enflamme dès la température ambiante; il faut, au contraire, chauffer pour le voir brûler dans le chlore, le brome et l’iode à l’état gazeux.
Le soufre et le lithium réagissent violemment à chaud pour donner le sulfure Li2S et des polysulfures; le système binaire Li-S ne montre toutefois pas la même richesse de combinaisons que celle observée avec le potassium, par exemple. Le phosphore produit avec le lithium un phosphure qui, au contact de l’eau, dégage de l’hydrogène phosphoré spontanément inflammable. L’azote réagit lentement dès la température ambiante; la formation du nitrure Li3N est quantitative au-dessus de 500 0C.
Le carbone s’unit directement à chaud pour donner un carbure ionique Li2C2, de couleur blanche, qui est un réducteur énergique. Moins stable thermiquement que CaC2, le carbure de lithium présente, néanmoins, de nombreuses analogies avec les carbures alcalino-terreux: il réagit sur l’eau à froid avec dégagement d’acétylène, et à chaud sur l’ammoniac avec formation de cyanamide Li2C2. L’action de l’acétylène sur une solution de lithium dans l’ammoniac liquide conduit au monoacétylure Li 漣C 令C 漣H.
La combinaison du lithium avec les dérivés halogénés organiques en solution dans l’éther de pétrole, un éther-oxyde ou le benzène anhydre donne naissance à une famille de composés organométalliques importants: les organolithiens Li 漣R (R: méthyle, éthyle, phényle, etc.). La synthèse se fait avec d’excellents rendements, car la réaction de Wurtz, qui conduit au doublement du radical R, est lente dans le cas du lithium et demeure négligeable. La réactivité des organolithiens est intermédiaire entre celle des dérivés sodés et celle des dérivés magnésiens. Les dérivés organométalliques du lithium se distinguent de ceux des autres alcalins par leur solubilité plus grande dans les solvants organiques et une grande facilité de préparation et d’emploi.
En raison de la petite taille du cation Li+, les sels de lithium présentent, par rapport à ceux des autres alcalins, des différences de solubilité importantes. Le tableau 3 montre, par exemple, que Li+ peut être précipité sous forme de fluorure ou de carbonate, alors que les sels de potassium correspondants sont assez solubles et qu’au contraire Li+ ne peut pas être précipité par l’ion perchlorate Cl4-, réactif habituel de précipitation du potassium. Cette différence de comportement rapproche le lithium du magnésium qui se singularise également dans le groupe IIA. Ainsi, ni Li+ ni Mg2+ ne peuvent être précipités par l’ion sulfate S42-, alors que BaS4 est un des sels les moins solubles dans l’eau de la chimie minérale.
Applications
Le lithium est, après le sodium, le métal alcalin qui reçoit le plus d’applications. L’hydrure est utilisé comme source d’hydrogène et très employé en chimie organique comme agent réducteur sous la forme LiAlH4. Les organolithiens sont préférés aux organomagnésiens pour certaines synthèses: préparation de plusieurs dérivés organométalliques, par exemple. La physique fait appel à des monocristaux de composés de lithium (LiF). La mise en œuvre de l’explosif thermonucléaire repose largement sur l’emploi des combinaisons deutériées et tritiées de l’isotope 6Li, car le lithium est un des éléments qui peuvent subir la fusion nucléaire avec libération d’énergie. C’est donc un élément de choix pour l’énergie atomique. En métallurgie, des cartouches de lithium pur sont utilisées pour dégazer, désoxyder ou désulfurer des bains de métaux liquides. On l’utilise également pour durcir certains alliages de plomb.
La forme 廓 du spodumène a un coefficient de dilatation thermique extrêmement faible, ce qui en fait un matériau intéressant pour les céramiques devant résister aux chocs thermiques.
lithium [ litjɔm ] n. m.
• 1839; lat. mod. lithion, créé par Berzelius (1818)
♦ Chim. Élément atomique (Li; no at. 3; m. at. 6,94), le premier des métaux alcalins. Le lithium, blanc argenté, est le plus léger de tous les métaux. Minerai de lithium. ⇒ lépidolite. Les sels de lithium sont utilisés dans le traitement de la psychose maniaque dépressive. Être sous lithium.
● lithium nom masculin (latin scientifique lithion, du grec lithos, pierre) Métal alcalin, le plus léger de tous les métaux. (Élément de symbole Li.) Numéro atomique : 3 Masse atomique : 6,941 Température de fusion : 180,54 °C Masse volumique : 0,53 g°cm3
lithium
n. m. CHIM élément alcalin (symbole Li) de numéro atomique Z = 3.
— Métal (Li), surtout utilisé pour l'élaboration d'alliages antifriction.
— Sels de lithium, utilisés en médecine dans le traitement des états maniaco-dépressifs.
⇒LITHIUM, subst. masc.
CHIM. Corps simple, le plus léger de tous les métaux connus, de couleur blanc argenté, utilisé dans la fabrication d'alliages et de produits pharmaceutiques (symb. Li). Dans ce boro-silicate complexe, c'est certainement le lithium qui empourpre magnifiquement la variété rose appréciée, la rubellite (METTA, Pierres préc., 1960, p. 86). En 1930, W. Bothe et H. Becker montrèrent qu'un certain nombre de noyaux légers, le béryllium, le lithium et le bore principalement, émettaient un rayonnement très pénétrant quand ils étaient bombardés par les rayons (...) du polonium (Hist. gén. sc., t. 3, vol. 2, 1964, p. 344).
Prononc. et Orth. : [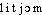 ]. Att. ds Ac. 1935. Étymol. et Hist. 1824 (NYSTEN). Du lat. sc. mod. lithion (1818, ARFWEDSON et BERZÉLIUS, v. COTTEZ et NED), de l'élém. formant litho- (gr.
]. Att. ds Ac. 1935. Étymol. et Hist. 1824 (NYSTEN). Du lat. sc. mod. lithion (1818, ARFWEDSON et BERZÉLIUS, v. COTTEZ et NED), de l'élém. formant litho- (gr.  (
( )-) « pour rappeler qu'il a été découvert dans le règne minéral », francisé avec le suff. -ium.
)-) « pour rappeler qu'il a été découvert dans le règne minéral », francisé avec le suff. -ium.
 ]. Att. ds Ac. 1935. Étymol. et Hist. 1824 (NYSTEN). Du lat. sc. mod. lithion (1818, ARFWEDSON et BERZÉLIUS, v. COTTEZ et NED), de l'élém. formant litho- (gr.
]. Att. ds Ac. 1935. Étymol. et Hist. 1824 (NYSTEN). Du lat. sc. mod. lithion (1818, ARFWEDSON et BERZÉLIUS, v. COTTEZ et NED), de l'élém. formant litho- (gr.  (
( )-) « pour rappeler qu'il a été découvert dans le règne minéral », francisé avec le suff. -ium.
)-) « pour rappeler qu'il a été découvert dans le règne minéral », francisé avec le suff. -ium.
lithium [litjɔm] n. m.
ÉTYM. 1839; lat. mod. lithion, créé par Berzelius (1818), du grec lithos « pierre ». → Lith-.
❖
♦ Chim. Corps simple (symb. Li), métal alcalin d'un blanc argenté, le plus léger de tous les solides (no at. 3). || Minerai de lithium. ⇒ Lépidolithe. || Emploi industriel et pharmaceutique des sels de lithium. || Batterie au lithium. || Oxyde de lithium. ⇒ Lithine.
❖
DÉR. et COMP. Lithémie, lithine.
Encyclopédie Universelle. 2012.