SOLVANTS
Un solvant est un liquide dans lequel on introduit une ou plusieurs substances – les solutés – de manière à constituer une phase homogène: la solution . Le solvant est donc défini non par sa structure chimique, mais par son état physique – l’état liquide – et par l’usage qui en est fait; il existe ainsi une variété infinie de solvants: l’eau, les composés organiques simples et liquides à la température ambiante (alcools, acides, hydrocarbures, etc.) sont les plus classiques, mais des gaz condensés ou sous pression, comme l’ammoniac ou le dioxyde de carbone, et des sels fondus (par exemple la cryolithe, liquide à plus de 1 000 0C) sont également utilisés comme solvants.
Milieux réactionnels et agents d’extraction dans l’industrie, supports pour le transport et la mise en œuvre des peintures, encres, parfums, aérosols, agents de nettoyage, les solvants ont envahi toutes les activités; ils sont, de ce fait, accusés de bien des pollutions. Cependant, un usage de plus en plus spécifique et mieux contrôlé, des opérations de recyclage les rendent de plus en plus discrets tout en élargissant leur rôle, pour longtemps encore indispensable.
Classification
Les propriétés physiques conduisent à une première distinction entre solvants moléculaires et solvants ionisés. Les composés organiques constituent, comme l’eau, des solvants moléculaires : ils sont constitués de molécules électriquement neutres et présentent, à l’état pur, une conductivité faible. Les solvants ionisés sont formés principalement d’anions et de cations reliés par des attractions électrostatiques et sont bons conducteurs: c’est le cas des sels fondus.
Les solvants moléculaires sont généralement classés à partir de la valeur de leur constante diélectrique ( 﨎) et du moment dipolaire de leur molécule ( 猪) qui définissent à la fois la nature des espèces susceptibles de s’y dissoudre et les modes d’interaction soluté-solvant (cf. tableau).
Comment fonctionne un solvant?
La mise en solution d’un composé résulte d’un ensemble complexe d’interactions entre molécules de solvant et molécules (ou ions) en solution: c’est la solvatation .
Les interactions électrostatiques sont assimilables à des interactions ion-dipôle (avec un soluté ionique) ou dipôle-dipôle (avec un soluté moléculaire, caractérisé par son moment dipolaire).
Par ailleurs, un solvant est un diélectrique, dont la constante diélectrique 﨎 fixe le pouvoir de dissociation des espèces ionisées; celles-ci sont dissociées ( 﨎 grand) ou sous forme de paires d’ions ( 﨎 petit).
Les interactions spécifiques sont liées à la nature chimique du solvant. Ce sont de véritables liaisons chimiques entre soluté et solvant. Les liaisons hydrogène sont spécifiques des solvants protiques (susceptibles d’échanger des ions H+), comme l’eau, les alcools, les acides carboxyliques, les amides. Elles constituent des liaisons d’énergie relativement faible, entre l’hydrogène du solvant et un atome du soluté donneur de doublet électronique ou entre les molécules du solvant (qui est dit alors associé).
Plus fréquentes que les liaisons hydrogène, les liaisons de caractère donneur-accepteur du doublet électronique (réactions «acide-base», au sens de Lewis) sont mises en œuvre entre solvants donneurs (comme le diméthylsulfoxyde, les alcools, l’eau) et solutés accepteurs ou entre solvants accepteurs (acides carboxyliques, eau, etc.) et solutés donneurs. C’est cet ensemble de propriétés qui gouverne la miscibilité des solvants entre eux et leur aptitude à dissoudre des composés moléculaires ou ioniques.
La mise en solution fait également intervenir la réactivité chimique du solvant lui-même: c’est le phénomène de solvolyse , particulièrement important lorsque le solvant peut se dissocier selon un équilibre d’autodissociation.
Un solvant protique, symbolisé par HS, se dissocie légèrement suivant l’équilibre de solvolyse:
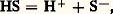
caractérisé par une constante d’autoprotolyse. On conçoit que, dans un tel solvant, toute espèce susceptible de fixer ou de céder des protons (c’est-à-dire ayant des propriétés basiques ou acides au sens de Johannes Brönsted – cf. ACIDES ET BASES) participe à cette solvolyse.
L’hydrolyse, qui caractérise la solvolyse de l’eau, limite le domaine de pH accessible, mais un changement de solvant permet d’élargir, de diminuer ou encore de déplacer considérablement ce domaine. Dans les solvants aprotiques, la solvolyse conduit à l’échange d’autres particules, par exemple l’ion oxyde (O2-) dans les sels fondus tels que les nitrates, sulfates, carbonates, etc. Les phénomènes de solvolyse s’interprètent alors selon le concept de solvoacidité qui élargit la notion d’acidité introduite pour interpréter les échanges d’ions H+.
La chimie en solution
La mise en contact des réactifs en solution provoque des réactions qui évoluent spontanément jusqu’à un état d’équilibre caractérisé par un ensemble de constantes d’équilibre thermodynamique. Dans ces réactions, le solvant n’est pas inerte et les états d’équilibre sont étroitement dépendants de sa nature. L’acquisition d’un grand nombre de données relatives aux équilibres en solution dans des solvants variés et dans des mélanges de solvants permet d’intervenir de façon rationnelle sur la réactivité des espèces, par modification de l’acidité, ou par le jeu de réactions de formation de complexes, par exemple. Ces effets sont également mis en œuvre dans les techniques de séparation, aussi bien sur le plan analytique en chromatographie en phase liquide que sur le plan préparatif en extraction liquide-liquide. Le solvant agit également sur la vitesse des réactions: cela est important en synthèse organique où un choix judicieux permet d’orienter la réaction à partir de critères cinétiques. Par exemple, la vitesse des réactions de substitution nucléophile est plus importante dans les solvants les plus polaires.
Les propriétés oxydoréductrices de l’eau peuvent, comme les caractéristiques acide-base, en limiter les applications et justifier l’emploi d’un solvant. Le développement des piles et batteries au lithium, par exemple, n’a été possible qu’en faisant appel à des électrolytes à base de solvants non aqueux (carbonate de propylène ou de dioxolane, etc.); ces solvants sont peu sensibles au pouvoir réducteur du lithium métallique utilisé comme électrode.
Les techniques de séparation
Les techniques de séparation constituent un domaine où l’utilisation des solvants continue d’apporter des progrès importants, sur le plan analytique comme sur le plan préparatif.
Dans l’extraction liquide-liquide, on met en contact deux solutions non miscibles, l’une étant en général une solution aqueuse et l’autre une solution dans un solvant peu dissociant. Chaque soluté à extraire se partage entre les deux phases, l’équilibre étant caractérisé par un coefficient de distribution égal au rapport des concentrations dans chacune des phases.
On peut favoriser sélectivement le passage d’un soluté d’une phase dans l’autre, par exemple de la phase aqueuse à la phase organique, en ajustant la composition de l’une ou l’autre des solutions par la mise en œuvre de réactions acide-base, par la formation de complexes ou de paire d’ions. Le soluté peut ensuite être de nouveau extrait par une solution aqueuse de composition différente. La prise en compte des propriétés des solutés permet des séparations extrêmement sélectives. Les premières applications industrielles en métallurgie extractive sont nées de l’industrie nucléaire: la purification de l’uranium à partir des solutions nitriques des minerais a été obtenue par extraction par le tributylphosphate dilué avec du décane. La méthode est maintenant d’un emploi très général; ainsi, les terres rares sont extraites sélectivement de solutions aqueuses par des acides alkyl-phosphoriques.
L’industrie pharmaceutique fait également appel aux techniques d’extraction par solvant (par exemple, extraction d’antibiotiques obtenus par fermentation), l’industrie alimentaire également. L’utilisation de solvants dits hypercritiques, comme le dioxyde de carbone liquide sous pression, offre des solutions élégantes et peu polluantes pour l’extraction de substances thermosensibles comme la caféine, les acides gras, les hormones naturelles.
De nouvelles méthodes de synthèse en chimie organique mettent en œuvre la catalyse par transfert de phase dans laquelle un réactif est transféré de l’une des phases (généralement la phase aqueuse) dans la phase organique où il réagit grâce à la formation d’une paire d’ions avec un cation (ammonium quaternaire, cryptate alcalin) en faible concentration.
Aspects économiques
Les procédés de synthèse, les techniques de séparation analytiques ou industrielles sont les domaines dans lesquels les solvants jouent un rôle fondamental. Ils constituent des secteurs d’application toujours en développement. Cependant, au niveau des quantités utilisées, la part de ce secteur reste très faible.
Quelques données économiques montrent que les besoins les plus importants concernent le nettoyage et l’utilisation des solvants pour le conditionnement des aérosols ou la mise en œuvre des peintures, encres et supports magnétiques ou photographiques. Les technologies actuelles continuent de développer l’utilisation des solvants dans des procédés où ils permettent un bon contrôle et une automatisation poussée. Cependant, dans certains secteurs comme celui des peintures, on tend à limiter l’usage des solutions non aqueuses pour les remplacer par des suspensions en milieu aqueux.
Les aspects technologiques, la toxicité et les exigences de la législation du travail, les problèmes liés à la pollution de l’environnement nécessitent l’emploi de solvants de plus en plus spécifiques ou d’un plus haut degré de pureté (donc d’un coût plus élevé) et incitent à généraliser les opérations de recyclage. Le solvant apparaît ainsi comme un auxiliaire à la fois plus efficace et de plus en plus discret.
Encyclopédie Universelle. 2012.