AMIDES
Les amides d’acides carboxyliques, ou carboxamides, sont les dérivés de la fonction acide dont le groupe hydroxyle est remplacé par un groupe aminé 漣NH2, amides primaires, 漣NHR, secondaires, ou 漣NRR , tertiaires. Ils peuvent également être considérés comme les dérivés acylés de l’ammoniac et des amines primaires ou secondaires, plusieurs groupes acyle pouvant être portés par la fonction azotée: monoamides R 漣CO 漣NH2, diamides (R 漣CO)2NH, triamides (R 漣CO)3N.
Les monoamides primaires et les diamides cycliques sont les plus importants. Les amides primaires et secondaires se présentent comme des mélanges équilibrés d’isomères (protomères) dans lesquels l’hydrogène est porté soit par l’azote, soit par l’oxygène fonctionnel:

Cet équilibre, analogue à l’équilibre céto-énolique, joue un rôle important dans la réactivité des amides.
Les monoamides simples n’apparaissent que très rarement à l’état naturel. La fonction amide, accompagnée d’autres fonctions, intervient dans certains alcaloïdes mais surtout dans la structure des protéines des êtres vivants, dont l’importance est fondamentale. La fonction amide secondaire est également présente dans les polyamides de synthèse qui constituent des matières plastiques de grande importance (nylons).
Les amides des acides sulfoniques, ou sulfonamides (sulfamides), ont été les premiers antibiotiques de synthèse et, depuis 1935, ont révolutionné la lutte contre les maladies infectieuses.
1. Nomenclature
Comme celui des acides carboxyliques dont ils dérivent, le nom des amides est formé de celui de la chaîne hydrocarbonée suivi du suffixe amide: alcanamides. Le nom des monoamides secondaires et tertiaires découle de celui de l’amide primaire de même chaîne, précédé du nom des groupes alkyle ou aryle portés par l’atome d’azote. Une nomenclature courante issue de celle des acides remplace le suffixe -ique de leur nom par amides. Les diamides provenant de diacides aliphatiques sont dénommés imides. Les monoamides cycliques sont appelés lactames et leur forme tautomère, lactimes.
2. Préparations et modes de formation
Les monoamides primaires se forment par déshydratation thermique des sels d’ammonium des acides carboxyliques. La distillation, à sec, de l’acétate d’ammonium donne quantitativement l’acétamide:
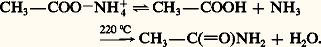
Qu’ils soient primaires, secondaires ou tertiaires, les monoamides sont facilement obtenus par ammonolyse ou aminolyse des chlorures et anhydrides d’acides et, dans une réaction réversible, des esters:
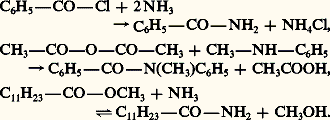
Les diamides cycliques (imides) sont formés d’une manière analogue par ammonolyse ou aminolyse des anhydrides correspondants (réaction 1).
L’hydratation des nitriles, en catalyse acide ou basique, conduit aux amides primaires, mais la réaction est difficile à contrôler car ces derniers, dans ces conditions, s’hydrolysent en sel d’ammonium de l’acide. On peut toutefois contrôler cette hydratation en employant l’eau oxygénée qui forme un hydroperoxyde qui se décompose en amide en milieu basique. C’est la réaction de Radziszewski (réaction 2). L’addition à un nitrile des éléments d’un alcool, par condensation de celui-ci ou d’une oléfine en milieu H2S4 concentré, conduit à un amide secondaire. C’est la réaction de Ritter (réaction 3).
Le formamide est fabriqué industriellement par carbonylation de l’ammoniac en présence de méthylate de sodium; le diméthylformamide (DMF), solvant aprotique dissociant, est fabriqué d’une manière analogue (réaction 4).
La transposition des cétoximes, sous l’action d’un catalyseur acide, conduit aux amides secondaires (transposition de Beckmann). C’est le groupe situé en anti de la fonction oxime qui migre du carbone sur l’azote. C’est ainsi que l’acétophénone est transformée en acétanilide (réaction 5) et la cyclohexanone en caprolactame, monomère qui, par chauffage, se polymérise en un polyamide appelé Nylon 6. Il en est de même de l’oxime de la cyclododécanone qui donne le lauryllactame, monomère du nylon 12 (réaction 6).
On obtient un amide primaire par action de l’amidure de sodium sur une cétone non énolisable (réaction 7).
3. Propriétés physiques
La structure électronique de la fonction amide est caractérisée par une conjugaison importante entre le doublet non partagé de l’azote et l’orbitale 神 du groupe carbonyle (formule 8). L’énergie de résonance de l’acétamide est de 46 kJ/mole, ce qui implique que, à température ordinaire, le groupe fonctionnel amide est plan et que la rotation autour de la liaison C 漣N est empêchée. On constate en effet que le spectre de résonance magnétique nucléaire (R.M.N.) protonique du diméthylformamide présente, à température ordinaire, deux signaux méthyle (2,88 et 2,97 ppm) se rapportant aux deux groupes CH3 situés dans un environnement différent. À température plus élevée (111 0C), ces deux signaux se regroupent en un seul signal plus large qui correspond à deux groupes CH3 situés dans le même environnement: à cette température, la rotation de la liaison C 漣N devient libre et les deux méthyles sont équivalents (formule 9).
Les amides primaires et secondaires existent sous deux formes isomères en équilibre, l’espèce «imino-alcool» étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l’état de dimères (formule 11), mais également sous la forme de polymères (formule 12). Cette association est responsable de la faible volatilité de ces amides: leurs températures d’ébullition sont anormalement élevées et supérieures à celles des acides. Elle joue un rôle essentiel dans la structure des protéines qui sont des polyamides secondaires, ainsi que dans la constitution des chaînes des acides désoxyribonucléiques (ADN) et leur assemblage spécifique en double hélice [cf. BIOLOGIE MOLÉCULAIRE].
Le spectre infrarouge des amides est caractérisé par une intense absorption vers 1690-1630 cm-1 due à la vibration d’élongation C 略O; les amides primaires présentent deux bandes d’intensité moyenne dans la région 3 500-3 400 cm-1 correspondant aux liaisons NH libres et une bande large à 3 300-3 100 cm-1 se rapportant aux liaisons NH associées; les secondaires n’ont plus que deux bandes: NH libre vers 3 400 cm-1 et NH associée vers 3 200 cm-1.
En raison de leur polarité, certains amides secondaires et tertiaires sont d’excellents solvants des composés polaires et non polaires (formules 13).
4. Propriétés chimiques
Les monoamides primaires et secondaires sont des acides très faibles dont le pK a est de l’ordre de 16. Les imides manifestent une acidité un peu plus importante. Ce sont également des bases très faibles dont l’acide conjugué présente un pK a de 0 (réaction 14).
Obtenu par action de l’amidure de sodium, le sel de sodium d’un amide primaire s’alkyle normalement à l’azote; le sel d’argent à l’oxygène (réaction 15). Dans les deux cas, le nucléophile acylamidure est le même, et sa réactivité est ambidente; l’attaque de l’halogénure d’alkyle est bimoléculaire (SN2) dans le cas du sel de sodium, unimoléculaire (SN1) dans celui du sel d’argent.
Les amides primaires et secondaires réagissent avec les halogènes en formant des dérivés halogénés à l’azote. Dans les dérivés bromés obtenus, le brome est positif. Cette propriété est mise à profit dans le cas des imides N-bromés, qui sont des réactifs de bromation soit ioniques, soit radicalaires. Le N-bromosuccinimide (NBS) est couramment employé à cet usage et le succinimide régénéré dans la réaction peut être recyclé par bromation (réaction 16).
Les amides primaires monobromés sont transformés, par la soude concentrée, en isocyanates dont l’hydrolyse conduit aux amines primaires (dégradation des amides selon Hofmann) [réaction 17].
L’acide nitreux transforme les amides secondaires en nitrosamides stables. Dans le cas des dérivés primaires, l’intermédiaire nitrosé évolue vers un acyldiazonium dont l’hydrolyse conduit à un acide (réaction 18). Cette réaction est utilisée lorsque l’hydrolyse acide de l’amide est rendue difficile par encombrement stérique.
L’hydrogénation des amides peut être réalisée au moyen de l’hydrure complexe LiAlH4 (NaBH4 ne réduit pas): on obtient les amines primaires, secondaires et tertiaires de même squelette (réactions 19). La réduction par le sodium et l’alcool (réaction de Bouveault et Blanc) conduit à un mélange d’alcool et d’amine.
Sous l’action d’agents déshydratants comme le pentoxyde ou le pentachlorure de phosphore (P410, P2Cl10), les amides primaires sont déshydratés en nitriles.
L’hydrolyse des amides, sans catalyseur, est très lente; par contre, elle est fortement accélérée par les acides forts et les bases. Dans le premier cas, on obtient l’acide et le sel d’ammonium de l’acide fort; dans le second, on arrive au sel minéral de l’acide avec libération d’ammoniac ou d’amine. De même, leur alcoolyse est lente et limitée.
L’action des organomagnésiens ne présente d’intérêt que dans le cas des amides tertiaires qui n’ont pas d’hydrogène acide. Le diéthylformamide réagit avec les organomagnésiens en formant un aldéhyde:

L’action du phosgène sur un amide tertiaire conduit à un chlorure d’imidinium particulièrement réactif et qui est utilisé en synthèse. Il en est de même de l’acétal d’amide qui résulte de l’action d’un alcoolate alcalin sur ce chlorure d’imidinium (réaction 20).
5. Applications
La fonction amide permet un nombre limité de synthèses pratiques: la dégradation de Hofmann qui donne les amines primaires; la synthèse d’acides encombrés par diazo-hydrolyse des amides primaires, obtenus par hydratation des nitriles encombrés, d’accès facile; la synthèse organomagnésienne des aldéhydes, à partir du diéthylformamide. Toutefois, l’acétylation des arylamines constitue une assez bonne protection de cette fonction contre l’oxydation et souvent on opère certaines substitutions aromatiques sur le dérivé acétylé de l’arylamine. L’hydrolyse régénère la fonction amine ainsi protégée (nitration de l’aniline).
L’acétamide est employé comme solvant polaire dans l’industrie (colorants). Son caractère amphotère et sa neutralité en font un additif antiacide précieux des laques, cosmétiques, explosifs. Le diméthylformamide et la N-méthylpyrrolidone sont des solvants industriels utilisés dans l’extraction sélective de l’acétylène des fractions de craquage en C2, du butadiène des coupes en C4 et dans la séparation des aromatiques et des aliphatiques par distillation extractive.
Certains lactames sont les monomères dont la polymérisation donne des résines de hautes qualités (Nylons 6 et 12).
Certains polyimides sont des polymères remarquablement stables vis-à-vis de la température (formule 21).
Encyclopédie Universelle. 2012.