Лейкозы (leucoscs; греч. leukos белый + ōsis; синоним лейкемия) — заболевания опухолевой природы, протекающие с вытеснением нормальных ростков кроветворения: опухоль возникает из кроветворных клеток костного мозга.
Заболеваемость Л. неодинакова в различных возрастных и этнических группах. Так, острый лимфобластный Л. значительно чаще встречается в детском и юношеском возрасте, хронический лимфолейкоз — в пожилом возрасте. По данным некоторых авторов, в СССР острые Л. составляют 3,1—100 000, хронические 1,0—1,7:100 000.
Классификация
В зависимости от морфологических особенностей опухолевых клеток выделяют две основные группы лейкозов — острые и хронические. К острым отнесены Л., при которых основная масса клеток крови представлена бластными (лейкозными, т.е. малодифференцированными) клетками, а к хроническим — Л., при которых основная масса опухолевых клеток дифференцирована и состоит главным образом из зрелых форм гранулоцитов, эритроцитов, лимфоцитов или плазмоцитов. Т.о., продолжительность болезни не является критерием для разделения лейкозов на острые или хронические.
Группа острых Л. включает следующие основные формы Л.: лимфобластный, миелобластный, промиелоцитарный, монобластный, миеломонобластный, плазмобластный, мегака-риобластный, эритромиелоз, недифференцируемый Л. Кроме того, выделяют форму острого Л., одним из основных признаков которой является малое содержание бластных клеток в костном мозге и крови на первых этапах заболевания — так называемый малопроцентный (олигобластный, тлеющий, или дремлющий) острый лейкоз.
К группе хронических Л. относятся: миелолейкоз, лимфолейкоз, хронический моноцитарный лейкоз, хронический эритромиелоз, миеломная болезнь, макроглобулинемия Вальденстрема (см. Парапротеинемические гемобластозы), эритремия (см. Полицитемия), остеомиелофиброз (сублейкемический миелоз или остеомиелодисплазия).
Этиология и патогенез
Причинами возникновения острых Л. и хронического миелолейкоза человека могут быть нарушения состава и структуры хромосомного аппарата как наследственно обусловленные, так и приобретенные под влиянием некоторых мутагенных факторов, одним из которых является ионизирующее излучение. Показана предрасполагающая роль наследственных дефектов миелоидной или лимфоидной ткани, Так, отмечено заметное учащение лейкоза на фоне болезни Дауна, синдромов Блума, Клайнфелтера, Тернера и др. Описаны случаи наследования хронического лимфолейкоза по доминантному и рецессивному типу, установлена низкая заболеваемость этой формой Л. в некоторых этнических группах и повышенная — в других. Вирусную природу имеют Л. птиц, крупного рогатого скота и других животных, из Л. человека — только Т-клеточная лимфома (лейкоз у жителей Японии и Карибского бассейна). У больных Т-клеточной лимфомой обнаруживают антитела к вирусу HTLV-I.
С помощью хромосомного анализа установлено, что при любом Л. происходит расселение по организму лейкозных клеток — потомков одной первоначально мутировавшей клетки. С помощью цитогенетического анализа и иммунофенотипирования можно определить класс клеток, являющихся исходными при некоторых формах Л. Так, при миелоидных Л. это клетка-предшественница миелопоэза, при лимфоидных Л. — клетка-предшественница лимфоцитопоэза.
Патологическая анатомия
Различные формы Л. отличаются морфологическими проявлениями, однако им свойственны общие черты. Все формы Л. характеризуются системными опухолевыми разрастаниями, исходящими из кроветворных клеток. Постоянно наблюдаются лейкозные разрастания (инфильтраты, пролифераты) в костном мозге, часто в селезенке, лимфатических узлах, печени, других органах и тканях. Развитию Л. закономерно сопутствуют признаки анемии, геморрагии, дистрофические и язвенно-некротические изменения, осложнения инфекционной природы.
Патологоанатомическая диагностика Л. и их частных форм основывается на анализе секционных данных и прижизненном исследовании кроветворных органов, главным образом костного мозга с помощью стернальной пункции и (или) трепанобиопсии. Объектом прижизненного изучения являются также удаленные с диагностической целью увеличенные лимфатические узлы, селезенка, узловатые разрастания различной локализации, материал, полученный при пункционной биопсии печени.
Патологоанатомическая картина Л. как у детей, так и у взрослых часто имеет ряд особенностей, обусловленных современными методами лечения. Они проявляются уменьшением объема лейкозной инфильтрации и возникновением гипо- и аплазии в кроветворных органах, усилением дистрофических и некробиотических, а также фиброзных изменений, развитием разнообразных тяжелых осложнений инфекционной природы.
Острые лейкозы
В течении острых Л. выделяют первый острый период, ремиссию и рецидивы. Для острых Л. характерна нарастающая беспричинная слабость, иногда одышка, головокружение, обусловленные обычно анемией. Увеличение селезенки, печени и лимфатических узлов встречается при всех острых Л., но чаще при лимфобластном. Болезненность костей при поколачивании, зависящая от инфильтрации их лейкозными клетками, свидетельствует о прогрессировании процесса. Нередко отмечается геморрагический синдром (кровоизлияния, кровоточивость слизистых оболочек, петехиальная сыпь на коже), обусловленный прежде всего тромбоцитопенией. В генезе выраженного геморрагическою синдрома существенную роль играет и синдром диссеминированного внутрисосудистого свертывания (см. Тромбогеморрагический синдром), связанный с освобождением протеолитических ферментов из лизосом опухолевых клеток. Возможно повышение температуры тела и результате инфекционных осложнений (например пневмонии, сепсиса) либо основного процесса.
При содержании лейкоцитов в крови ниже 1,0․109/л часто возникают язвенно-некротические поражения слизистой оболочки полости рта (стоматит) глотки (ангина), пищевода, кишечника (так называемая язвенно-некротическая энтеропатия, которая может привести к перфорации кишки). Язвенно-некротические поражения могут появиться в местах выраженной лейкозной инфильтрации. В ряде случаев развиваются парапроктит, пневмония, сепсис и другие осложнения.
Ремиссией острого Л. называют состояние, при котором у больного в костном мозге обнаруживается менее 5% бластных клеток (в крови они отсутствуют), менее 30% лимфоидных клеток, в крови — более 100,0․109/л тромбоцитов и более 3․109/л лейкоцитов при тенденции к увеличению их количества, отсутствуют внекостномозговые лейкозные пролифераты. Для лимфобластного Л. у детей обязательным критерием полноты ремиссии является нормальный состав цереброспинальной жидкости. Выздоровлением от острого Л. принято считать состояние полной ремиссии на протяжении не менее 5 лет.
Сравнительно редко встречаются такие формы острого Л., как мегакариобластный, плазмобластный, эритромиелоз (синдром Ди Гульельмо), малопроцентный Л. Мегакариобластный Л. характеризуется присутствием в костном мозге и крови мегакариобластов (клеток с бластным, но гиперхромным ядром, узкой цитоплазмой с нитевидными выростами), а также недифференцированных бластных клеток. Нередко в крови и костном мозге встречаются уродливые мегакариоциты и осколки их ядер. Отмечается тромбоцитоз (более 1000,0․109/л).
Плазмобластный Л. характеризуется появлением в костном мозге и крови плазмобластов и плазмоцитов с признаками клеточного атипизма, а также недифференцированных бластных клеток. При цитохимическом исследовании в бластных клетках не выявляют пероксидазы. Особенность этого Л. — наличие в крови парапротеина.
При эритромиелозе (синдроме Ди Гульельмо) источником бластных клеток является клетка-предшественница миелопоэза. Этим объясняется частая трансформация острого эритромиелоза в острый миелобластный Л., реже в миеломонобластный. Заболевание характеризуется гиперплазией клеток красного ряда без признаков выраженного гемолиза. Наблюдается прогрессирующая нормо- или гиперхромная анемия без ретикулоцитоза, повышение содержания в крови витамина В12, нарастающие лейкоцитопения и тромбоцитопения. В костном мозге увеличивается содержание клеток красного ряда с наличием двух- и трехъядерных эритробластов с перекрученными ядрами и атипичных недифференцированных бластных клеток, миелобластов.
Малопроцентный Л. характеризуется небольшим (не более 20%) увеличением числа бластных клеток в костном мозге в течение длительного срока болезни, причем иногда их количество в крови больше, чем в пунктате костного мозга. Обычно рано развивается анемия, обнаруживается склонность к лейкопении и тромбоцитопении. Как правило, периферические лимфатические узлы и печень не увеличены, в отдельных случаях отмечается небольшое увеличение селезенки. Течение болезни нередко до 11/2—2 лет (реже более).
Одно из частых осложнений острых Л. — нейролейкемия (лейкозное поражение нервной системы). Наблюдается главным образом при остром лимфобластном Л. у лиц моложе 15 лет. Возникновение нейролейкемии обусловлено метастазированием лейкозных клеток в оболочки головного и спинного мозга. В ряде случаев отмечается лейкозная инфильтрация периферических нервов с разнообразными двигательными и чувствительными нарушениями. Нейролейкемия характеризуется менингеальным и гипертензиоиным синдромами. Отмечаются стойкая головная боль, повторная рвота, вялость, раздражительность. Выявляются отек дисков зрительных нервов, нистагм, косоглазие и другие признаки поражения черепных нервов. В цереброспинальной жидкости при этом обычно наблюдается выраженный бластный цитоз.
Поражения кожи характерны как для острых, так и для хронических лейкозов. Выделяют две группы кожных проявлений лейкозов.
К первой относят кожные проявления, клиническая и гистологическая картина которых не имеет специфических для Л. особенностей (эритема, крапивница, буллезные высыпания, проявления геморрагического синдрома, герпес, фурункулез и др.). Вторую группу составляют специфические поражения кожи — лейкемвды, гистологическая картина которых соответствует изменениям в кроветворных органах. Они характеризуются узелковыми и узловатыми образованиями, ограниченными инфильтратами в виде бляшек (рис. 1), язвенно-некротическими изменениями, развивающимися вследствие разрушения лейкозного пролиферата, а также частичной или полной эритродермией.
Кожные проявления Л. следует дифференцировать с изменениями кожи, связанными с лечением больных Л. цитостатическими и гормональными препаратами, лучевой терапией и пр., а также с васкулитом геморрагическим (Васкулит геморрагический), Импетиго, Дюринга болезнью и с доброкачественными кожными лимфоидными гиперплазиями, имеющими форму узелков.
Патологическая анатомия. Макроскопические проявления различных форм острого Л. сходны между собой, в связи с чем их дифференциация на вскрытии может быть затруднена. При развернутой картине острого Л. костный мозг плоских костей темно-красного, розово-красного цвета, сочный, жировой костный мозг в трубчатых костях замещается лейкозными разрастаниями. В ряде случаев выявляется увеличение селезенки, лимфатических узлов, печени, которое, однако, выражено не столь значительно, как при хроническом Л. Масса селезенки в большинстве случаев в 2—3 раза выше возрастной нормы. Ткань селезенки на разрезе красного цвета, со стертым рисунком, иногда имеются инфаркты, пульпа дает обильный соскоб. Пораженные лимфатические узлы мягкой консистенции розово-красного цвета, не спаяны между собой. Печень, как правило, увеличена незначительно, на разрезе иногда видны мелкие серовато-белые полоски, соответствующие зонам лейкозной инфильтрации. Специфические разрастания часто выявляются в желудочно-кишечном тракте. При значительной распространенности процесса узелковые или диффузные беловатые разрастания лейкозной ткани локализуются в коже, эпикарде, плевре, почках, сердце, внутренних половых органах, а у детей — в вилочковой железе.
В костном мозге, по данным трепанобиопсии, на первых стадиях заболевания скопления бластных клеток являются очаговыми, в достаточном количестве обнаруживаются элементы деятельного костного мозга. Прогрессирование заболевания характеризуется увеличением числа и размеров лейкозных разрастаний, их слиянием, а затем диффузной инфильтрацией ткани костного мозга (рис. 2). Лейкозная инфильтрация ткани селезенки и лимфатических узлов сопровождается уменьшением размеров (рис. 3) и числа фолликулов вплоть до полного их исчезновения. Лейкозная инфильтрация также может быть обнаружена в желудочно-кишечном тракте, легких, печени, сердце и др.
Закономерности развития лейкозного процесса и сопутствующие ему вторичные изменения сходны при различных формах острого Л. Однако патоморфология некоторых форм имеет довольно выраженные особенности. Так, при остром мегакариобластном лейкозе выявляется большое количество атипичных мегакариоцитов и мегакариобластов, которые диффузно рассеяны в тканях различных органов, а местами образуют скопления (рис. 4).
Клинический диагноз устанавливают на основании данных цитологического исследования крови и костного мозга (обнаруживается высокий процент бластных клеток). На ранних этапах болезни бластные клетки в крови могут присутствовать (лейкемическая стадия) или отсутствовать (алейкемическая стадия). В обоих случаях отмечается уменьшение количества зрелых нормальных клеток, обычно двух или всех рядов кроветворения (Кроветворение). В костном мозге при всех острых Л. за исключением малопроцентного выявляется высокое (десятки процентов) содержание бластных клеток.
Форму острого Л. устанавливают на основании морфологических и цитохимических особенностей бластных клеток. При миелобластном Л. ядра бластных клеток имеют нежно-структурную хроматиновую сеть, нередко несколько мелких нуклеол. Цитоплазма содержит ауэрофильную зернистость (тельца Ауэра), дает положительную реакцию на пероксидазу, липиды, хлорацетатэстеразу, диффузно окрашивается при ШИК-реакции. Активность неспецифической эстеразы низкая. При миеломонобластном Л. в бластных клетках при цитохимическом исследовании выявляется не только пероксидаза, но и α-нафтилэстераза, характерная для элементов моноцитарного ряда; она подавляется фторидом натрия. По цитохимическим признакам бластные клетки часто относятся к миелобластам. Отличительной их особенностью является малая чувствительность к различным видам терапии.
Для лимфобластного Л. характерной особенностью является положительная гранулярная ШИК-реакция, отсутствие пероксидазных и суданофильных включений в цитоплазме бластных клеток. Реакция на специфическую эстеразу отрицательная или слабоположительная. Высокая активность кислой фосфатазы отмечена при редко встречающемся варианте лимфобластного лейкоза.
При промиелоцитарном Л. бластные клетки различны по величине и форме, имеют голубоватую цитоплазму, густую крупную фиолетово-бурую зернистость, располагающуюся и на ядрах, нередко выявляются тельца Ауэра. Зернистость содержит кислые сульфатированные гликозаминогликаны. В цитоплазме имеется большое количество лизосом. Бластные клетки лишь отдаленно напоминают промиелоциты и относятся к предшественникам гранулоцитов.
Они дают положительную реакцию на пероксидазу, липиды, хлорацетатэстеразу, неспецифическую эстеразу; при ШИК-реакции цитоплазма окрашивается диффузно.
При монобластном Л. выявляется положительная реакция цитоплазмы на α-нафтилэстеразу, подавляемая фторидом натрия; реакция на пероксидазу, липиды, ШИК-реакция выражены слабо или отсутствуют. Активность кислой фосфатазы умеренная или высокая. В сыворотке крови и моче больных содержится большое количество лизоцима.
Дополнительное диагностическое и прогностическое значение имеют кариологические, иммунохимические и другие методы исследования. Для оценки полноты ремиссии применяют цитологическое и гистологическое изучение костного мозга различных частей скелета. Так, при остром лимфобластном Л. у детей обязательна люмбальная пункция для исключения нейролейкемии.
При постановке диагноза острого эритромиелоза прежде всего следует исключить гемолиз, в частности аутоиммунный, а также пернициозную анемию. Применение трепанобиопсии в затруднительных случаях нередко позволяет обнаружить пролифераты недифференцированных клеток, не характерных для неопухолевых заболеваний. Иногда лишь динамическое наблюдение выявляет увеличение количества бластных клеток в костном мозге, и диагноз эритромиелоза становится несомненным.
Специфические изменения костей скелета у больных острым Л. при рентгенологическом исследовании обнаруживаются преимущественно в диафизах длинных трубчатых костей, но могут быть выявлены и в плоских коротких костях. Изменения чаще имеют вид мелких очагов деструкции продолговато-овальной формы. В отдельных случаях участки деструкции больших размеров захватывают всю толщу кости (рис. 5). Возможно образование продольно разволокненной (рис. 6), широкопетлистой, беспорядочной структуры костного вещества или диффузного остеопороза. Из плоских и коротких костей сильнее поражаются позвонки: помимо остеопороза, в них могут обнаруживаться компрессионные переломы.
Изменения в органах грудной клетки при острых Л. встречаются чаще в виде опухоли средостения, гиперплазии внутригрудных лимфатических узлов, поражения легких, плевры. Специфические изменения в легких заключаются в инфильтрации легочной ткани. Характерно образование массивных затемнений, формирующихся из сливающихся очагов на фоне выраженной межальвеолярной или перибронхиальной лейкозной инфильтрации. Лейкозное поражение плевры сопровождается ее утолщением и образованием массивных плевритов. Изменения в желудке и двенадцатиперстной кишке могут быть в виде полипообразных выбуханий слизистой оболочки или ограниченных плоских дисковидных утолщений стенок желудка, крупных опухолевых образований и резко утолщенных приподнятых складок слизистой оболочки; перистальтика сохранена или ослаблена. Рентгенологические данные при необходимости подтверждаются эндоскопией и биопсией их пораженного отдела желудочно-кишечного тракта.
Дифференциальный диагноз проводят с инфекционным мононуклеозом, для которого характерно, как правило, острое начало с высокой температурой тела, интоксикацией, болезненностью увеличенных лимфатических узлов. Установить правильный диагноз помогает микроскопическое исследование тонких окрашенных мазков крови. Кроме того, при инфекционном мононуклеозе отсутствуют анемия и тромбоцитопения,
Острый Л. с панцитопенией без бластных клеток в крови следует дифференцировать с апластической анемией и так называемым остеопластическим раком — тотальном метастатическом поражении костного мозга. Диагноз уточняют результаты пункции костного мозга (обнаружение при остром Л. бластных клеток), а также трепанобиопсии.
Иногда возникает затруднение в дифференциальной диагностике острого Л. и иммунного лизиса, приводящего к анемии, тромбоцитопении и нейтропении, к панцитолизу. Иммунный панцитолиз сопровождается выраженным геморрагическим синдромом и вялотекущими осложнениями инфекционной природы, обусловленными нейтропенией. В крови могут появляться бласттрансформированные лимфоциты, которые ошибочно, особенно в толстом мазке, можно принять за бластные клетки. Однако в материалах пункции и трепанобиопсии при иммунном лизисе в отличие от острого Л. костный мозг полиморфен, в нем содержится немало мегакариоцитов и отсутствуют типичные бластные клетки, пробы на антитела к эритроцитам и тромбоцитам положительны.
Лечение. При подозрении на острый Л. больному делают стернальную пункцию и при подтверждении диагноза немедленно направляют в гематологический стационар, где он находится до достижения ремиссии. В дальнейшем поддерживающую терапию проводят амбулаторно. Госпитализируют больного в случае развития агранулоцитоза или глубокой тромбоцитопении. При невозможности достичь ремиссии в стационаре терапия сдерживания лейкозного процесса иногда может осуществляться амбулаторно.
Лечение проводят в основном цитостатическими средствами. Оно включает индукцию ремиссии и ее консолидацию (проводят в гематологическом стационаре) и терапию поддержания ремиссии (осуществляют амбулаторно). В группе больных острым лимфобластным Л. с благоприятным прогнозом (возраст больного от 2 до 8 лет, количество лейкоцитов ниже 25,0․109/л, отсутствие увеличения лимфатических узлов средостения, массивной инфильтрации органов, нейролейкемии) для индукции ремиссии используется 4—6-недельная программа: введение винкристина (онковина) в дозе 1,5 мг/м2 (не более 2 мг/м2 в 1-й, 8-й, 15-й, 22-й, 29-й, 36-й дни и преднизолона в дозе 40 мг/м2 ежедневно. Детям старше 8 лет и взрослым при остром лимфобластном и недифференцированном Л. одновременно с винкристином и преднизолоном назначают рубомицина гидрохлорид в дозе 45—60 мг/м2. Кроме того, детям старше 15 лет и взрослым можно рекомендовать L-аспарагиназу в дозе 5 000 —10 000 МЕ/м2. Для индукции ремиссии любого острого лимфобластного Л. можно использовать следующую схему: вначале 4-недельный курс терапии, включающий введение винкристина в дозе 1,5 мг/м2 и рубомицина гидрохлорида в дозе 25—45 мг/м2 еженедельно в один и тот же день, L-аспарагиназы в дозе 5000 МЕ/м2 (с 1-го по 14-й день) и преднизолона в дозе 60 мг/м2 ежедневно; затем 4-недельный курс: введение циклофосфана в дозе 600 мг/м2 (3 раза), цитарабина в дозе 75 мг/м2 на 2-й, 3-й, 4-й и 5-й день каждой недели, меркаптопурина в дозе 60 мг/м2 ежедневно. Для консолидации ремиссии взрослым больным назначают препараты в разных сочетаниях, например циклофосфан, винкристин, цитарабин и преднизолон (СОАР), меркаптопурин, винкристин, метотрексат и преднизолон (POMP); циклофосфан, адриамицин, винкристин и преднизолон (CHOP). Можно использовать также метотрексат (1000 мг/м2 в сутки, 1 раз в неделю, 3 введения) или тенипозид (60 мг/м2) в сочетании с цитарабином (75 мг/м2), которые вводят ежедневно в течение 5 дней. После достижения ремиссии рекомендуется терапия поддержания ремиссии: введение меркаптопурина (60 мг/м2 ежедневно), метотрексата (20 мг/м2 на 6-й день недели), циклофосфана (200 мг/м2 на 7-й день недели). Детям в возрасте до 2 лет и от 10 до 15 лет непрерывную терапию поддержания сочетают каждые 11/2—2 мес. с терапией усиления (винкристин, преднизолон и рубомицина гидрохлорид). У взрослых больных терапия поддержания включает прием меркаптопурина, метотрексата и циклофосфана. Каждые 11/2—2 мес, эти препараты заменяют одним из приведенных выше курсов (CHOP, СОАР, POMP).
При остальных формах Л. (острых нелимфобластных Л.) для индукции ремиссии используют цитарабин, рубомицина гидрохлорид и другие противоопухолевые антибиотики антра-циклинового ряда. При этом основная схема (схема 7 + 3) включает введение цитарабина в дозе 100 мг/м2 в сутки (непрерывное введение) или 100 мг/м2 в инъекции каждые 12 ч в течение 7 дней и рубомицина гидрохлорида в дозе 45—60 мг/м2 (для больных в возрасте старше 60 лет доза составляет 30 мг/м2) в течение 3 дней. Высокой эффективностью обладает лечение по схеме ТАД-9: цитарабин (первые два дня его вводят капельно, следующие 7 дней — 2 раза внутривенно), тиогуанин (введение в дозе 100 мг/м2 каждые 12 ч на 3-й, 4-й, 5-й, 6-й, 7-й, 8-й и 9-й день), рубомицина гидрохлорид (вводят на 3-й, 4-й и 5-й день). При остром промиелоцитарном Л. для индукции ремиссии эффективно лечение одним рубомицина гидрохлоридом в дозе 45—60 мг/м2 в течение 5 дней. В ряде случаев (например, при невозможности проведения интенсивной полихимиотерапии, резистентности, а также при рецидиве Л.) применяют цитарабин в дозе 12 мг/м2 каждые 12 ч в течение 21—28 дней. Используют и новые препараты — амсакрин, вепезид (наиболее эффективен при миеломонобластном и монобластном Л.), митоксантрон и др. Для консолидации ремиссии при острых нелимфобластных Л. рекомендуется, как правило, 1—3 курса терапии, при которой была достигнута ремиссия. С целью консолидации ремиссии назначают цитарабин в больших дозах (1—3 г/м2 каждые 12 ч, 8—12 введений); его можно сочетать с рубомицина гидрохлоридом, амсидилом, митоксан троном, L-аспарагиназой. Терапию поддержания ремиссии (в случае индукции ремиссии по схеме 7 + 3) можно провести по схеме 5 + 2 или назначить цитарабин в дозе 100 мг/м2 подкожно каждые 12 ч в течение 5 дней ежемесячно в сочетании поочередно с тиогуанином (или меркаптопурином), циклофосфаном, рубомицина гидрохлоридом, кармустином, винкристином и преднизолоном.
Используют также лучевую терапию. Тотальное облучение может предшествовать трансплантации костного мозга (Трансплантация костного мозга).
При нейролейкемии в связи с непроницаемостью гематоэнцефалического барьера для большинства цитостатиков их вводят эндолюмбально. Наиболее эффективно сочетание метотрексата с цитозаром. В период ремиссии проводят специальный профилактический курс, включающий лучевую терапию (облучение головы) и 5-кратное введение метотрексата эндолюмбально. При наличии лейкозных инфильтратов в веществе головного мозга эндолюмбальное введение цитостатиков и лучевая терапия могут оказаться малоэффективными. Рецидив на фоне непрерывной терапии свидетельствует о новом этапе опухолевой прогрессии и требует смены схемы лечения.
Активное применение цитостатических средств в ряде случаев приводит к резкому угнетению нормального кроветворения (миелодепрессии), развитию тяжелых осложнений инфекционной природы и прогрессированию лейкозного процесса. С целью профилактики осложнений инфекционной природы больного острым Л. с глубокой нейтропенией (количество лейкоцитов меньше 1,0․109/л) помещают в стерильную (асептическую) палату. При развитии некротической энтеропатии рекомендуется полный голод (разрешается прием только кипяченой воды). Возможно назначение неадсорбируемых антибиотиков (например, мономицина, полимиксина В сульфата). В период миелодепрессии необходима адекватная заместительная терапия клеточными компонентами крови. Для купирования кровоточивости используют переливание тромбоцитной массы, свежезамороженной плазмы, а также вводят трасилол (контрикал) и другие гемостатические средства. Для устранения анемии переливают эритроцитную массу (см. Препараты крови). При Агранулоцитозе решающая роль в предупреждении инфекционных осложнений принадлежит антибиотикам.
Прогноз. Современная терапия острых Л. позволяет у 20—80% больных (в зависимости от возраста больных, формы Л. и других прогностических факторов) достигать полных не прерываемых в течение 5 лет ремиссий, которые расценивают практически как выздоровление.
Хронические лейкозы
Хронический миелолейкоз характеризуется поражением гранулоцитарного, моноцитарного, тромбоцитарного и эритроцитарного ростков костного мозга. Родоначальница опухоли — клетка-предшественница миелопоэза. Процесс распространяется на печень, селезенку; в терминальной стадии может поражаться любая ткань.
В начале развернутой стадии у больного может быть небольшая слабость, утомляемость, повышенное потоотделение. Селезенка имеет нормальные размеры или незначительно увеличена. Состав крови практически не изменен, хотя возможен незначительный нейтрофильный лейкоцитоз. В пунктате костного мозга увеличено количество миелокариоцитов, в материале, полученном при трепанобиопсии, наблюдается почти полное вытеснение жировой ткани миелоидной тканью. Без лечения у больного в развернутой стадии постепенно нарастает утомляемость, отмечаются повышенная потливость, иногда субфебрилитет, прогрессирующе увеличивается селезенка, реже печень.
В анализе крови наблюдается нейтрофильный лейкоцитоз (10,0—50,0—100,0․109/л и выше), сдвиг лейкоцитарной формулы влево (до миелоцитов, единичных промиелоцитов). Изредка встречается увеличение количества эозинофилов, базофилов и тромбоцитов. Число эритроцитов и содержание гемоглобина, как правило, нормальны. Хотя при этом заболевании гранулоциты дозревают до сегментоядерных форм, поломка хромосомного аппарата (укорочение хромосомы в 22-й паре с транслокацией чаще на 9-ю пару) приводит к снижению фагоцитарной способности лейкоцитов, изменению в них соотношения ферментов.
В терминальной стадии хронический миелолейкоз приобретает черты злокачественности; отмечаются высокая температура тела, боли в костях, резкая слабость, увеличение и уплотнение лимфатических узлов, выраженная анемия, как правило, быстрое увеличение селезенки, реже печени, на коже и слизистых оболочках имеется петехиальная сыпь, наблюдаются носовые, десневые, а также желудочно-кишечные кровотечения, связанные со снижением количества тромбоцитов, могут быть повторные осложнения инфекционной природы; прогрессирует истощение. Возможны некротические процессы (нома, пролежни, трофические язвы, некротические ангина и эзофагит, некрозы кишечника), обусловленные снижением количества нейтрофилов в крови. Важнейшим признаком терминальной стадии является бластный криз — резкое увеличение процента бластных клеток (вначале нередко мислобластов, затем недифференцируемых бластных клеток) в костном мозге и крови.
Резкий перелом в течении заболевания в момент перехода к терминальной стадии обусловлен неустойчивостью хромосомного аппарата лейкозных клеток, появлением клеток более злокачественных клонов. В терминальной стадии у 80% больных с помощью кариологического анализа определяют анэуплоидные клоны. Результаты кариологического анализа, как и клинические особенности терминальной стадии, демонстрируют переход опухоли из моноклоновой доброкачественной (в развернутой стадии) в поликлоновую — злокачественную.
Патологическая анатомия. Типичная патологоанатомическая картина хронического миелолейкоза наблюдается в развернутой и терминальной стадиях. Костный мозг плоских и трубчатых костей очень сочный, серо-розового или серого цвета (так называемый гноевидный, или пиоидный, костный мозг). Имеется порозность костной ткани. Характерно увеличение селезенки, печени. В большинстве наблюдений масса селезенки в пределах 400—3000 г, изредка достигает 5000—6000 г. Ткань селезенки на разрезе однородная, сочная, серо-розового цвета, пульпа дает необильный соскоб, часто имеются ишемические и геморрагические инфаркты различной давности, склеропигментные узелки. Масса печени обычно не превышает 3000 г, изредка достигает 5000—6000 г. На разрезе ткань со смазанным рисунком, желтоватого цвета, часто с множественными серыми полосками. Лимфатические узлы обычно увеличены незначительно, между собой не спаяны, эластической консистенции, серо-розового цвета, иногда с мелкоточечными кровоизлияниями.
При микроскопическом исследовании в костном мозге преобладают незрелые и зрелые клетки гранулоцитарного ряда (рис. 7), соотношение которых может варьировать. По данным трепанобиопсии, в начальной стадии заболевания еще в достаточном количестве сохраняются элементы эритропоэтического и мегакариоцитарного рядов. По мере прогрессирования процесса их число снижается, исчезают жировые клетки. Характерны глубокие изменения в строме в виде сочетания процессов деструкции с увеличением количества фибробластов, аргирофильных и иногда коллагеновых волокон. В селезенке и лимфатических узлах в развернутой стадии болезни обнаруживается диффузная инфильтрация миелоидными элементами, атрофия лимфатической ткани.
Для хронического миелолейкоза характерна локализация лейкозных инфильтратов в печени по ходу синусоидных капилляров (рис. 8), в легких — в области межальвеолярных перегородок. При бластном кризе хронического миелолейкоза лейкозные инфильтраты имеют распространенный характер, состоят преимущественно из бластных клеток.
Диагноз хронического миелолейкоза устанавливают на основании данных исследования крови, с учетом клинической картины, результатов стернальной пункции и трепанобиопсии, а также выявления филадельфийской хромосомы в клетках крови.
Лечение проводят амбулаторно с помощью цитостатических препаратов под контролем регулярных анализов крови с обязательным подсчетом тромбоцитов. Критериями эффективности этого лечения являются снижение числа лейкоцитов и уменьшение размеров селезенки. В развернутой стадии назначают миелосан внутрь по 2—4—6 мг в день или гидреа (гидроксимочевину) в дозах от 500 до 2 000 мг в зависимости от количества лейкоцитов в крови. При их неэффективности или непереносимости используют миелобромол, который особенно показан при выраженной спленомегалии. В этом случае также возможно облучение селезенки. Может быть применен гексафосфамид. Иногда при исходно значительной спленомегалии применяют интенсивную полихимиотерапию, затем переходят на монотерапию. Получены хорошие результаты при лечении больных хроническим миелолейкозом препаратами интерферона.
При переходе хронического миелолейкоза в терминальную стадию используют комбинации цитостатиков, применяемые обычно для лечения острых Л. В ряде случаев в начале терминальной стадии эффективен миелобромол. По показаниям проводят лечение инфекционных осложнений и геморрагического синдрома. При резком увеличении какой-либо группы лимфатических узлов, селезенки или усилении локальных болей в костях показана телегамматерапия.
Прогноз определяется стадией хронического миелолейкоза. При правильном лечении развернутая стадия может продолжаться в среднем около 4 лет, нередко 5—10 лет. Состояние больных вполне удовлетворительное; они сохраняют полностью или частично трудоспособность, ведут обычный образ жизни. Длительность жизни больных в терминальной стадии даже при комбинированной полихимиотералии обычно не превышает 6—12 мес.
Хронический лимфолейкоз (хронический лимфаденоз, хроническая лимфоидная лейкемия) — поражение иммунокомпетентной ткани, основу которой составляют морфологически зрелые лимфоциты, в основном В-лимфоциты (80—98%); известны формы болезни с Т-лимфоцитарной пролиферацией. Проявляется чаще в пожилом возрасте.
По течению различают развернутую (доброкачественную) стадию и терминальную (злокачественную), при которой процесс трансформируется в острый Л. или лимфосаркому; вторая стадия может отсутствовать.
Начало болезни нередко определить почти невозможно: среди полного здоровья и при отсутствии каких бы то ни было неприятных субъективных ощущений в крови у больного обнаруживается небольшой, но постепенно нарастающий лимфоцитоз. На ранних этапах число лейкоцитов может быть нормальным. затем по мере увеличения количества лимфоцитов растет и лейкоцитоз. При возрастании числа лейкоцитов в несколько раз обычно появляются и субъективные признаки — умеренная слабость, повышенная потливость, утомляемость. Увеличение размеров лимфатических узлов (как правило, на шее) является характерным признаком болезни, который иногда выявляется в самом начале Л., в других случаях присоединяется позже. Частый симптом — увеличение размеров селезенки. Реже отмечается увеличение печени.
В крови наряду с ростом числа лимфоцитов, присутствием единичных пролимфоцитов и иногда лимфобластов довольно часто можно обнаружить характерные для хронического лимфолейкоза так называемой тени Гумпрехта — разрушенные при приготовлении мазка ядра лимфоцитов, в которых среди глыбок хроматина можно заметить нуклеолы. Абсолютное содержание в крови нейтрофилов, тромбоцитов и эритроцитов в течение многих лет в развернутой стадии болезни может оставаться нормальным.
При гистологическом исследовании костного мозга выявляется диффузное (рис. 9) или очаговое разрастание лимфоцитов. В пунктате костного мозга обнаруживается высокий процент лимфоцитов. Однако этот признак может быть достоверным свидетельством опухолевой пролиферации в костном мозге лишь при невысоком проценте лимфоцитов в крови, в противном случае для подтверждения диагноза Л. предпочтительнее пользоваться не результатами пункции костного мозга, а данными трепанобиопсии или совмещать оба метода исследования.
В развернутой стадии болезни выявляются иммунные цитолитические процессы и разнообразные инфекционные осложнения. Иммунный цитолиз затрагивает все ростки кроветворения, чаще эритроцитарный и тромбоцитарный. Характерное для хронического лимфолейкоза угнетение гуморального иммунитета — следствие депрессии нормального лимфоцитопоэза; оно проявляется инфекционными осложнениями (например, пневмонией, ангиной) — самой частой причиной гибели больных.
Переход хронического лимфолейкоза в острый Л. или лимфосаркому (Лимфосаркомы) отмечается сравнительно редко. Возникновение лимфосаркомы характеризуется появлением плотной опухоли, чаще в области одного из лимфатических узлов. Развитие лимфосаркомы может сопровождаться уменьшением размеров не пораженных опухолевым процессом лимфатических узлов, а также сменой лимфоцитоза нейтрофилезом.
Особую форму хронического лимфолейкоза представляет волосато-клеточный лейкоз, при котором лимфоциты имеют ряд морфологических признаков: выросты цитоплазмы в виде ворсинок, гомогенное, иногда с нуклеолами ядро, напоминающее ядро бластной клетки; цитоплазма этих клеток содержит много кислой фосфатазы, устойчивой к тартариковой кислоте. Для этого Л. характерны увеличение размеров селезенки, нередко значительное, отсутствие увеличения периферических лимфатических узлов, а также выраженная цитопения.
Самостоятельной формой хронического лимфолейкоза является так называемая форма Сезари, при которой поражается кожа. Процесс начинается нередко с появления кожного зуда, затем лимфатических инфильтратов в коже, которые могут быть локальными, в дальнейшем поражают кожу тотально; постепенно (иногда довольно рано) нарастает лимфоцитоз или число уродливых лимфоцитов в крови (лимфоциты имеют Т-клеточное происхождение). Отмечается увеличение лимфатических узлов за счет лейкозной инфильтрации; оно может быть и реактивным. В процессе болезни нередко увеличивается селезенка.
Патологическая анатомия. При вскрытии трупов больных, умерших в развернутой стадии хронического лимфолейкоза, как правило, обнаруживается генерализоваиное увеличение размеров периферических и висцеральных лимфатических узлов от 3 до 5 см в диаметре и более. Ткань их на разрезе серого или серо-розового цвета, часто с множественными кровоизлияниями. Может наблюдаться значительное увеличение миндалин, лимфатических фолликулов кишечника. Типично увеличение селезенки и печени, однако оно выражено обычно в меньшей степени, чем при хроническом миелолейкозе. В большинстве случаев масса селезенки 600—800 г, масса печени не превышает 3000 г, под капсулой и на разрезе часто видны очаги серого цвета. Костный мозг серо-розового цвета, извлекается из костномозгового канала трубчатых костей в виде компактной массы. В ткани легких иногда выявляются сероватые плотные участки, а также разрастания вокруг бронхов.
При микроскопическом исследовании костного мозга обнаруживается системное разрастание лимфоцитов. В отличие от других форм Л., даже при массивной инфильтрации в костном мозге сохраняются небольшие очаги нормального кроветворения, не исчезают полностью жировые клетки. Характерно резкое рассасывание костной ткани и отсутствие признаков ее новообразования. В костном мозге выделяют три типа инфильтрации: диффузную, диффузно-очаговую и очаговую. Данные прижизненного гистологического исследования костного мозга показывают, что очаговая инфильтрация наблюдается в ранние стадии заболевания. При развернутой картине хронического лимфолейкоза в лимфатических узлах и селезенке обнаруживается диффузная инфильтрация ткани лимфоцитами, которые могут проникать через капсулу в окружающую жировую клетчатку. В печени обширные скопления лимфоцитов располагаются главным образом в области портальных полей, но могут встречаться и в синусоидных капиллярах. В легких разрастания локализуются в стенках бронхов, что приводит к нарушению их дренажной функции и способствует развитию пневмонии. Могут наблюдаться участки массивной лейкозной инфильтрации ткани легкого. Гнездные скопления лимфоцитов нередко обнаруживаются в строме почек, сердца, половых железах, жировой клетчатке и т.д. Очень редко встречается специфическая инфильтрация оболочек и вещества головного мозга.
В отдельных случаях хронический лимфолейкоз может трансформироваться в лимфосаркому, что может послужить причиной смерти больного. При этом опухолевые массы состоят из крупных недифференцированных клеток с уродливыми ядрами, нередко в них обнаруживаются участки некроза, кровоизлияния. Характерен резко выраженный инфильтрирующий рост. Особенно высокий удельный вес среди причин смертности при хроническом лимфолейкозе имеют инфекционные осложнения, например пневмония.
Диагноз хронического лимфолейкоза устанавливают на основании повышения количества лимфоцитов в крови и обнаружения лимфатической пролиферации в костном мозге. Биохимическое исследование крови на ранних этапах болезни, как правило, не обнаруживает специфических изменений. Развитие заболевания сопровождается снижением в сыворотке крови содержания гамма-глобулинов, в редких случаях возможно моноклональное увеличение гамма-глобулинов. При рентгенологическом исследовании органов грудной клетки у больных хроническим лимфолейкозом обнаруживается увеличение внутригрудных лимфатических узлов. В легких наблюдаются инфильтраты с распадом и перибронхиальная инфильтрация. Поражения плевры встречаются редко.
Необходимость в дифференциации с другими заболеваниями возникает в тех случаях, когда наблюдается лимфоцитоз при нормальном или даже несколько сниженном количестве лейкоцитов в крови и умеренно увеличены отдельные лимфатические узлы на шее. Подобная картина может отмечаться при инфекционном мононуклеозе. Дифференциальной диагностике помогает оценка мазка крови: при инфекционном мононуклеозе выражен полиморфизм лимфоцитов, отмечается базофилия и наличие широкого ободка цитоплазмы, в то же время отсутствуют тени Гумпрехта. Если речь вдет о больных моложе 25 лет, хронический лимфолейкоз можно, как правило, исключить и предположить наличие инфекционного мононуклеоза или лимфатической реакции на внедрение вируса. Трудности в диагностике хронического лимфолейкоза могут возникнуть при развитии воспалительного процесса в лейкозном лимфатическом узле на фоне невысокого лейкоцитоза. Уточнить диагноз удается в результате наблюдения за больным после антибиотакотерапии. При увеличении одной группы лимфатических узлов и отсутствии лейкоцитоза хронический лимфолейкоз дифференцируют с лимфосаркомой. В этом случае диагноз позволяет установить гистологическое и цитологическое исследование лимфатического узла, в котором при хроническом лимфолейкозе обнаруживается, как правило, диффузный рост зрелых клеток (лимфоцитов), а при лимфосаркоме — бластные клетки.
Лечение в основном проводится амбулаторно. Применяют хлорбутин (лейкеран, хлорамбуцил), иногда в сочетании с преднизолоном. Показаниями для стероидной терапии являются общая или парциальная цитопения, иммунный гемолиз или тромбоцитопения, а также неэффективность цитостатиков. Стероидная терапия для лечения больных хроническим лимфолейкозом, протекающим без иммунных осложнений, в течение длительного срока и без применения цитостатических препаратов противопоказана (кроме хлорбутина или его сочетания с преднизолоном). Положительный эффект дает лечение циклофосфаном (200—400 мг в день внутримышечно или внутрь). При безуспешном использовании указанных препаратов назначают фотрин и пафенцил.
При значительном увеличении и относительной плотности периферических лимфатических узлов, вовлечении в процесс лимфатических узлов брюшной полости, увеличении печени может оказаться эффективной комбинированная цитостатическая терапия (схема СОАР, CHOP). При высоком лейкоцитозе (200,0—300,0․109/л) могут быть применены цитаферез, затем цитостатические препараты. При анемии показаны инфузии эритроцитной массы.
При хроническом лимфолейкозе довольно широко используется лучевая терапия: облучение селезенки, лимфатических узлов и кожи при их поражении. Прямым показанием является лейкозная инфильтрация нервных стволов, сопровождающаяся болевым синдромом. Облучение селезенки в умеренных дозах приводит не только к ее уменьшению, но и к снижению лейкоцитоза и уменьшению регионарных лимфатических узлов.
Одним из методов лечения иммунной цитопении являетс спленэктомия (см. Селезенка (Селезёнка)). Показания для нее — резкое снижение количества эритроцитов или тромбоцитов, не корригируемое кортикостероидами, назначаемыми в больших дозах.
При волосато-клеточном Л. хороший эффект достигается при применении стероидных гормонов и спленэктомии, а также препаратов интерферона.
Особое значение при хроническом лимфолейкозе имеет профилактика и лечение инфекционных осложнений с помощью антибиотиков, назначаемых в максимальных дозах. При хроническом лимфолейкозе больные обычно в течение ряда лет сохраняют удовлетворительное самочувствие и трудоспособность.
Хронический моноцитарный лейкоз встречается у лиц старше 50 лет. Увеличение периферических лимфатических узлов обычно не наблюдается; в 50% всех случаев увеличена селезенка. Длительное благополучное течение может смениться, как и при других формах хронического Л., терминальной стадией, проявляющейся бластным кризом, тромбоцитопенией с геморрагическим синдромом, увеличением селезенки.
Хронический моноцитарный Л. характеризуется значительным увеличением (20—50%) моноцитарных клеток в крови при нормальном или несколько повышенном лейкоцитозе, высокой концентрацией лизоцима в крови и моче, а также положительной реакцией на α-нафтилэстеразу в моноцитах. В крови больных могут встречаться единичные эритрокариоциты. СОЭ увеличивается, как правило, рано и значительно; обычно отмечается анемия.
Значительный моноцитоз в костномозговом пунктате наблюдается редко; результаты трепанобиопсии, как правило, выявляют полиморфно-клеточную гиперплазию костного мозга с диффузным расположением крупных мононуклеаров, почти полное вытеснение жировой ткани.
Дифференциальный диагноз проводят с туберкулезом, раком, макроглобулинемией Вальденстрема, при которых наблюдается моноцитоз; в сомнительных случаях необходимо динамическое наблюдение за гематологическими показателями. Хронический моноцитарный Л. имеет спокойное многолетнее течение, поэтому не требует лечения.
Хронический эритромиелоз характеризуется прогрессирующей нормохромной анемией, незначительным повышением в крови числа ретикулоцитов, наличием эритрокариоцитов, нередко миелоцитов, промиелоцитов, а также бластных клеток, гиперплазией красного ростка костного мозга, часто с мегалобластоидными чертами, а также рефрактерностью к терапии витамином В12. Заканчивается заболевание бластным кризом. При наличии сопутствующего миелофиброза говорят об эссенциальной форме хронического эритромиелоза Вон.
При лечении хронического эритромиелоза применяют преднизолон (20—40 мг в день), на этапе бластного криза — комбинированную химиотерапию, как при острых лейкозах.
Остеомиелофиброз характеризуется развитием в костномозговых полостях соединительной и костной тканей, замещающих кроветворную ткань, и образованием очагов кроветворения в других органах и тканях (селезенке, печени, лимфатических узлах и др.). Ранними симптомами являются слабость, чувство тяжести в левой подреберной области в связи со значительным увеличением селезенки. У 2/3 больных наблюдается увеличение печени. В крови отмечаются умеренный лейкоцитоз, тромбоцитоз. По мере прогрессирования заболевания присоединяется анемия, нередко гемолитическая, панцитопения. Часто развивается лихорадка, возникают боли в костях (особенно голеней), тромботические осложнения, обусловленные гипертромбоцитозом, кожный зуд.
Диспропорция между существенно увеличенной селезенкой и сравнительно невысоким лейкоцитозом позволяет заподозрить остеомиелофиброз. Диагноз подтверждается результатами трепанобиопсии (в костном мозге выражены клеточная гиперплазия с почти полным вытеснением жирового костного мозга, обилие мегакариоцитов, замещение костного мозга соединительной тканью), пункции селезенки (в пунктате обнаруживают трехростковую миелоидную метаплазию с преобладанием эритроидных элементов). Дифференциальный диагноз проводят с хроническим миелолейкозом, при котором обнаруживают филадельфийскую хромосому. Лечение проводят цитостатическими препаратами. Течение остеомиелофиброза может быть длительным, малосимптомным, доброкачественным, в ряде случаев — острым, продолжительностью 1—2 года.
Особенности лейкозов в пожилом и старческом возрасте
В пожилом и старческом возрасте чаще наблюдаются малопроцентный острый Л., хронический лимфолейкоз, хронический моноцитарный Л. и миеломная болезнь. У лиц старше 60 лет хронический миелолейкоз, а иногда и острый малопроцентный протекают доброкачественно в течение многих лет. В этом возрасте больные тяжелее переносят анемизацию, нередко проявляющуюся прежде всего недостаточностью кровообращения. Поэтому при снижении гемоглобина ниже 80 г/л наряду с другими лечебными мероприятиями особое значение имеет переливание эритроцитной массы.
Особенности лейкозов у детей
Лейкозы у детей составляют значительную часть (более 40%) злокачественных новообразований в детском возрасте. Их частота — 3—5 на 100 000 детского населения. В СССР ежегодно заболевает Л. около 3 500 детей. Преимущественно (95—97%) встречаются острые лейкозы. Частота Л. у новорожденных составляет 0,3 на 100 000 родившихся. В ряде случаев Л. развивается внутриутробно, приводя к выкидышу в ранние сроки беременности, в других случаях наступают роды мертвым плодом с признаками Л., в третьих — заболевание возникает в конце беременности, а первые клинико-гематологические признаки появляются в первые месяцы жизни ребенка.
Начальные симптомы заболевания: общее беспокойство, отказ от груди, повышение температуры тела, бледность кожи, увеличение живота. Клиническая картина врожденного острого Л. детей характеризуется анемией и геморрагическим синдромом (петехии и экхимозы на коже туловища и конечностей, кровоизлияния в склеры). Периферические лимфатические узлы, печень и селезенка увеличены. У большинства детей выявляются экстрамедуллярные очаги лейкозной инфильтрации (нейролейкемия, поражение внутренних половых органов, кожи, мягких тканей). Для врожденного острого Л. характерен высокий лейкоцитоз (более 100,0․109/л); обнаруживается тотальная инфильтрация костного мозга лейкозными клетками.
Врожденный хронический миелолейкоз у детей встречается крайне редко. У ряда детей он выявлялся случайно при плановом обследовании ребенка (лейкоцитоз более 200,0․109/л). Врожденный хронический миелолейкоз, как и врожденный острый Л., проявляется с момента рождения ребенка или в первые 3 мес. жизни. Заболевание часто сочетается с болезнью Дауна. Характерно быстрое наступление бластного криза.
Для острого лимфобластного Л., если он развивается у детей старше 3 мес., пик заболеваемости приходится на возраст от 2 до 4 лет. Выделяют следующие формы острого лимфобластного лейкоза: В-клеточный вариант, Т-клеточный вариант, общий вариант и недифференцированно-клеточный вариант. В-клеточный вариант встречается в 1—4% случаев острого лимфобластного Л. Болеют преимущественно мальчики в возрасте до 1 года и в пубертатном возрасте. Клиническая картина характеризуется наличием предлейкозного периода, проявляющегося нарушением функции желудочно-кишечного тракта, геморрагическим синдромом различной степени выраженности, развитием кахексии (гипотрофии). В дальнейшем отмечается резкое увеличение печени и селезенки, наличие опухоли в брюшной полости, поражение ц.н.с. (лейкозный менингит, менингоэнцефалит и др.), половых органов (увеличение яичек и яичников). В крови выявляется высокий лейкоцитоз.
Т-клеточный вариант встречается в 30—35% случаев острого лимфобластного Л. Он возникает в возрасте от 3 до 7 лет. Обычно болеют мальчики. Развитию процесса часто предшествует симптомокомплекс, характерный для иммунодефицитных заболеваний. Л. протекает остро, проявляется увеличением лимфатических узлов, иногда синдромом Микулича (увеличение лимфатических узлов, слюнных и слезных желез), высоким лейкоцитозом.
Общий вариант Л. встречается в 60—65% случаев острого лимфобластного Л. Болеют дети в возрасте от 2 до 4 лет. У них наблюдается склонность к частым вирусным инфекциям. Первые признаки заболевания — боли в костях, кровотечения, в крови отмечается уменьшение числа эритроцитов. В развернутой стадии заболевания выражены симптомы интоксикации, поражение костной системы и угнетения кроветворения. Менее характерно увеличение лимфатических узлов, печени и селезенки.
Недифференцированно-клеточный вариант Л. встречается в 3—5% случаев острого лимфобластного лейкоза. По клиническим проявлениям, течению, результатам лечения и прогнозу заболевание близко к общему варианту острого лимфобластного лейкоза.
Острые миелоидные лейкозы (миелобластный, промиелоцитарный, монобластный, миеломонобластный Л., эритромиелоз) встречаются у детей с такой же частотой, как и у взрослых; чаще болеют девочки. Среди острых нелимфоидных Л. больше случаев острого миелобластного Л. Заболевание характеризуется прогрессирующим течением, выраженной интоксикацией, постоянным увеличением печени. Поражение лимфатических узлов и селезенки носит менее выраженный и непостоянный характер. Имеется тенденция к раннему и прогрессирующему угнетению нормального кроветворения. В крови — анемия, тромбоцитопения, количество лейкоцитов и бластных клеток может колебаться в широких пределах. В миелограмме отмечается резкое угнетение нормальных ростков кроветворения. Терапевтические возможности при остром миелобластном Л. у детей значительно ниже, чем при острых лейкозах лимфоидного происхождения.
При остром промиелоцитарном Л. в пунктате костного мозга выявляется высокий процент промиелоцитов (более 40%). Характерен выраженный геморрагический синдром; печень, селезенка и лимфатические узлы не увеличены. Быстрый летальный исход обусловлен проявлениями геморрагического синдрома.
Клиническая картина монобластного и миеломонобластного Л. характеризуется язвенно-некротическими поражениями слизистых оболочек, подкожной клетчатки и кожи, а также выраженным геморрагическим синдромом. При остром монобластном Л. могут быть значительно увеличены лимфатические узлы (в средостении они принимают вид опухолевых конгломератов), на коже появляются лейкемиды.
При эритромиелозе чаще выявляется смешанная инфильтрация пораженных органов лейкозными эритро- и нормобластами, с одной стороны, и миелобластами — с другой. Характерен внутриклеточный гемолиз. Прогноз неблагоприятный.
Диспансеризация и реабилитация
В большинстве случаев больные хроническим Л., даже получающие цитостатическую терапию, не нуждаются в освобождении от работы. Они должны находиться под постоянным диспансерным наблюдением. Следует с большой осторожностью подходить к направлению в санатории и дома отдыха, расположенные в южных районах, больных хроническим Л. в развернутой стадии. Им противопоказаны инсоляция, УВЧ-терапия, горячие ванны и другие тепловые процедуры.
Больным острым Л., находящимся под наблюдением врача амбулатории, систематически (ежемесячно) проводят развернутый анализ крови, включающий определение содержания тромбоцитов и ретикулоцитов.
На первом году ремиссии стернальную пункцию осуществляют 1 раз в месяц, в дальнейшем — 1 раз в 3 месяца. При подозрении на рецидив (изменение показателей крови, появление в крови бластных клеток, увеличение лимфатических узлов, лихорадка, болевой синдром) необходимы срочное исследование костного мозга и госпитализация больного.
В отношении больных Л. медперсонал обязан строго соблюдать требования деонтологии. При острых Л. истинный диагноз больным, как правило, не сообщают. Задачей врача является убеждение больного (или родителей, если болев ребенок) в необходимости продолжения интенсивного цитостатического лечения по схеме в период полной ремиссии, проведения пункций (люмбальной, стернальной). С большой осторожностью следует информировать больного о показателях его крови. Учитывая тяжесть и длительность полихимиотерапии, возможность осложнений, необходимо стремиться настроить больного оптимистически, ориентируя его на необходимость систематического проведения обследований и курсов лечения.
Больным хроническим Л., учитывая относительно благоприятный прогноз, в большинстве случаев сообщают диагноз, подчеркивая доброкачественность процесса. Подробная информация способствует сознательному их отношению к длительной химиотерапии, необходимости повторных анализов крови и других исследований. Следует акцентировать внимание больных на соблюдении рекомендуемого режима с целью предупреждения осложнений.
Библиогр.: Абрамов М.Г. Гематологический атлас, с. 185, М., 1985; Владимирская Е.Б. и Торубарова Н.А. Острые лейкозы и гипоплазин кроветворения у детей, М., 1985, библиогр.; Махонова Л.А. и Маякова С.А. Результаты лечения острого лимфобластного лейкоза у детей, Гематол. и трансфузиол., т. 32, № 2, с. 3. 1987, библиогр.; Новикова Э.З. Рентгенологические изменения при заболеваниях системы крови, М., 1982; Руководство по гематологии, под ред. А.И. Воробьева, т. 1, М., 1985; Файнштейн Ф.Э. и др. Болезни системы крови, с. 139, Ташкент, 1987.
 Окраска гематоксилином и эозином; ×400">
Окраска гематоксилином и эозином; ×400">Рис. 2. Микропрепарат костного мозга при остром миелобластном лейкозе: диффузная лейкозная инфильтрация. Окраска гематоксилином и эозином; ×400.
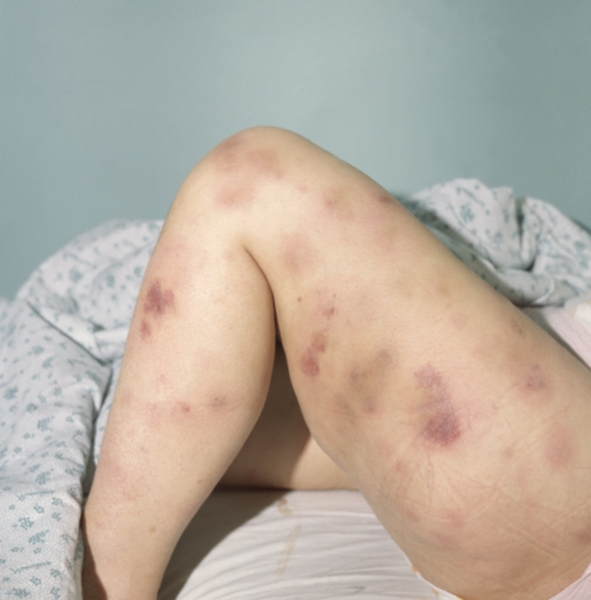
Рис. 1. Больная хроническим миелолейкозом: на коже нижней конечности синюшные ограниченные инфильтраты, кровоизлияния.
 Рентгенограмма бедренной кости при остром лейкозе (прямая проекция): продольно-разволокненная структура костного вещества">
Рентгенограмма бедренной кости при остром лейкозе (прямая проекция): продольно-разволокненная структура костного вещества">Рис. 6. Рентгенограмма бедренной кости при остром лейкозе (прямая проекция): продольно-разволокненная структура костного вещества.
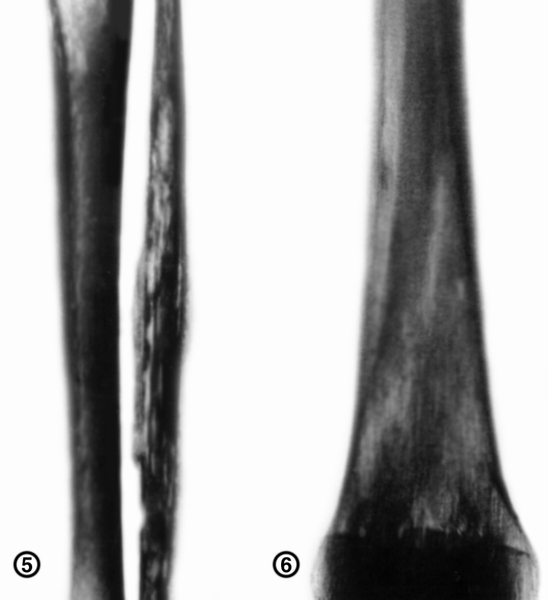
Рис. 5. Рентгенограмма костей голени при остром лейкозе (прямая проекция): очаги деструкции по всей толщине малоберцовой кости.
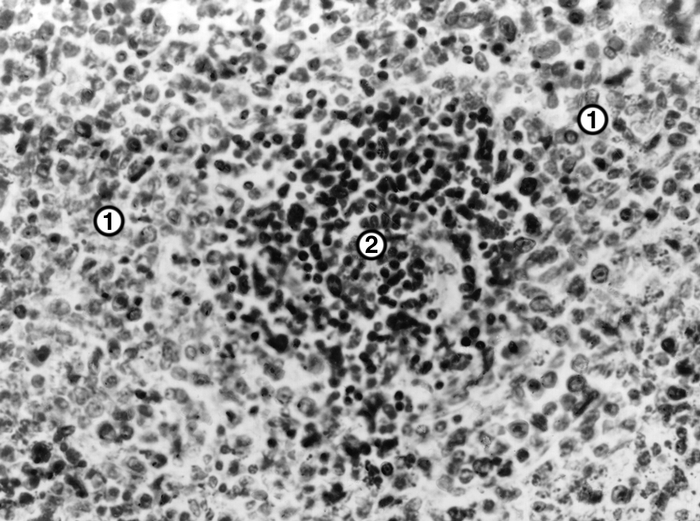
Рис. 3. Микропрепарат селезенки при остром монобластном лейкозе: лейкозная инфильтрация (1), резкое уменьшение размеров фолликулов (2). Окраска гематоксилином и эозином; ×280.
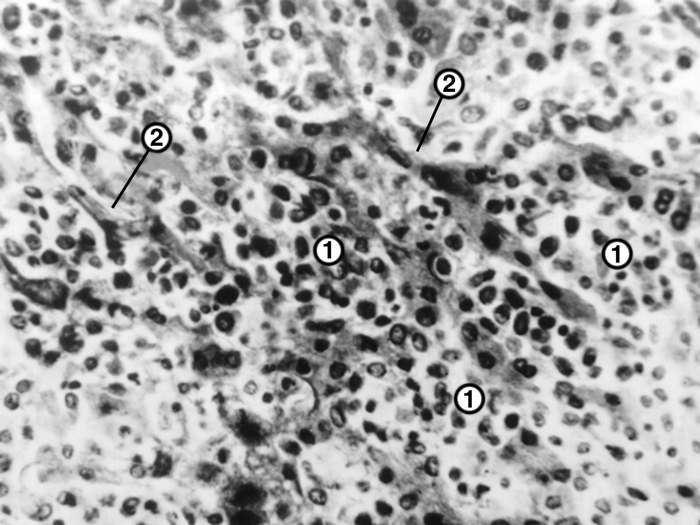
Рис. 7. Микропрепарат костного мозга при хроническом миелолейкозе: диффузная инфильтрация зрелыми и незрелыми гранулоцитами. Окраска гематоксилином и эозином; ×250.
Рис. 9. Микропрепарат костного мозга при хроническом лимфолейкозе: диффузная инфильтрация зрелыми лимфоцитами. Окраска гематоксилином и эозином; ×250.

Рис. 8. Микропрепарат печени при хроническом миелолейкозе: внутридольковая лейкозная инфильтрация (1) с нарушением трабекулярной структуры дольки и атрофией гепатоцитов (2). Окраска гематоксилином и эозином; ×280.
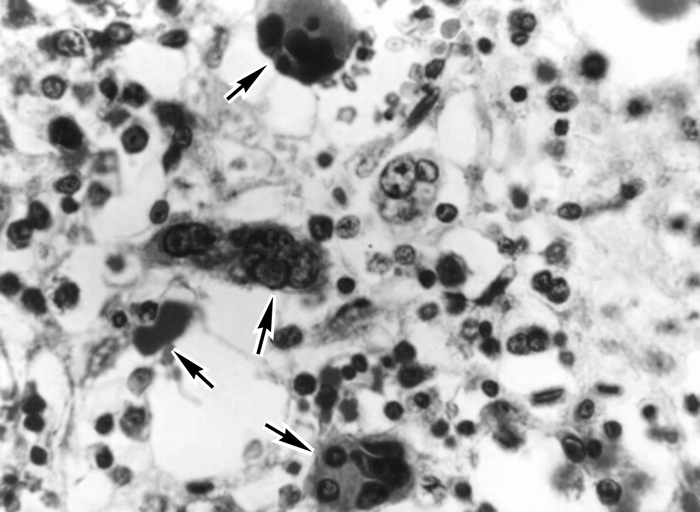
Рис. 4. Микропрепарат костного мозга при остром мегакариобластном лейкозе: стрелками указаны скопления атипичных мегакариоцитов. Окраска гематоксилином и эозином; ×400.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.