«холодное» свечение некоторых веществ (люминофоров). Излучение света происходит при наличии в атомах избыточной энергии, в зависимости от способа сообщения которой различают фото-, электро-, хемилюминесценцию и т.д. Широко распространенный вид Л. — биолюминесценция, возникающая в результате биохимических реакций. Явление Л. широко используется в лабораторной диагностике, санитарно-биохимических и других исследованиях.
Различают два вида Л. — флюоресценцию (кратковременную Л.) и фосфоресценцию (длительную Л.), последняя в физиологических условиях практически не наблюдается. Физические механизмы Л. схематически отображены на рис. 1.
В лабораторной практике большое значение имеет исследование спектров Л., которые представляют собой широкие полосы с полушириной (ширина на половине высоты) 50—100 нм. Они сдвинуты в более длинноволновую область по сравнению со спектром поглощения. Причем спектр фосфоресценции сдвинут сильнее спектра флюоресценции (рис. 2).
Для идентификации люминесцирующего вещества измеряются спектры Л. и спектры возбуждения Л. Для регистрации спектров Л. фиксируют длину волны возбуждающего света и измеряют зависимость λ от длины волны излучаемого света. Важнейшими характеристиками являются положение максимума и форма спектра люминесценции (рис. 3). При регистрации спектров возбуждения Л. не меняют длину волны регистрируемой Л., но изменяют длину волны возбуждающего света.
Люминесценция биологических объектов может быть собственной (первичной) либо возникать после соответствующей химической модификации имеющихся веществ (вторичная Л.), а также после введения так называемых флюоресцентных зондов. В качестве таких зондов выбирают вещества, параметры Л. которых резко меняются в зависимости от характеристики окружающей их среды: полярности, вязкости, поверхностного заряда и др. Часто в качестве зондов используют молекулы, которые в воде почти не флюоресцируют, но при связывании с биологическими мембранами, белками и липидами интенсивность их Л. возрастает в десятки раз.
Флюоресцирующие соединения могут быть определены в очень низких концентрациях, часто в присутствии посторонних веществ. Поэтому регистрация Л. успешно используется для количественного определения многих биологически важных веществ. Одним из наиболее ярко флюоресцирующих лекарственных соединений является хинин. В кислых растворах он люминесцирует в синей области (450—475 нм). Чтобы определить его в плазме крови проводят осаждение белков метафосфорной кислотой и измеряют Л. хинина прямо в фильтрате. Яркой синей флюоресценцией обладает противогрибковый препарат гризеофульвин, он легко определяется в экстрактах из крови или мочи. Барбитураты в щелочной среде обладают яркой зеленой флюоресценцией, их можно определить в экстрактах из биологического материала. После экстракции возможна количественная регистрация многих витаминов, например витамина Е, максимум флюоресценции которого лежит в УФ-области при 330 нм. Витамин В6 имеет синюю, а витамин А — зеленую флюоресценцию. Витамины С, D, В12 и др. удается определить по вторичной люминесценции.
Наркотические вещества морфин и героин флюоресцируют очень слабо, но после обработки образцов серной кислотой с последующим выщелачиванием возникает специфическая интенсивная синяя флюоресценция продуктов реакции. Этим методом удается определить до 0,02 мкг наркотика в пробе.
Весьма серьезную проблему представляет анализ содержания онкогенных углеводородов в атмосферном воздухе. Загрязнение воздуха улавливают органическими растворителями, затем по сине-зеленой флюоресценции в пентане или концентрированной серной кислоте с высокой чувствительностью (до 0,001 мкг/мл) и специфичностью определяются бензпирен и другие онкогенные вещества.
Чувствительным лабораторным методом определения АТФ является регистрация хемилюминесценции в присутствии люциферина и люциферазы светлячка. Люцифераза катализирует реакцию восстановленного люциферина с АТФ; продукт этой реакции — аденилат при окислении испускает свет.
По собственной Л. проводят контроль качества пищевых продуктов. Так, при длительном хранении молока и сливок рибофлавин окисляется в люмихром, что сопровождается изменением цвета флюоресценции от желто-зеленого к синему. Яйца, зараженные некоторыми видами бактерий рода Pseudomonas, при УФ-облучении начинают интенсивно флюоресцировать (за счет пигмента пиовердина, синтезированного этими бактериями).
Регистрацию Л. используют в целях диагностики. Характерная первичная Л. желто-зеленого цвета, возбуждаемая УФ-облучением при 365 нм, наблюдается в волосах, пораженных паразитическими грибками.
Диагностические возможности существенно расширяются за счет применения флюоресцентных зондов. При введении в организм некоторых гидрофобных порфиринов (гематопорфирина и его производных) эти соединения избирательно накапливаются в опухолевой ткани. Под действием возбуждающего порфирины света наблюдается красная флюоресценция опухолей. Это явление используется для визуального распознавания опухолей кожи, а с помощью эндоскопической техники — опухолей трахеи, бронхов, желудочно-кишечного тракта и др. Свойством накапливаться в опухолях обладает также тетрациклин, флюоресценция которого в опухоли в несколько раз выше, чем в окружающих ее тканях. Эту особенность используют в ряде случаев для того, чтобы отличить опухолевое поражение желудка от воспалительного или язвенного, при которых подобного роста флюоресценции не наблюдается.
Если в локтевую вену человека ввести несколько миллилитров раствора флюоресцеина, то через несколько секунд ярко-зеленую флюоресценцию можно наблюдать в тканях глаза, слизистой оболочке рта и на губах. Данный метод можно использовать, например. для определения скорости кровотока.
Явление Л. широко используется в ряде микроскопических методов исследования (Микроскопические методы исследования). Некоторые примеры применения люминесцентной микроскопии показаны на рис. 4—5.
В диагностической и санитарно-гигиенической практике находит применение регистрация хемилюминесценции, сопровождающей процессы пероксидного окисления липидов биологических мембран, а также генерацию активных форм кислорода фагоцитирующими клетками.
Регистрация Л. позволяет получать важную информацию о физико-химических свойствах биологических объектов в норме и патологии. Молекулярные механизмы работы цепи переноса электронов в митохондриях, целых клетках и даже в тканях изучают по изменению синей (440 нм) флюоресценции восстановленных пиридиннуклеотидов, возбуждаемой при 365 нм. При изучении структуры нуклеиновых кислот применяют акридиновый оранжевый и другие зонды. При этом определение положения максимума Л. в спектре позволяет судить о структуре нуклеиновой кислоты. Так, максимум Л. акридинового оранжевого и двуспиральной нативной ДНК располагается в зеленой области спектра (530 нм), тогда как в одноцепочечной ДНК и РНК он смещается в красную область (640 нм). Микрофлюориметрически с помощью зондов анализируют ДНК непосредственно в клетках.
В медицинской технике распространение получили неорганические люминофоры — вещества, способные к фото-, рентгенофлюоресценции и т.д. Люминофоры используются в люминесцентных лампах. При изготовлении рентгеновских экранов применяют цинккадмийсульфидные люминофоры, способные к рентгенолюминесценции.
См. также Фотобиологические процессы.
Библиогр.: Владимиров Ю.А. и Арчаков А.И. Перекисное окисление липидов в биологических мембранах, М., 1972; Владимиров Ю.А. и Потапенко А.Я. Физико-химические основы фотобиологических процессов, с. 27, М., 1989; Гительзон И.И. и др. Светящиеся бактерии, Новосибирск, 1984; Добрецов Г.Е. Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов, М., 1989: Зеленин А.В. Люминесцентная цитохимия нуклеиновых кислот, М., 1967, библиогр.; Карнаухов В.Н. Люминесцентный спектральный анализ клетки, М., 1978, библиогр.; Конев С. В и Волотовский И.Д. Фотобиология, Минск, 1979; Лакович Дж. Основы флуоресцентной спектроскопии, пер. с англ., М., 1986; Паркер С. Фотолюминесценция растворов, пер. с англ. М., 1972; Юденфренд С. Флуоресцентный анализ в биологии и медицине, пер. с англ., М., 1965.
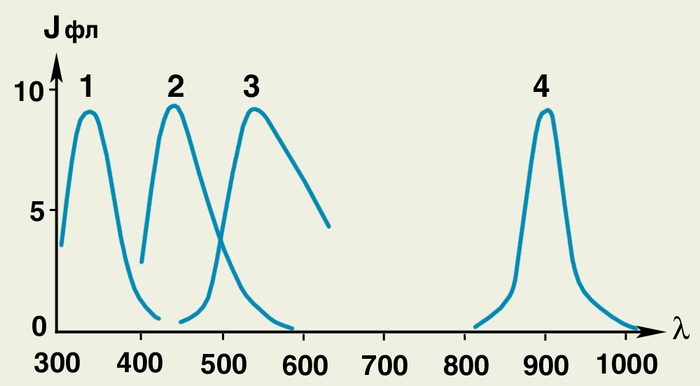
Рис. 3. Спектры флюоресценции различных веществ: по оси абсцисс, λ — длина волны (в нм), по оси ординат, Jфп — интенсивность флюоресценции (в условных единицах); 1 — сывороточный альбумин человека (λ = 335 нм); 2 — восстановленные пиридиннуклеотиды в культуре дрожжей (λ = 443 нм): 3 — водный раствор рибофлавина (λ = 535 нм): 4 — бактериохлорофилл в культуре Rhodopseudomonas palustris (λ = 901 нм). По положению λmax можно идентифицировать определенное вещество.
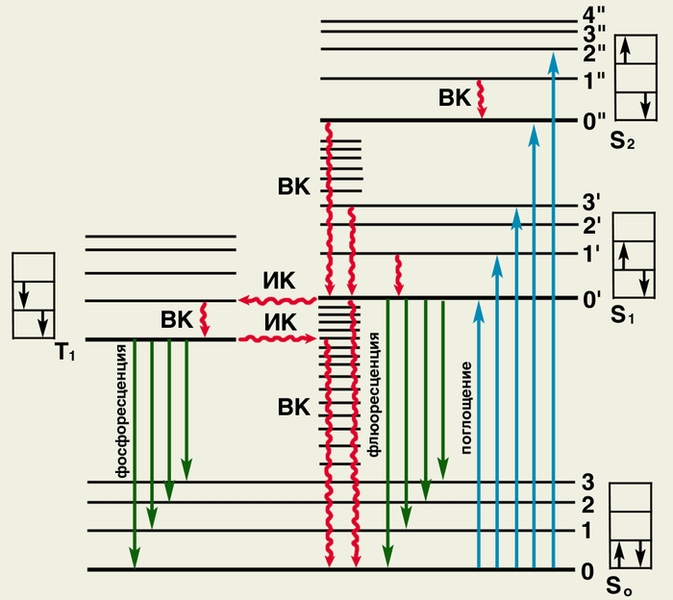
Рис. 1. Схематическое изображение физического механизма люминесценции: жирными горизонтальными линиями обозначены энергетические состояния молекулы люминесцирующего вещества; S0 — основное (невозбужденное) состояние; S2, S2 и Т1 — возбужденные состояния; тонкими горизонтальными линиями обозначены колебательные уровни (0, 1, 2.,. или 0’, 1’, 2’ и т.д.); в прямоугольниках показано направление спина возбужденного электрона (слева) по отношению к спину оставшегося электрона; ВК — внутренняя конверсия (переходы электрона без обращения спина); ИК — интеркомбинационная конверсия (переходы электрона с обращением спина). При поглощении энергии молекула переходит в возбужденное состояние S1 или S2 (обозначено синими вертикальными стрелками). Часть поглощенной энергии преобразуется в тепло (обозначено волнистыми стрелками), при этом молекула переходит на нижний колебательный уровень состояния S1 или трансформируется в состояние Т1 Возвращение молекулы из состояния S1 или Т1 на исходный энергетический уровень может сопровождаться излучением света — флюоресценцией (обозначена темно-зелеными стрелками) или фосфоресценцией (обозначена светло-зелеными стрелками).
 микрофотография культуры клеток амниона человека, зараженных вирусом кори: зоны локализации вирусного антигена обладают зеленоватым свечением (метод флюоресцирующих антител)">
микрофотография культуры клеток амниона человека, зараженных вирусом кори: зоны локализации вирусного антигена обладают зеленоватым свечением (метод флюоресцирующих антител)">Рис. 5. Люминесцентная микрофотография культуры клеток амниона человека, зараженных вирусом кори: зоны локализации вирусного антигена обладают зеленоватым свечением (метод флюоресцирующих антител).

Рис. 4. Люминесцентная микрофотография макрофага, внутри которого видны фагоцитированные бактерии, излучающие красное свечение (обработка акридиновым оранжевым).
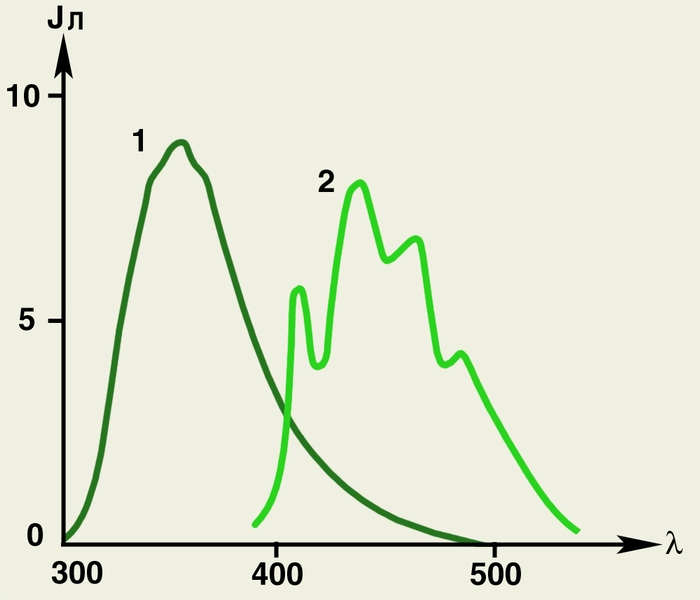
Рис. 2. Спектры флюоресценции и фосфоресценции молекул триптофана: по оси абсцисс, λ — длина волны люминесценции (в нм); по оси ординат, Jn — интенсивность люминесценции (в условных единицах); 1 — спектр флюоресценции (при +20°С); 2 — спектр фосфоресценции (при 196°С). Максимум спектра поглощения триптофана расположен около 285 нм, спектры люминесценции сдвинуты в более длинноволновую область, особенно велик сдвиг для фосфоресценции.
II
Люминесценци́я (лат. lumen, luminis свет)
излучение света некоторыми веществами, избыточное над тепловым излучением при данной температуре, возбужденное каким-либо источником энергии; регистрация Л. используется в некоторых видах клинико-диагностических, гигиенических и судебно-медицинских исследований.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.