многоступенчатая ферментная система, при активации которой растворенный в плазме крови фибриноген подвергается после отщепления краевых пептидов полимеризации и образует в кровеносных сосудах фибринные тромбы, останавливающие кровотечение.
В физиологических условиях в С. с. к. уравновешены процессы активации и торможения, в результате сохраняется жидкое состояние крови. Локальная активация С. с. к., происходящая в местах повреждения кровеносных сосудов, способствует остановке кровотечения. Активация С. с. к. в сочетании с агрегацией клеток крови (тромбоцитов, эритроцитов) играет существенную роль в развитии локального тромбоза при нарушениях гемодинамики и реологических свойств крови, изменениях ее вязкости, воспалительных (например, при васкулитах) и дистрофических изменениях стенок кровеносных сосудов. Множественный рецидивирующий тромбоз у лиц молодого и среднего возраста может быть связан с врожденными (наследственными) аномалиями С. с. к. и системы фибринолиза, в первую очередь со снижением активности основных физиологических антикоагулянтов (антитромбина III, белков С и S и др.), необходимых для поддержания циркулирующей крови в жидком состояния.
Важная физиологическая функция С. с. к. состоит также в том, что она путем массивного тромбирования микрососудов в зоне воспаления, вокруг очагов инфекционной деструкции тканей, а также асептического некроза отграничивает эти очаги, препятствует диссеминации инфекции, ослабляет поступление в общий кровоток бактериальных токсинов и продуктов распада тканей. Вместе с тем избыточное и чрезмерно распространенное диссеминированное свертывание крови приводит к развитию тромбогеморрагического синдрома (Тромбогеморрагический синдром) — патологического процесса, являющегося важным компонентом патогенеза большого числа заболеваний, критических и терминальных состояний. В связи с этим распознавание нарушений свертываемости крови и их коррекция имеют большое значение в медицинской практике.
Процесс свертывания крови реализуется многоэтапным взаимодействием на фосфолипидных мембранах («матрицах») плазменных белков, называемых факторами свертывания крови (факторы свертывания крови обозначают римскими цифрами; если они переходят в активированную форму, к номеру фактора добавляют букву «а»). В состав этих факторов входят проферменты, превращающиеся после активации в протеолитические ферменты; белки, не обладающие ферментными свойствами, но необходимые для фиксации на мембранах и взаимодействия между собой ферментных факторов (факторов VIII и V); основной субстрат С. с. к — фибриноген (фактор I), белки-ингибиторы свертывания крови, или физиологические первичные антикоагулянты; небелковые компоненты (важнейшим из них являются ионы кальция). Свертывающая система крови на разных уровнях тесно взаимодействует с клеточным гемостазом, в котором участвуют эндотелий кровеносных сосудов, тромбоциты, эритроциты, макрофаги; плазменными ферментными системами, например калликреин-кининовой, фибринолитической, комплемента, а также иммунной системой.
Основные механизмы и этапы свертывания крови представлены на схеме. Принято различать три этапа. Первый этап (начальный, или пусковой) длится с момента активации факторов XII (фактора Хагемана) и (или) VII до образования протромбиназного комплекса, состоящего из факторов Ха и Va, фактора 3 тромбоцитов, являющегося фосфолипидом (3 пф), и ионов кальция. Второй этап включает трансформацию протромбина (фактора II) в активный фермент тромбин (фактор IIa) под влиянием протромбиназного комплекса. На третьем этапе осуществляется протеолитическое действие тромбина на фибриноген с последовательным образованием фибрин-мономеров, фибрин-олигомеров (или растворимых фибрин-мономерных комплексов) и фибрин-полимера, а также активация тромбином фактора XIII с последующей стабилизацией фибрин-полимера. Некоторые исследователи в конечном этапе выделяют две фазы: ферментативную, в которой тромбин отщепляет от молекулы фибриногена последовательно пептиды А и В, в результате чего образуются фибрин-мономеры с четырьмя свободными связями (обозначаются как дес-А2В2 мономеры фибрина), и неферментативную, при которой происходит полимеризация фибрин-мономеров в растворенные в плазме фибрин-олигомеры, затем в полимеры (волокна фибрина), образующие сгусток или тромб.
Самым сложным является первый этап свертывания крови, в котором по традиции условно различают два пусковых механизма — внешний и внутренний. Внешний механизм связан с поступлением в кровь из тканей и клеток тканевого тромбопластина (комплекса апопротеина III с фосфолипидным компонентом) и активацией фактора VII. Внутренний механизм свертывания крови запускается универсальным активатором всех плазменных протеолитических систем — фактором XII. Внешний и внутренний механизмы функционально между собой связаны активирующим воздействием фактора XIIa в комплексе с калликреином и высокомолекулярным кининогеном (ВМК) на фактор VII; взаимным активирующим влиянием фактора XII и IX; ретроградным активирующим действием факторов Ха и, в меньшей степени, IIa на фактор VII (с последующим его расщеплением и деактивацией). Т.о., фактор VII может активироваться разными механизмами — тканевым тромбопластином, факторами XIIa, IXa, Ха и IIa, поэтому ему, а также факторам Ха и IIa отводится одно из узловых мест в схеме свертывания крови.
Важной особенностью пусковых факторов свертывания крови (факторов XII и VII) является то, что они могут активироваться как ферментным путем, т.е. в результате протеолиза, так и неферментным — фактор XII контактирует с коллагеном и чужеродной поверхностью, катехоламинами, сиаловой кислотой, фактор VII — с фасфолипидами (чем определяется его длительная частичная активация при некоторых гиперлипидемиях и ишемической болезни сердца с высоким тромбогенным риском).
При патологических состояниях в активацию С. с. к. помимо описанного основного механизма могут включаться дополнительные или альтернативные механизмы. Дополнительные механизмы связаны с образованием частично активированных факторов свертывания крови, а также некоторых новых (афизиологичных) активаторов этого процесса в активированных клетках макрофагальной системы или в злокачественно перерожденных клетках (раковый и меланомный активаторы, коагулянт промиелоцитарного лейкоза и др.) При альтернативных механизмах кровь может свертываться под влиянием чужеродных (экзогенных) коагулаз — бактериальных (например, стафилокоагулаза), коагулаз, содержащихся в змеиных ядах и др.
Свертывающая система крови — саморегулирующаяся система, в которой происходят процессы как активации, в т.ч. по механизму обратной связи, так и торможения. Так, факторы Ха и тромбин вначале ретроградно активируют процесс свертывания крови, затем путем протеолиза других факторов тормозят его. Конечные продукты свертывания крови (фибрин) и фибринолиза (продукты деградации фибриногена) тормозят как гемокоагуляцию, так и агрегацию тромбоцитов. Помимо этого в крови содержится ряд первичных, самостоятельно синтезируемых антикоагулянтов, которые имеют первостепенное значение для поддержания крови в жидком состоянии, предупреждения тромбоза и диссеминированного внутрисосудистого свертывания крови (антисвертывающая система крови). К ним относят универсальный ингибитор всех ферментных факторов свертывания крови и плазменный кофактор гепарина — антитромбин III, комплекс ингибиторов неферментных факторов свертывания (факторов V и VIII), синтезируемых в печени при участии витамина К, — протеины С и S, взаимодействующие с эндотелиальным тромбомодулином, α2-макроглобулин и некоторые другие антипротеазы. Препятствует свертыванию крови и лизирует уже образовавшиеся тромбы фибринолитическая система. Наследственный или приобретенный дефицит компонентов этой системы и первичных антикоагулянтов служит причиной развития тромбофилических состояний, характеризующихся склонностью к множественным рецидивирующим тромбозам. Приобретенные формы указанных тромбофилий чаще обусловлены интенсивным расходом (потреблением) антикоагулянтов или компонентов фибринолитической системы, возникающим либо вследствие массивного внутрисосудистого свертывания крови (тромбогеморрагический синдром, большие тромбоэмболии), либо в результате ускоренной их метаболизации при интенсивной антикоагулянтной или фибринолитической терапии. В этих случаях необходимо возмещение утилизированных факторов свертывания крови, что достигается внутривенным введением их концентратов или струйными трансфузиями свежезамороженной плазмы, в которой имеются все физиологические антикоагулянты и компоненты фибринолитической системы.
Нарушения свертываемости крови, характеризующиеся гипокоагуляцией, могут быть обусловлены дефицитом одного или нескольких факторов свертывания крови, появлением в циркулирующей крови их иммунных ингибиторов, т.е. антител к факторам свертывания крови (чаще факторам VIII, IX, V и фактору Виллебранда), действием антикоагулянтов и тромболитических препаратов, синдромом диссеминированного внутрисосудистого свертывания крови. Ориентировочное разграничение большинства указанных нарушений возможно на основании семейного и личного анамнеза: типа кровоточивости; фоновых заболеваний и воздействий (в т.ч. лекарственными средствами), с которыми может быть связано развитие геморрагий. Также используют результаты следующих лабораторных тестов — определения активированного частичного (парциального) тромбопластинового времени, протромбинового и тромбинового времени, агглютинации тромбоцитов под влиянием ристомицина (тест важен для выявления большинства форм болезни Виллебранда), исследования содержания в плазме фибриногена и продуктов его метаболизации (растворимых комплексов фибрин-мономеров, выявляемых с помощью паракоагуляционных тестов, например этанолового, протаминсульфатного, ортофенантролинового, теста склеивания стафилококков) и продуктов расщепления фибриногена (фибрина) плазмином (фибринолизином). Определение растворимых комплексов фибрин-мономеров и продуктов деградации фибриногена особенно важно для диагностики внутрисосудистого свертывания крови, в т.ч. тромбогеморрагического синдрома. Важное значение имеют также выявление ломкости микрососудов (например, манжеточная проба Кончаловского — Румпеля — Лееде), времени кровотечения, подсчет количества тромбоцитов в крови и исследование их агрегационной функции. Выбор диагностических тестов определяется данными анамнеза, клинической картиной, типом кровоточивости, фоновыми заболеваниями и воздействиями. После ориентировочных проводятся дифференцирующие (коррекционные) тесты.
Среди наследственных нарушений свертываемости крови подавляющее большинство приходится на гемофилии А и В, а также болезнь Виллебранда. Для них характерна кровоточивость, возникшая еще в детском возрасте; при этом отмечаются гематомный тип кровоточивости (с кровоизлияниями в суставы и поражением опорно-двигательного аппарата) у лиц мужского пола при гемофилиях и смешанный тип (петехиально-пятнистый с редкими гематомами) у лиц обоих полов при болезни Виллебранда. Характерным лабораторным признаком этих заболеваний является изолированное удлинение времени свертывания крови в тесте определения активированного частичного тромбопластинового времени при нормальных протромбиновом и тромбиновом времени. При болезни Виллебранда часто значительно удлинено время кровотечения, отмечается нарушение агрегации тромбоцитов под влиянием ристомицина.
Изолированное нарушение только протромбинового времени при смешанном типе кровоточивости характерно для наследственного дефицита фактора VII либо для ранней фазы применения антикоагулянтов непрямого действия (кумаринов, варфарина и др.). При комплексном дефиците всех витамин-К-зависимых факторов (VII, IX, Х и II), наблюдающемся при геморрагической болезни новорожденных, болезнях печени и приеме антикоагулянтов непрямого действия, а также при наследственном дефиците факторов X, V, II, нарушены как тест активированного частичного тромбопластинового времени, так и протромбиновый показатель, но остается нормальным тромбиновое время.
Нарушение показаний всех коагуляционных тестов, включая тромбиновое время, характерно для тромбогеморрагического синдрома, наследственных гипо- и дисфибриногенемий, хронических поражений печени. При дефиците фактора XIII показания всех коагуляционных тестов остаются нормальными, но фибриновый сгусток растворяется в 5—7 М мочевине.
Нарушения свертываемости крови, характеризующиеся склонностью к рецидивирующим тромбозам сосудов и инфарктам органов, чаще связаны с наследственным или вторичным (симптоматическим) дефицитом антитромбина III — основного инактиватора всех ферментных факторов свертывания крови и кофактора гепарина, белков С и S (блокаторов активированных факторов VIII и V), дефицитом компонентов фибринолитической (дефицит плазминогена и его эндотелиального активатора и др.) и калликреин-кининовой системы (дефицит плазменного прекалликрениа и высокомолекулярного кининогена), редко с дефицитом фактора XII и аномалиями фибриногена. Причиной тромбофилии могут быть и гиперагрегация тромбоцитов, дефицит простациклина и других ингибиторов агрегации тромбоцитов. Вторичное истощение указанных выше механизмов поддержания жидкого состояния крови может быть обусловлено интенсивным расходом физиологических антикоагулянтов. Склонность к тромбозам усиливается при повышении вязкости крови, что определяется методом вискозиметрии, а также по увеличению гематокритного показателя, повышенному содержанию в плазме крови фибриногена.
Основной принцип лечения нарушений свертываемости крови заключается в быстром (струйном) внутривенном введении препаратов, содержащих недостающие факторы свертывания крови (криопреципитат при гемофилии А и болезни Виллебранда; протромбиновый комплекс или PPSB — комплекс II, VII, IX и Х факторов свертывания крови при дефиците факторов IX, VII, Х и II, в т.ч. при геморрагической болезни новорожденных, передозировке антикоагулянтов непрямого действия; концентратов отдельных факторов свертывания крови, антикоагулянтов, компонентов фибринолитической системы). Комплексное замещение различных компонентов крови достигается также массивным (до 1 л и более) струйным введением свежезамороженной или свежей нативной (сроком хранения до 1 сут.) донорской плазмы. Для стимуляции синтеза витамин-К-зависимых факторов парентерально вводят препараты витамина К, для подавления фибринолиза — аминокапроновую кислоту и другие антифибринолитики, для нейтрализации гепарина — протамина сульфат. Заместительная терапия показана при проведении оперативных вмешательств, для предупреждения кровопотери в родах и др.
Библиогр.: Балуда В.П. и др. Лабораторные методы исследования системы гемостаза, Томск, 1980; Баркаган З.С. Геморрагические заболевания и синдромы, с. 63, М., 1988; Люсов В.А., Белоусов Ю.Б. и Бохарев И.Н. Лечение тромбозов и геморрагия в клинике внутренних болезней, М., 1976; Фермилен Ж. и Ферстрате М. Гемостаз, пер. с англ., М., 1984; Они же, Тромбозы, пер. с англ., М., 1986, библиогр.
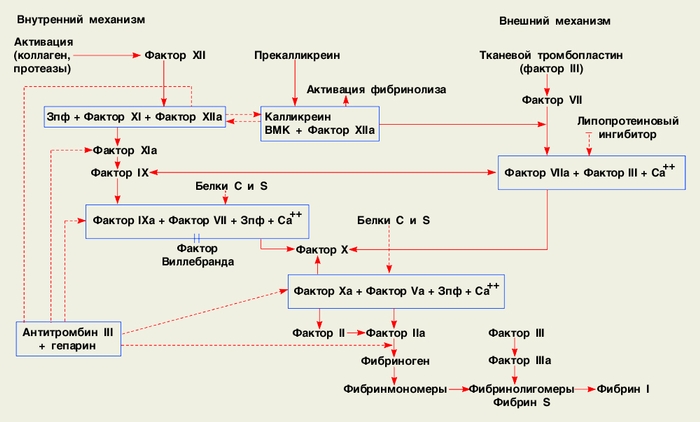 трансформация неактивного фактора в активный, тонкие стрелки — активация процесса, пунктирные линии — торможение процесса. ВМК — высокомолекулярный кининоген, 3 пф — 3-й фактор тромбоцитов (фосфолипидные матрицы)">
трансформация неактивного фактора в активный, тонкие стрелки — активация процесса, пунктирные линии — торможение процесса. ВМК — высокомолекулярный кининоген, 3 пф — 3-й фактор тромбоцитов (фосфолипидные матрицы)">Схема свертывания крови. Обозначения: толстые стрелки — трансформация неактивного фактора в активный, тонкие стрелки — активация процесса, пунктирные линии — торможение процесса. ВМК — высокомолекулярный кининоген, 3 пф — 3-й фактор тромбоцитов (фосфолипидные матрицы).
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.