- ИСПАРЕНИЕ
-
переход в-ва из жидкого или твёрдого агрегатного состояния в газообразное (пар). Обычно под И. понимают переход жидкости в пар, происходящий на свободной поверхности жидкости. И. твёрдых тел наз. возгонкой или сублимацией.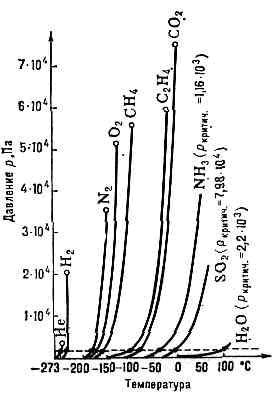 Зависимость давления насыщ. пара нек-рых жидкостей от темп-ры.Вследствие теплового движения молекул И. возможно при любой темп-ре, но с возрастанием темп-ры скорость И. увеличивается. В замкнутом пр-ве (закрытом сосуде) И. происходит при заданной пост. темп-ре до тех пор, пока пр-во над жидкостью (или тв. телом) не заполнится насыщ. паром. Давление насыщ. пара рнас зависит только от темп-ры Т и повышается с её возрастанием. Кривая зависимость рнас от Т наз. равновесной кривой И. (рис.). Если рнас становится равным внеш. давлению или несколько его превышает, то И. переходит в кипение. Наиб. высокой темп-рой кипения явл. критическая температура данного в-ва. Критические темп-pa и давление определяют критическую точку — конечную точку на равновесной кривой И. Выше этой точки сосуществование двух фаз — жидкости и пара — в равновесии невозможно.При переходе из жидкости в пар молекула должна преодолеть силы мол. сцепления в жидкости. Работа против этих сил (работа выхода), а также против внеш. давления уже образовавшегося пара, совершается за счёт кинетич. энергии теплового движения молекул. В результате И. жидкость охлаждается. Поэтому, чтобы процесс И. протекал при пост. темп-ре, необходимо сообщать каждой ед. массы в-ва определ. кол-во теплоты l (Дж/кг или Дж/кмоль), наз. теплотой испарения. Теплота И. уменьшается с ростом темп-ры, особенно быстро вблизи критич. точки, обращаясь в этой точке в нуль. Теплота И. связана с производной давления насыщ. пара по темп-ре Клапейрона — Клаузиуса уравнением, на основе к-рого определяются численные значения l для жидкостей. Скорость И. резко снижается при нанесении на поверхность жидкости достаточно прочной плёнки нелетучего в-ва. И. жидкости в газовой среде, напр. в воздухе, происходит медленнее, чем в разреженном пр-ве (вакууме), т. к. вследствие соударений с молекулами газа часть ч-ц пара вновь возвращается в жидкость (конденсируется). И. относится к фазовым переходам 1-го рода, к-рые характеризуются отличной от нуля теплотой фазового перехода. При процессе, обратном И., т. е. при образовании из пара жидкой фазы (конденсации пара), происходит выделение теплоты И. Применяется И. в технике как средство очистки в-в или разделения жидких смесей перегонкой. Процесс И. лежит в основе работы двигателей внутр. сгорания, холодильных установок, а также всех процессов сушки материалов.В естественных условиях И. явл. единств. формой передачи влаги с океанов и суши в атмосферу и осн. составляющей круговорота воды на земном шаре.
Зависимость давления насыщ. пара нек-рых жидкостей от темп-ры.Вследствие теплового движения молекул И. возможно при любой темп-ре, но с возрастанием темп-ры скорость И. увеличивается. В замкнутом пр-ве (закрытом сосуде) И. происходит при заданной пост. темп-ре до тех пор, пока пр-во над жидкостью (или тв. телом) не заполнится насыщ. паром. Давление насыщ. пара рнас зависит только от темп-ры Т и повышается с её возрастанием. Кривая зависимость рнас от Т наз. равновесной кривой И. (рис.). Если рнас становится равным внеш. давлению или несколько его превышает, то И. переходит в кипение. Наиб. высокой темп-рой кипения явл. критическая температура данного в-ва. Критические темп-pa и давление определяют критическую точку — конечную точку на равновесной кривой И. Выше этой точки сосуществование двух фаз — жидкости и пара — в равновесии невозможно.При переходе из жидкости в пар молекула должна преодолеть силы мол. сцепления в жидкости. Работа против этих сил (работа выхода), а также против внеш. давления уже образовавшегося пара, совершается за счёт кинетич. энергии теплового движения молекул. В результате И. жидкость охлаждается. Поэтому, чтобы процесс И. протекал при пост. темп-ре, необходимо сообщать каждой ед. массы в-ва определ. кол-во теплоты l (Дж/кг или Дж/кмоль), наз. теплотой испарения. Теплота И. уменьшается с ростом темп-ры, особенно быстро вблизи критич. точки, обращаясь в этой точке в нуль. Теплота И. связана с производной давления насыщ. пара по темп-ре Клапейрона — Клаузиуса уравнением, на основе к-рого определяются численные значения l для жидкостей. Скорость И. резко снижается при нанесении на поверхность жидкости достаточно прочной плёнки нелетучего в-ва. И. жидкости в газовой среде, напр. в воздухе, происходит медленнее, чем в разреженном пр-ве (вакууме), т. к. вследствие соударений с молекулами газа часть ч-ц пара вновь возвращается в жидкость (конденсируется). И. относится к фазовым переходам 1-го рода, к-рые характеризуются отличной от нуля теплотой фазового перехода. При процессе, обратном И., т. е. при образовании из пара жидкой фазы (конденсации пара), происходит выделение теплоты И. Применяется И. в технике как средство очистки в-в или разделения жидких смесей перегонкой. Процесс И. лежит в основе работы двигателей внутр. сгорания, холодильных установок, а также всех процессов сушки материалов.В естественных условиях И. явл. единств. формой передачи влаги с океанов и суши в атмосферу и осн. составляющей круговорота воды на земном шаре.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ИСПАРЕНИЕ
-
- переход вещества из жидкого или твёрдого состояния в газообразное (пар), обычно со свободной поверхности. Чаще всего под И. понимают переход жидкости в пар, он обусловлен разностью хим. потенциалов жидкости и пара. И. твёрдых тел наз. возгонкой или сублимацией. И. является фазовым переходом первого рода. При И. совершается работа по преодолению сил сцепления в жидкости (работа выхода) за счёт кинетич. энергии молекул, в результате чего жидкость охлаждается. Кол-во теплоты, к-рое нужно сообщить жидкости при изотермич. образовании единицы массы пара, наз. теплотой парообразования. В отличие от кипения, И. происходит при любой температуре, причём с повышением температуры скорость И. возрастает вследствие уменьшения работы выхода и увеличения доли молекул, обладающих необходимой кинетич. энергией, теплота испарения уменьшается, обращаясь в нуль в критич. точке. В замкнутой системе жидкость - пар при пост, темпре Т со временем устанавливается равновесное давление - давление насыщенного пара р н( Т). Этому давлению соответствует равенство потоков испаряющихся и конденсирующихся (возвращающихся обратно в жидкость из пара) молекул. Производная dp н/dT>0 определяется Клапейрона - Клаузиуса уравнением:
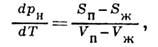
где S п-S ж и V п-V ж - скачки энтропии и объёма при фазовом переходе жидкость - пар. Для нахождения р н используются эмпирич. выражения, напр.lgp н = А-B/T+ClgT +DT6,где А, В, С, D - индивидуальные для данного вещества постоянные. На фазовой диаграмме однокомпонентной системы (рис.) равновесная кривая р н( Т )расположена между тройной и критич. точками. В области темп-р Т ниже темп-ры Т а тройной точки эта кривая имеет метастабильное продолжение ab', где стабильным фазам соответствует равновесие кристалл - пар. Разные вещества имеют характерные фазовые диаграммы, широко разнесённые на плоскости р, Т. В координатах lg(p н/p к), Т к/Т (где р к, Т к - критич. давление и темп-pa) кривые сближаются, но не стягиваются в одну линию. Для неассоциированных жидкостей набор таких кривых с хорошим приближением можно рассматривать как однопараметрич. семейство р н/ р к-f(Т/Т к, А). Параметр термодинамич. подобия (критерий подобия) А можно использовать для описания и др. свойств веществ в области газожидкостных состояний. Для капель жидкости радиуса rравновесное давление пара рr при заданной темп-ре больше (а для пузырьков пара в жидкости - меньше), чем давление насыщения
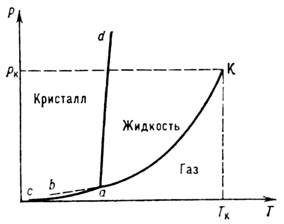
Фазовая диаграмма однокомпонентной системы с одной нормально плавящейся кристаллич. фазой: а - тройная точка; к - критическая точка; ак - линия равновесия жидкость - пар; ас, ad - линии равновесия кристалл - пар и кристалл - жидкость соответственно.при плоской границе раздела (см. Капиллярные явления). Приближённо зависимость отношения рr/р н от r описывает Кельвина уравнение: р r/р н=ехр(2sV ж/rRT), где s - поверхностное натяжение, V ж - объём жидкости. Т. о., И. выше для мелких капель и крупные капли могут расти за их счёт (см. Атмосфера). При интенсивном испарении жидкости плотность пара вблизи поверхности ниже, чем при изотермич. равновесии фаз. Для установления стационарного потока массы испаряющегося вещества j м необходим подвод к поверхности такого стационарного потока теплоты jq, чтобы jq/j м@L+DE п, где L - теплота фазового перехода, E п - превышение внутр. энергии единицы массы пара над равновесной энергией. При интенсивных потоках подводимой энергии, напр, при лазерном нагреве, когда DE п дL, И. мало связано с условиями фазового равновесия системы жидкость - пар и определяется газодинамич. условиями у поверхности раздела фаз. При И. сферич. частиц в поле очень мощного лазерного излучения за счёт реактивной отдачи получены давления до 1016 Па и сжатие мишени до плотностей, превышающих плотность исходной конденсированной фазы на два порядка. И. играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения и т. д. В системе из двух или более компонент равновесный состав пара отличается от состава жидкой фазы, что используется для разделения (очистки) веществ (метод перегонки). Лит.: Радченко И. В., Молекулярная физика, М., 1965; Xирс Д., Паунд Г., Испарение и конденсация, пер. с англ., М., 1966; Кириллин В. А., Сычев В. В., Шейндлин А. Е., Техническая термодинамика, 4 изд., М., 1983; Филиппов Л. П., Подобие свойств веществ, М., 1978. В. Я. Скрипов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.