- КОНДЕНСАЦИЯ
-
(от позднелат. condensatio — уплотнение, сгущение), переход в-ва вследствие его охлаждения или сжатия из газообразного состояния в конденсированное (жидкое или твёрдое). К. пара возможна только при темп-pax ниже критической для данного в-ва (см. КРИТИЧЕСКОЕ СОСТОЯНИЕ). К., как и обратный ей процесс — испарение, относится к фазовым переходам I рода. При К. выделяется то же кол-во теплоты, к-рое было затрачено на испарение сконденсировавшегося в-ва. Дождь, снег, роса, иней — следствия конденсации водяного пара в атмосфере. К. широко применяется в энергетике, в хим. технологии, в холодильной и криогенной технике, в опреснит. установках и т. д. В технике К. обычно осуществляется на охлаждаемых поверхностях. Известны два режима поверхностной К.: плёночный и капельный. Первый наблюдается при К. на смачиваемой поверхности и характеризуется образованием сплошной плёнки конденсата. На несмачиваемых поверхностях конденсат образуется в виде отд. капель. При капельной К. интенсивность теплообмена (отводы теплоты к поверхности охлаждения) значительно выше, чем при плёночной, т. к. сплошная плёнка конденсата затрудняет теплообмен (см. КИПЕНИЕ).Скорость поверхностной К. тем выше, чем ниже темп-pa поверхности по сравнению с темп-рой насыщения пара при заданном давлении. Наличие в объёме наряду с паром др. газа уменьшает скорость поверхностной К., т. к. газ затрудняет поступление пара к поверхности охлаждения. В присутствии неконденсирующихся газов К. начинается при достижении паром у поверхности охлаждения парциального давления и темп-ры, соответствующих состоянию насыщения (точке росы).К. может происходить также внутри объёма пара (парогазовой смеси). Для начала объёмной К. пар должен быть заметно пересыщен. Мерой пересыщения служит отношение давления пара р к давлению насыщ. пара ps, находящегося в равновесии с жидкой или тв. фазой, имеющей плоскую поверхность. Пар пересыщен, если p/ps>1, при p/ps=l пар насыщен. Степень пересыщения e=p/ps, необходимая для начала К., зависит от содержания в паре мельчайших пылинок (аэрозолей), к-рые явл. готовыми центрами К. Чем чище пар, тем выше должна быть нач. степень пересыщения. Зародышами, или центрами, К. могут служить также электрически заряжённые частицы, в частности ионизованные атомы, присутствующие в паре.Кинетика процесса К. изучается теоретически как задача кинетики физической.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- КОНДЕНСАЦИЯ
-
(от позднелат. condensatio - уплотнение, сгущение) - переход вещества из газообразного состояния (пара) в жидкое или твёрдое состояние. Ква-зистатич. процесс К. происходит в условиях равновесия сосуществующих фаз и является фазовым переходом 1-го рода. Если при этом давление р поддерживается постоянным, то сохраняется постоянной и абс. темп-ра Т. Связь между р и Т определяется равенством химических потенциалов
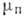 и
и 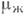 для пара и жидкости соответственно:
для пара и жидкости соответственно:

или задаётся Клапейрона - Клаузиуса уравнением. Эти ур-ния справедливы как для К., так и для обратного процесса - испарения, направление же процесса определяется теплообменом с окружающей средой: если системе сообщается теплота, происходит испарение, при её отводе - К. Кол-во теплоты, выделяющееся при К. единицы массы, равно теплоте испарения. В квази-статич. условиях К. пара в жидкость возможна в интервале давления от критического до давления в тройной, точке. Ниже давления в тройной точке конденсирующийся пар граничит с кристаллом (рис. к ст. Испарение).
Равновесие между паром и конденсированной фазой (напр., в замкнутом объёме) имеет динамич. характер: ср. потоки конденсирующихся и испаряющихся молекул равны между собой, т. е. компенсируют друг друга. При нарушении фазового равновесия величину нескомпенсированного потока молекул
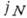 можно оценить, используя приближение идеального газа для пара (т. н. ур-ние Герца - Кнудсена):
можно оценить, используя приближение идеального газа для пара (т. н. ур-ние Герца - Кнудсена):
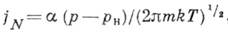
где
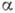 - коэф. конденсации, различный для разных веществ, р н - равновесное давление (давление насыщения при темп-ре Т), т - масса молекулы. Если в газовой фазе присутствует неконденсирующий газ, то К. пара происходит при его парциальном давлении, соответствующем линии насыщения чистого вещества. Молекулы газа скапливаются у поверхности раздела фаз и затрудняют К., снижая её скорость, однако появляющийся градиент концентраций вызывает их диффузию.
- коэф. конденсации, различный для разных веществ, р н - равновесное давление (давление насыщения при темп-ре Т), т - масса молекулы. Если в газовой фазе присутствует неконденсирующий газ, то К. пара происходит при его парциальном давлении, соответствующем линии насыщения чистого вещества. Молекулы газа скапливаются у поверхности раздела фаз и затрудняют К., снижая её скорость, однако появляющийся градиент концентраций вызывает их диффузию.
Если первоначально пар не сосуществует с конденсированной фазой, то он может перейти в метастабиль-ное состояние, характеризуемое степенью пересыщения
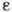 =р/р н. При высоких степенях пересыщения внутри парогазовой смеси даже в отсутствие конденсирующих поверхностей может начаться процесс К. Кинетика нач. стадии такой объёмной К. описывается теорией гомогенного зародышеобразования. Высокая степень пересыщения создаётся при быстром расширении пара в потоке, при смешении пара с холодным газом, в молекулярных пучках. Образование зародышевых капель облегчается на смачиваемых стенках, твёрдых частицах (гетерогенное зародышеобразование) и на ионах (напр., в Вильсона камере).
=р/р н. При высоких степенях пересыщения внутри парогазовой смеси даже в отсутствие конденсирующих поверхностей может начаться процесс К. Кинетика нач. стадии такой объёмной К. описывается теорией гомогенного зародышеобразования. Высокая степень пересыщения создаётся при быстром расширении пара в потоке, при смешении пара с холодным газом, в молекулярных пучках. Образование зародышевых капель облегчается на смачиваемых стенках, твёрдых частицах (гетерогенное зародышеобразование) и на ионах (напр., в Вильсона камере).
К. и испарение играют важную роль в круговороте воды в природе, а также в разл. технол. процессах. На тепловых и атомных электростанциях К. отработанного водяного пара происходит при низком давлении (ок. 4 КПа). На смачиваемой твёрдой охлаждаемой поверхности конденсат образует сплошную плёнку, к-рая ухудшает теплообмен между паром и стенкой. В отсутствие смачивания наблюдается капельный режим К., к-рый предпочтительнее плёночного, однако при длит. работе несмачиваемая поверхность обычно становится смачиваемой. К. используется также в холодильных машинах, в ожижителях газов, в опреснительных и ректификационных установках. Кроме К. на твёрдой поверхности в технике применяют К. на струях и каплях предварительно охлаждённой жидкости.
Неравновесная К. на твёрдой поверхности с темп-рой
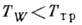 (T тp - темп-pa тройной точки) может идти по схеме пар
(T тp - темп-pa тройной точки) может идти по схеме пар  жидкость
жидкость  кристалл. Для ряда веществ экспериментально показано, что ниж. граница перехода к механизму К. пар-кристалл лежит при
кристалл. Для ряда веществ экспериментально показано, что ниж. граница перехода к механизму К. пар-кристалл лежит при 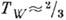 T тp (см. Кристаллизация). Неравновесная К. на охлаждаемой подложке (напр., для воды при
T тp (см. Кристаллизация). Неравновесная К. на охлаждаемой подложке (напр., для воды при 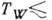 120 К) может приводить к образованию твёрдого аморфного (стеклообразного) слоя вещества.
120 К) может приводить к образованию твёрдого аморфного (стеклообразного) слоя вещества.
Лит.: Радченко И. В., Молекулярная физика, М. 1965; Хирс Д., Па унд Г., Испарение и конденсация пер. с англ., М., 1966; Кириллин В. А., Сычев В. В. Шейндлин А. Е., Техническая термодинамика, 4 изд. М., 1983. В. П. Скрипов
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.