POLAROGRAPHIE
La polarographie est une méthode électrochimique d’analyse, inventée en 1922 par Jaroslav Heyrovsky, de l’université Charles de Prague. Pour sa découverte, il reçut le prix Nobel de chimie en 1959 en raison des possibilités très variées de cette méthode tant en chimie minérale qu’en chimie organique, qu’il s’agisse d’analyse chimique ou d’études ayant un caractère fondamental.
De nombreuses variantes ont été conçues et on parle aujourd’hui des polarographies. Ces méthodes ont en commun l’utilisation d’une électrode particulière appelée électrode à gouttes de mercure à la surface de laquelle on réalise une oxydation ou une réduction électrochimique en appliquant un potentiel selon un programme pré-établi. La mesure du courant d’électrolyse permet d’accéder à la concentration de la substance électrolysée.
1. Courbes intensité-potentiel et polarographie
Cas général
Soit l’expérience suivante: dans une solution qui contient du fer ferreux Fe2+, on plonge une électrode de potentiel fixe (électrode dite de référence) et une électrode de platine. On augmente alors lentement la différence de potentiel entre les deux électrodes, le montage étant réalisé de façon que l’électrode de platine fonctionne comme anode, c’est-à-dire qu’elle soit le siège d’une réaction d’oxydation. Tant que le potentiel de l’électrode de platine est faible, le courant est nul. Lorsque la tension croît, il arrive un moment où le potentiel de l’anode est suffisamment élevé pour que le fer ferreux soit oxydé en fer ferrique:
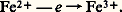
Les électrons sont cédés à l’électrode de platine par les ions Fe2+, et un courant électrique circule en sens inverse. Plus le potentiel de l’anode est élevé, plus le courant i est grand, c’est-à-dire plus la réaction électrochimique considérée est rapide.
Mais, pour que les ions Fe2+ soient oxydés à l’anode, encore faut-il qu’ils se déplacent du sein de la solution vers l’anode. D’une façon générale, le transport de matière dans une solution se fait par migration, diffusion et convection. La description que l’on rencontre dans tous les manuels: «Sous l’action du champ électrique, les anions se déplacent vers l’anode et les cations vers la cathode» ne correspond qu’au phénomène de migration , c’est-à-dire au passage du courant dans la solution. Ici, la migration n’est pas favorable à la poursuite de l’électrolyse puisque, par migration, les ions Fe2+ se déplacent vers la cathode et non vers l’anode.
La diffusion est un phénomène général qui se produit chaque fois que dans un fluide les concentrations des différentes substances ne sont pas homogènes et qui tend à annuler ces écarts de concentration. Ainsi, au cours de l’électrolyse considérée, la concentration en Fe2+ au voisinage de l’anode diminue puisque les ions Fe2+ sont consommés à l’anode. Il en résulte un mouvement des ions Fe2+ du sein de la solution vers l’anode.
Enfin, les corps peuvent se déplacer dans la solution, en provoquant une agitation de celle-ci. On parle alors de convection .
En polarographie et, d’une façon générale, dans toutes les méthodes d’analyse électrochimique, on opère dans des conditions telles que les ions à doser ne puissent arriver aux électrodes que par diffusion. À cet effet, on ajoute à la solution un excès de ce qu’on appelle un «électrolyte indifférent», c’est-à-dire un électrolyte dont les ions réagissent plus difficilement aux électrodes que les ions à doser. C’est le cas, par exemple, des perchlorates alcalins, des chlorures alcalins. La concentration de l’électrolyte indifférent doit être de cent à mille fois plus grande que celle du corps à doser. On conçoit dès lors que, étant en excès, les ions de l’électrolyte indifférent assurent pratiquement la totalité du courant par migration.
Au cours de l’électrolyse d’une solution de Fe2+ additionnée d’un excès de perchlorate de sodium par exemple, lorsque le potentiel de l’anode augmente, les ions Fe2+ sont oxydés et le courant croît, mais pas indéfiniment. Il est en effet limité par la vitesse de diffusion des ions Fe2+ à l’électrode, vitesse proportionnelle à la différence entre les concentrations en Fe2+ au sein de la solution et au voisinage immédiat de l’électrode. Lorsque l’électrolyse est suffisamment rapide, la concentration en Fe2+ à l’électrode devient nulle et la vitesse de diffusion de Fe2+ ne peut plus augmenter. Il en résulte que le courant d’électrolyse tend vers une limite que l’on appelle «courant limite de diffusion», proportionnel à la concentration en Fe2+ au sein de la solution. À partir de ce moment, tous les ions Fe2+ qui arrivent à l’électrode sont immédiatement oxydés.
Avec une électrode de surface suffisamment petite pour que l’intensité du courant limite de diffusion soit très faible, la quantité de substance électrolysée est toujours négligeable par rapport à celle qui reste dans la solution. La polarographie est donc une microélectrolyse indicatrice de la concentration de l’espèce électrolysée sans modifier cette concentration.
On obtient une courbe intensité-potentiel telle que celle qui est représentée sur la figure 1. L’ordonnée limite id est proportionnelle à la concentration de l’ion électrolysé. Sa position dans l’échelle des potentiels, que l’on caractérise généralement par le potentiel pour lequel: i = id /2 (potentiel de demi-vague, E1/2), est caractéristique de l’ion électrolysé. Le tracé des courbes intensité-potentiel peut donc servir à la fois à des fins d’identification et de dosage. Lorsqu’il y a plusieurs corps électrolysables en solution, les intensités sont additives et l’on obtient des courbes semblables à celle de la figure 1, avec des vagues dont les hauteurs sont proportionnelles aux concentrations des différentes substances électrolysées.
L’électrode à gouttes de mercure
L’électrode à gouttes de mercure est l’électrode indicatrice utilisée en polarographie. Elle est constituée d’un tube de verre capillaire, de 3 à 5/100 mm de diamètre et de quelques centimètres de longueur, par lequel le mercure s’écoule dans la solution sous forme de fines gouttelettes sphériques se détachant à des intervalles de temps réguliers. L’écoulement du métal est assuré par la pression d’une colonne de mercure de hauteur suffisante pour que le temps de formation d’une goutte (temps de goutte) soit compris entre deux et six secondes (fig. 2).
Cette électrode, en apparence assez compliquée, a été choisie pour tracer les courbes intensité-potentiel parce qu’elle permet d’obtenir des résultats reproductibles. En effet, les caractéristiques géométriques de l’électrode sont bien définies d’une goutte à l’autre si la hauteur de la colonne de mercure est constante. D’autre part, la surface du mercure est sans cesse renouvelée de sorte qu’il n’y a pas de contamination de l’électrode par des substances susceptibles de s’y déposer. Enfin, elle a un avantage commun à toutes les électrodes de mercure: les ions H+ et l’eau y sont beaucoup plus difficilement réductibles que ne le prévoit le potentiel théorique. Par suite, de nombreuses espèces et, en particulier, de nombreux cations métalliques sont plus facilement réductibles que les ions H+ et peuvent être dosés par réduction.
On remarquera qu’en tombant la goutte agite la solution et élimine pour une large part l’effet d’appauvrissement par électrolyse: chaque goutte constitue, à elle seule, une expérience en soi.
Les vagues polarographiques, ou polarogrammes
On appelle «vagues polarographiques», ou polarogrammes, les courbes intensité-potentiel obtenues avec l’électrode à gouttes de mercure. Celle-ci étant constituée par une goutte en formation, sa surface varie continuellement au cours de l’électrolyse. De ce fait, à potentiel constant, le courant d’électrolyse croît en valeur absolue pendant le temps de goutte. L’équation du courant limite de diffusion a été établie mathématiquement par Ilkovic. On a, à 25 0C:

expression dans laquelle: i est le courant d’électrolyse exprimé en microampère, n le nombre d’électrons mis en jeu dans la réaction électrochimique, D le coefficient de diffusion de l’espèce électrolysée (en cm2/s), m la vitesse d’écoulement du mercure en milligramme par seconde, t le temps en seconde, C la concentration en millimole par litre.
La variation de i en fonction du temps est représentée sur la figure 3. En principe, le courant s’annule brusquement chaque fois qu’une goutte se détache du capillaire, mais cela ne peut être observé qu’à l’oscillographe cathodique. Dans la pratique, on utilise un galvanomètre dont l’inertie fait que l’on n’observe jamais les courbes courant-temps complètes. Finalement, on obtient des courbes intensité-potentiel présentant des oscillations du courant (fig. 4).
On peut définir un courant moyen pendant la durée de vie de chaque goutte:

精 étant le temps de goutte.
On aboutit à:

Cette expression du courant moyen (de même que celle de i ) n’est qu’approchée, et des expressions plus complexes ont été données. Toutefois, les corrections sont faibles, et les expressions précédentes sont largement suffisantes dans la pratique.
2. Mise en œuvre technique
Les différents facteurs
La vitesse m d’écoulement du mercure est proportionnelle à la hauteur h de la colonne de mercure; le temps de goutte est, lui, inversement proportionnel à h . Il en résulte que le produit m 2/3 精1/6, donc 稜 , est proportionnel à la racine carrée de h , ce qui permet de s’assurer que le courant observé est bien dû à la limitation du courant d’électrolyse par diffusion de l’espèce électrolysée.
Le coefficient de diffusion D dépend de la viscosité de la solution et de la solvatation des espèces électrolysées. Tous les facteurs de l’équation d’Ilkovic, à l’exception de n , dépendent de la température. Pratiquement, les courants de diffusion augmentent de 1 à 2 p. 100 par degré Celsius, d’où la nécessité de réguler la température lorsqu’une grande précision est recherchée. Enfin, et c’est là le point le plus important, le courant de diffusion est proportionnel à la concentration de l’espèce électrolysée. On pourrait penser utiliser l’équation d’Ilkovic pour déterminer C (en mesurant 稜 , D, m et 精), mais, dans la pratique, on procède toujours par étalonnage.
On encadre le polarogramme de la solution inconnue par ceux de solutions étalons de concentrations aussi voisines que possible de celle que l’on veut déterminer. La méthode des ajouts dosés est également commode. On trace le polarogramme de la solution à doser, puis celui de la même solution additionnée d’une qualité connue de l’ion dosé. La hauteur de la vague est augmentée. Une simple règle de trois permet d’en déduire la concentration.
Enfin, une des méthodes les plus précises et les plus rapides est celle dite de l’ion pilote ; elle est fondée sur le fait que le rapport des vagues correspondant à deux substances présentes dans la même solution est pratiquement indépendant de la température et des caractéristiques du capillaire. Si l’on veut, par exemple, doser le plomb dans un échantillon, on ajoute à la solution une quantité connue de cadmium et on trace le polarogramme correspondant, ainsi que celui d’une solution connue de plomb et de cadmium. On peut alors comparer les rapports des deux vagues.
Mise en œuvre de la méthode
Il existe de nombreux polarographes enregistreurs commerciaux permettant une mise en œuvre simple de la méthode et son application aux dosages en série. Quelques précautions doivent cependant être prises lors du tracé d’un polarogramme. Tout d’abord, la solution ne doit pas être agitée, et il faut éviter tous les mouvements de convection parasites dus, par exemple, à des vibrations. D’autre part, les solutions aqueuses contiennent toujours de l’oxygène dissous, qui est facilement réductible. La vague de l’oxygène vient donc perturber le dosage de la plupart des substances électroactives. On élimine l’oxygène par barbotage préalable pendant une vingtaine de minutes d’un gaz inerte comme l’azote.
Enfin, les vagues polarographiques présentent parfois des anomalies désignées sous le nom de maximums polarographiques. L’interprétation de ce phénomène a donné lieu à de nombreux travaux. Il semble que les maximums soient dus à des mouvements tangentiels de solution à la surface de la goutte. On les supprime généralement par addition de très petites quantités de substances tensioactives telles que la gélatine, certains colorants comme le rouge de méthyle, etc. Une trop grande concentration de «suppresseur» perturbe les courbes de sorte que la quantité ajoutée doit rester faible. Elle doit, de plus, être la même pour les solutions étalons et la solution à doser.
Caractéristiques de la méthode
La polarographie est surtout utilisée pour le dosage de faibles concentrations de sorte que la sensibilité de la méthode est l’une de ses caractéristiques fondamentales.
Contrairement à ce que l’on pourrait penser, la sensibilité n’est pas limitée par des difficultés de mesure des faibles courants de diffusion, mais par l’existence d’un courant parasite, appelé «courant capacitif», qui est dû à ce que l’interface entre un métal et une solution porte une double couche électrique et se comporte comme un condensateur; le courant capacitif dépend de nombreux facteurs, mais il est de l’ordre de 10 size=1漣7 à 10 size=1漣8 A, ce qui est l’ordre de grandeur des courants de diffusion pour des solutions ayant une concentration de 10 size=1漣5 à 10 size=1漣6 mole/1. La limite de sensibilité de la polarographie classique est ainsi de 10 size=1漣5 à 10 size=1漣6 mole/l, ce qui correspond, pour un élément de masse atomique 100, à des concentrations de 0,1 à 1 milligramme par litre. La polarographie est donc une méthode d’analyse des traces .
Comme elle permet l’analyse de mélanges (fig. 1), une autre caractéristique importante est sa sélectivité . En pratique, il faut, pour obtenir des vagues distinctes, que les potentiels de demi-vague diffèrent d’au moins 150 à 200 mV. La précision est de l’ordre de 1 à 2 p. 100 pour des concentrations de 10 size=1漣3 à 10 size=1漣4 mole/l (10 à 100 mg/l pour un élément de masse atomique 100). Aux concentrations de 10 size=1漣5 mole/l, la précision est de 5 p. 100 environ.
3. Applications
En chimie inorganique, la polarographie est une méthode de choix pour le dosage des faibles quantités. Elle est utilisée pour l’analyse de minerais, d’alliages, des eaux. Certains corps non électroactifs peuvent être dosés. Par exemple, pour doser les ions sulfate S42 size=1漣, on peut les précipiter à l’état de sulfate de plomb PbS4, puis redissoudre le précipité en milieu acétate et doser le plomb par polarographie.
En chimie organique, on opère souvent non plus en solution aqueuse, mais dans des solvants organiques ou des mélanges eau-solvant. La polarographie sert ainsi au dosage des aldéhydes, des cétones, des dérivés nitrés aliphatiques et aromatiques, des azoïques, de certaines vitamines, des stéroïdes. En biologie, des dispositifs spéciaux permettent d’effectuer des dosages sur quelques gouttes de solution.
De nombreuses études ont été entreprises au cours des années soixante pour accroître la sensibilité et la sélectivité de la polarographie. Avec le développement de l’électronique, on a vu apparaître des méthodes utilisant un appareillage beaucoup plus complexe que la polarographie classique, comme la voltampérométrie cyclique et la polarographie à tension surimposée, développée ci-dessous.
Polarographie à tension surimposée (tension sinusoïdale, tension carrée, impulsions)
Il existe toute une série de méthodes dans lesquelles à une tension continue entre l’électrode à gouttes de mercure et l’électrode de référence, tension qui varie lentement de manière à balayer le domaine de potentiel intéressant, on superpose – à chaque goutte, dont la durée de vie est de quelques secondes – une tension de faible amplitude qui peut être une tension sinusoïdale, une tension carrée ou encore une impulsion de tension. La méthode la plus importante est la polarographie à impulsions. La figure 5 représente la programmation du potentiel sur plusieurs gouttes: à un instant déterminé de la vie de la goutte on applique une impulsion de tension d’une durée de 5 à 100 milli-secondes. Le courant d’électrolyse résultant comporte plusieurs composantes, l’une, continue, que l’on élimine, la seconde, capacitive, qui décroît rapidement au cours de l’impulsion et la troisième, liée à l’impulsion. En effectuant la mesure du courant vers la fin de l’impulsion, on ne mesure que cette troisième composante.
Les courbes courant-potentiel obtenues ont la forme de pics symétriques par rapport à un potentiel voisin de E1/2 et leur hauteur est proportionnelle à la concentration de l’espèce électrolysée. Le courant capacitif étant éliminé, on obtient des gains de sensibilité considérables: de 10 size=1漣8 à 10 size=1漣9 mol . l size=1漣1 en polarographie à impulsions, soit 0,001 mg . l size=1漣1 (fig. 6) pour un élément de masse atomique 100 (une partie par milliard).
Il existe des appareils commerciaux utilisant toutes les ressources de l’électronique et des microprocesseurs qui en font des techniques d’une grande valeur dans le domaine de l’analyse des traces tant en chimie inorganique qu’en chimie organique.
● polarographie nom féminin Méthode d'analyse des métaux dans les solutions salines, qui repose sur la mesure de la tension de polarisation dans l'électrolyse. (La polarographie permet d'identifier les ions et de mesurer la concentration ionique d'une solution.)
⇒POLAROGRAPHIE, subst. fém.
PHYS. Mesure et enregistrement des variations de potentiel lors du passage d'un courant électrique à travers une solution. La polarographie est aussi à l'origine des titrages ampérométriques (Hist. gén. sc., t.3, vol. 2, 1964, p.415).
Prononc.:[ ]. Étymol. et Hist. 1959 (DUVAL). Comp. de polaro-, v. polari- et -graphie, d'apr. polarographe. On note déjà polarography «id.» en 1936 en angl. (v. NED Suppl.2). Bbg. DUB. Dér. 1962, p.50.
]. Étymol. et Hist. 1959 (DUVAL). Comp. de polaro-, v. polari- et -graphie, d'apr. polarographe. On note déjà polarography «id.» en 1936 en angl. (v. NED Suppl.2). Bbg. DUB. Dér. 1962, p.50.
 ]. Étymol. et Hist. 1959 (DUVAL). Comp. de polaro-, v. polari- et -graphie, d'apr. polarographe. On note déjà polarography «id.» en 1936 en angl. (v. NED Suppl.2). Bbg. DUB. Dér. 1962, p.50.
]. Étymol. et Hist. 1959 (DUVAL). Comp. de polaro-, v. polari- et -graphie, d'apr. polarographe. On note déjà polarography «id.» en 1936 en angl. (v. NED Suppl.2). Bbg. DUB. Dér. 1962, p.50.
polarographie [pɔlaʀɔgʀafi] n. f.
ÉTYM. Mil. XXe; de polar(isation), et -graphie.
❖
♦ Sc. Établissement de la courbe de polarisation, dans une électrolyse (→ Électro-analyse).
➪ tableau Vocabulaire de la chimie.
❖
DÉR. Polarographique.
Encyclopédie Universelle. 2012.