THERMODYNAMIQUE
LA THERMODYNAMIQUE est une science relativement jeune. Elle a pris naissance au XIXe siècle sous la forme d’une discipline embrassant l’étude de toutes les transformations qui s’accomplissent à notre échelle (phénomènes macroscopiques), c’est-à-dire aussi bien les changements d’états physicochimiques que les changements de positions seuls envisagés en mécanique. Elle concerne à la fois les systèmes dits ouverts , parce qu’ils peuvent échanger de la matière et de l’énergie avec le milieu extérieur, les systèmes fermés , qui n’échangent que de l’énergie avec le monde ambiant, et les systèmes isolés , privés de tout échange.
Elle repose sur deux propositions fondamentales. L’une, appelée premier principe de la thermodynamique, introduit le concept d’énergie et exprime une propriété de conservation impliquant que l’énergie, considérée sous toutes ses formes, doit rester constante au cours de la transformation d’un système isolé. L’autre, appelée second principe , introduit le concept plus subtil d’entropie et exprime une propriété d’évolution impliquant que, dans un système isolé, l’entropie ne peut que croître, ou demeurer constante à l’état d’équilibre [cf. ENTROPIE].
La principale originalité du second principe repose précisément sur cette propriété d’évolution, nécessairement associée à la direction du temps. Les travaux de L. Boltzmann (1844-1906), en théorie des gaz, relatifs à ce même concept d’entropie, interprété du point de vue mécanique à l’échelle moléculaire, ont permis d’assimiler la notion d’accroissement d’entropie à l’évolution ordredésordre qui caractérise tout système isolé. Mais, en dépit de ce résultat dont l’influence sur le développement ultérieur de la thermodynamique fut considérable, la conséquence la plus directe fut l’élaboration d’une discipline macroscopique autonome, applicable aux systèmes complexes, comportant le concept d’irréversibilité , ayant son génie propre, en accord avec celui de la mécanique mais toutefois distinct sous le rapport de ses principes fondamentaux.
D’un point de vue historique, les deux principes trouvent leur origine dans le non-possumus du moteur perpétuel (premier principe) et dans celui du mouvement perpétuel (second principe). La première présentation d’une théorie complète remonte à l’œuvre de R. J. E. Clausius (1822-1888), publiée en 1850 sous le nom de Abhandlungen über die mecanische Wärme Theorie . L’ampleur des vues de l’auteur est manifeste dans son interprétation du contenu des deux principes: L’énergie du monde est constante et L’entropie du monde tend vers un maximum . Cette généralisation imagée mais audacieuse d’un système isolé fut, par la suite, l’objet de plusieurs controverses. Après Clausius et ses contemporains W. Thomson (lord Kelvin, 1824-1907) et E. Clapeyron (1799-1864), il faut citer l’école des énergétistes et principalement: P. Duhem (1861-1916), H. von Helmholtz (1821-1894), W. Ostwald (1853-1932), W. J. M. Rankine (1820-1872). Mais, en dépit de toutes ces contributions à une doctrine de portée générale, le succès recueilli par une telle thermodynamique strictement phénoménologique devait bientôt être limité au seul domaine des états d’équilibre , faute d’informations plus complètes que la seule inégalité de Clausius propre aux processus irréversibles. La contribution la plus importante a été fournie, en 1876, par J. W. Gibbs (1839-1903) avec son Equilibrium of Heterogeneous Substances . Cette œuvre est regardée aujourd’hui comme la base de la physicochimie. Des compléments importants ont été apportés quelques années plus tard par Duhem.
Ce n’est qu’après 1920 que l’intérêt se porte à nouveau vers la thermodynamique des processus hors d’équilibre, spécialement avec l’introduction, en 1922, de la notion d’affinité chimique par T. De Donder (1872-1957) et, en 1931, des lois de réciprocité de L. Onsager sur les coefficients phénoménologiques intervenant dans les lois de cinétique linéaire. On envisage ici les lois unissant les courants irréversibles Ji (chaleur, diffusion...) aux forces généralisées Xi (gradients thermiques, de potentiels...) tels qu’ils apparaissent dans l’expression bilinéaire obtenue pour la production d’entropie (cf. THERMODYNAMIQUE - Lois fondamentales, équation 15).
À présent, la thermodynamique des phénomènes irréversibles comporte deux chapitres essentiels. L’un, relativement simple et presque entièrement développé, concerne les phénomènes gouvernés par les cinétiques linéaires et les relations d’Onsager associées. Les problèmes de couplage rencontrés dans l’étude de la thermodiffusion et des différents effets Dufour, Peltier, etc., appartiennent à cette catégorie. L’autre chapitre, d’origine plus récente encore, correspond à la thermodynamique non linéaire: il gouverne les états éloignés de l’équilibre où interviennent les causes d’instabilité sous forme d’états marginaux pouvant éventuellement donner naissance à des structures dissipatives créatrices d’ordre. En fait, la thermodynamique non linéaire est encore à ses débuts, car elle reste limitée actuellement au domaine de validité de l’hypothèse dite de l’équilibre local selon lequel l’état d’un système peut être défini localement à l’aide des mêmes variables qu’à l’état d’équilibre. Mais déjà, sous cette forme, elle apporte une contribution importante pour l’approche physicochimique des problèmes biologiques ainsi que pour l’étude des effets combinés de dissipation et de convection en hydrodynamique.
On trouvera dans cet article une vue d’ensemble des trois étapes successives: la thermodynamique des états d’équilibre, la thermodynamique des processus irréversibles linéaires et enfin celle, plus récente, des processus non linéaires. Après quelques illustrations des principales applications à la technique et un bref examen épistémologique des lois de la thermodynamique au stade actuel de son développement, on examinera le lien entre biologie et physique. Pour cela, on essaiera de situer l’ordre biologique et de préciser sa dépendance vis-à-vis des lois de la thermodynamique. Observons à ce point de vue que, contrairement aux exposés strictement phénoménologiques, et donc indépendant de toute considération d’ordre microscopique, la thermodynamique admet l’existence de fluctuations et interprète les variables d’état comme des valeurs moyennes. On a pu en déduire ainsi de nouveaux critères de stabilité fondés sur le second théorème de Liapounov, une interprétation par l’analyse stochastique des bifurcations observées et, plus fondamentalement encore, le sens profond de la notion d’irréversibilité.
Ainsi, au-delà de la dynamique connue des systèmes définis par un petit nombre de degrés de liberté, vient se juxtaposer une dynamique des systèmes complexes à un grand nombre de degrés de liberté où apparaît cette notion d’irréversibilité totalement absente des lois de la dynamique régissant les systèmes simples.
À mesure que l’étude des interactions collectives intéresse davantage les recherches contemporaines dans toutes les disciplines confrontées à des systèmes complexes, le modèle thermodynamique est de plus en plus fréquemment invoqué. Toutefois, c’est généralement une extension appropriée du second principe lui-même qui fait le plus souvent défaut. L’interprétation des phénomènes irréversibles et des corollaires qui en dérivent (fluctuations, probabilités, flèche du temps, causalité) ont ranimé et raniment encore de nombreux débats philosophiques.
thermodynamique [ tɛrmodinamik ] n. f. et adj. ♦ Sc. Branche de la physique qui étudie tous les phénomènes dans lesquels interviennent les échanges thermiques. Principes de (la) thermodynamique (⇒ énergie [interne], enthalpie, entropie) . — Adj. Équilibre thermodynamique d'un système.
● thermodynamique nom féminin Branche de la physique qui étudie les propriétés des systèmes où interviennent les notions de température et de chaleur. ● thermodynamique adjectif Relatif à la thermodynamique.
thermodynamique
n. f. et adj. PHYS Partie de la physique qui étudie tous les phénomènes physiques ou chimiques où intervient la chaleur.
|| adj. Relatif à la thermodynamique.
Encycl. La thermodynamique repose essentiellement sur les principes suivants. Principe zéro: deux systèmes dont chacun est en équilibre thermique avec un troisième sont en équilibre thermique entre eux. Premier principe: la somme du travail W et de la chaleur Q échangés par un système avec le milieu extérieur au cours de son évolution entre deux états d'équilibre thermique 1 et 2 est égale à la variation d'une fonction de l'état du système, notée U, et appelée énergie interne: W + Q = U 2 - U 1. Second principe: il énonce l'irréversibilité des phénomènes naturels; on peut en déduire: un système qui décrit un cycle monotherme ne peut pas produire de travail (énoncé de Kelvin); le passage de la chaleur d'un corps froid à un corps chaud n'a jamais lieu spontanément (énoncé de Clausius). V. température.
⇒THERMODYNAMIQUE, subst. fém. et adj.
PHYSIQUE
I. — Subst. fém. Branche de la physique qui traite des échanges entre les diverses formes d'énergie, des états et des propriétés de la matière, des transformations d'état et des phénomènes de transport. La thermodynamique comprend l'étude des corps en tenant compte de l'influence de la température sur leurs caractéristiques (L. BOREL, Thermodyn. et énergétique, 1984, p. 1).
♦ Thermodynamique statistique. ,,Partie de la thermodynamique où l'on s'attache à retrouver les propriétés des corps et les fonctions de la thermodynamique en appliquant les méthodes statistiques, classiques ou quantiques, aux assemblages moléculaires que constituent ces corps`` (Industries 1986).
♦ Thermodynamique des phénomènes, des processus irréversibles. Branche de la thermodynamique qui étudie en particulier les processus de passage d'un état d'équilibre à un autre. La thermodynamique statistique, la thermodynamique des processus irréversibles ont ouvert démesurément les possibilités de cette science [la thermique] (La Rech. à l'École Centrale, déc. 1980, p. 297).
♦ Principes, lois de la thermodynamique. Ensemble de quatre propositions générales qui régissent des systèmes ainsi que leurs états d'équilibre. Les principes de la thermodynamique permettent de prévoir l'évolution macroscopique des systèmes et leurs états d'équilibre (GDEL).
II. — Adj. Relatif à, de la nature de la thermodynamique. Analyse, condition, équilibre thermodynamique; transformations thermodynamiques; grandeurs, variables thermodynamiques; propriétés thermodynamiques des corps. Helmholtz a édifié une théorie thermodynamique de la pile (H. POINCARÉ, Thermodyn., 1892, p. 344). En décembre 1981, à Targassonne (Pyrénées-Orientales), les deux cents miroirs de Thémis réfléchiront la lumière solaire vers une chaudière juchée sur une tour, à 100 mètres du sol. La chaleur deviendra électricité. Ce sera la première centrale solaire thermodynamique du monde (L'Express, 19 janv. 1980, p. 72, col. 2).
♦ Cycle thermodynamique. ,,Succession des états thermodynamiques par lesquels un système repasse indéfiniment, soit dans le temps (...), soit dans l'espace`` (L. BOREL, Thermodyn. et énergétique, 1984, p. 540).
♦ Diagramme thermodynamique. Description graphique de l'état thermodynamique d'un système utilisant un certain mode de représentation paramétrique. La division prévision (...) dresse [chaque jour] environ 200 diagrammes thermodynamiques concernant la structure verticale de l'atmosphère (Météor. fr., 1963, p. 10).
♦ État thermodynamique. L'état thermodynamique d'un système est l'ensemble des propriétés qui le caractérisent, indépendamment de la forme de sa frontière (L. BOREL, Thermodyn. et énergétique, 1984, p. 5).
♦ Potentiel thermodynamique. Système thermodynamique.
Prononc. et Orth.:[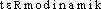 ]. Att. ds Ac. 1935. Étymol. et Hist. 1. 1864 subst. (Réponse aux deux notes de M. Dupré sur la thermodynamique, par W. Thomson, in Comptes Rendus de l'Ac. des Sc., t. 59, p. 705 ds QUEM. DDL à paraître; v. aussi QUEM. DDL t. 12); 2. 1892 adj. (H. POINCARÉ, op. cit., p. 233). Comp. de l'élém. formant thermo- et de dynamique subst., d'apr. l'angl. thermodynamics subst., att. dep. 1854 à la suite de l'adj. thermodynamic att. dep. 1849 (NED). Fréq. abs. littér.:14.
]. Att. ds Ac. 1935. Étymol. et Hist. 1. 1864 subst. (Réponse aux deux notes de M. Dupré sur la thermodynamique, par W. Thomson, in Comptes Rendus de l'Ac. des Sc., t. 59, p. 705 ds QUEM. DDL à paraître; v. aussi QUEM. DDL t. 12); 2. 1892 adj. (H. POINCARÉ, op. cit., p. 233). Comp. de l'élém. formant thermo- et de dynamique subst., d'apr. l'angl. thermodynamics subst., att. dep. 1854 à la suite de l'adj. thermodynamic att. dep. 1849 (NED). Fréq. abs. littér.:14.
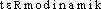 ]. Att. ds Ac. 1935. Étymol. et Hist. 1. 1864 subst. (Réponse aux deux notes de M. Dupré sur la thermodynamique, par W. Thomson, in Comptes Rendus de l'Ac. des Sc., t. 59, p. 705 ds QUEM. DDL à paraître; v. aussi QUEM. DDL t. 12); 2. 1892 adj. (H. POINCARÉ, op. cit., p. 233). Comp. de l'élém. formant thermo- et de dynamique subst., d'apr. l'angl. thermodynamics subst., att. dep. 1854 à la suite de l'adj. thermodynamic att. dep. 1849 (NED). Fréq. abs. littér.:14.
]. Att. ds Ac. 1935. Étymol. et Hist. 1. 1864 subst. (Réponse aux deux notes de M. Dupré sur la thermodynamique, par W. Thomson, in Comptes Rendus de l'Ac. des Sc., t. 59, p. 705 ds QUEM. DDL à paraître; v. aussi QUEM. DDL t. 12); 2. 1892 adj. (H. POINCARÉ, op. cit., p. 233). Comp. de l'élém. formant thermo- et de dynamique subst., d'apr. l'angl. thermodynamics subst., att. dep. 1854 à la suite de l'adj. thermodynamic att. dep. 1849 (NED). Fréq. abs. littér.:14.
thermodynamique [tɛʀmodinamik] n. f. et adj.
ÉTYM. 1867, in Rev. des cours sc., t. IV, p. 153; angl. thermodynamics (v. 1850); de thermo-, et dynamique.
❖
♦ Didactique.
1 N. f. Branche de la physique et de la chimie qui étudie les relations entre l'énergie thermique (chaleur) et mécanique (travail), et, par ext., les lois générales des phénomènes impliquant des échanges ou des transformations thermiques. || Principes, lois de la thermodynamique : 1re loi : conservation de l'énergie; 2e loi : la chaleur ne peut pas passer d'un corps froid à un corps chaud sans modification dans les autres corps (l'expression mathématique de cette loi fait intervenir, pour des transformations réversibles, l'entropie). ⇒ aussi Équivalent (mécanique), dégradation (de l'énergie); 3e loi : chaque substance possède une entropie positive finie qui devient nulle au zéro absolu. || Le second principe de la thermodynamique fut à l'origine de la théorie cinétique des gaz.
➪ tableau Noms de sciences et d'activités à caractère scientifique.
2 Adj. || Système, potentiel, quantité thermodynamique. || Équations thermodynamiques d'état, donnant pour des modifications réversibles, des relations entre la pression, le volume et la température d'un certain état de la matière. || Température thermodynamique. — Centrale thermodynamique. || « Production d'électricité d'origine thermodynamique ou photovoltaïque » (la Recherche, juin 1979, p. 694).
❖
DÉR. Thermodynamicien, thermodynamiquement.
Encyclopédie Universelle. 2012.