FLUOR
Élément chimique de symbole F et de numéro atomique 9, le premier de la famille des halogènes, le fluor est le plus électronégatif et le plus réactif de tous les éléments chimiques. C’est un gaz faiblement coloré en jaune verdâtre dont l’odeur très forte et irritante rappelle celle de l’ozone. Son inhalation, très nocive, et la brutalité avec laquelle il réagit avec les composés organiques et certains dérivés minéraux en font un produit dangereux que l’on fabrique le plus souvent sur les lieux d’utilisation (usines de séparation isotopique des hexafluorures d’uranium). Les recherches sur les dérivés du fluor, et notamment les composés organofluorés, sont cependant très activement poursuivies, car ces dérivés ont souvent une extraordinaire stabilité thermique et chimique.
État naturel et préparations
Le fluor est un élément relativement abondant dans l’écorce terrestre. Il serait plus abondant que le cuivre, par exemple. On le trouve toujours à l’état combiné. Il est présent sous forme de fluorure de silicium gazeux dans les fumerolles des volcans ainsi que dissous dans les eaux thermales. La source essentielle de fluor est constituée, cependant, par des minerais dont les principaux sont la cryolite (Na3Al6) et la fluorine, ou spath-fluor (CaF2). Le mot «fluor», qui en latin signifie écoulement, provient d’ailleurs de l’utilisation de la fluorine en métallurgie pour la fluidification des scories. On le rencontre également combiné à un grand nombre d’oxydes sous forme de fluosilicates ou de fluorapatites.
Le fluor est aussi présent dans les végétaux, et principalement dans les graminées. Il joue un rôle important dans le règne animal, où il se trouve essentiellement dans les os et les dents.
Bien que sa présence ait été soupçonnée dans les sels depuis longtemps, la préparation du fluor est relativement récente. La difficulté de cette préparation provient surtout de la réactivité du fluor qui, mis en liberté, réagit immédiatement avec la vapeur d’eau atmosphérique. C’est Henri Moissan qui, en 1886, réussit pour la première fois à l’isoler en électrolysant une solution de fluorure de potassium dans le fluorure d’hydrogène anhydre à l’aide d’électrodes de platine iridié auxquelles il appliquait une différence de potentiel de 50 V. Il maintenait son appareil à basse température pour éviter l’évaporation du gaz fluorhydrique, qui bout à 19 0C. Moissan obtenait ainsi du fluor au pôle positif et de l’hydrogène au pôle négatif. L’utilisation d’une membrane évitait la recombinaison des deux gaz.
Les méthodes modernes de préparation du fluor utilisent un principe similaire. Elles sont fondées sur l’électrolyse des sels fondus KH23 (t f = 70 0C) ou KH34 (t f = 56 0C). Les électrodes sont généralement en carbone. Le fluorure d’hydrogène utilisé pour préparer les fluorures acides de potassium provient de l’attaque de la fluorine par l’acide sulfurique:

Propriétés physiques
Premier élément du groupe VII du tableau de Mendeleïev, celui des halogènes, le fluor a pour masse atomique 18,998 4. Sa structure électronique fondamentale, 1 s 2, 2 s 2, 2 p 5, entraîne une grande aptitude à capter un électron pour prendre la structure à octet de son voisin, le néon. Cette propriété donne la possibilité au fluor d’établir un lien de covalence avec un autre atome de fluor, les deux atomes se prêtant chacun un électron pour conduire à la molécule 2. Cette molécule se dissocie cependant facilement, ce qui procure au fluor une grande réactivité. En effet, sa forme la plus stable est l’état ionique - acquis en prenant un électron à un autre atome:
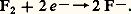
Le fluor naturel ne possède qu’un seul type nucléaire (19F). Des isotopes artificiels de masse atomique 17 à 22 ont pu cependant être obtenus.
Propriétés chimiques
Le développement de la chimie du fluor est relativement récent. Il a commencé pendant la Seconde Guerre mondiale, en Allemagne, où le fluor était utilisé pour la préparation de fluorures de chlore aux propriétés incendiaires, et aux États-Unis, pour la synthèse de l’hexafluorure d’uranium destiné à la séparation isotopique de l’uranium.
L’extrême réactivité du fluor, due partiellement à sa grande électronégativité et à la relative facilité avec laquelle se dissocie la molécule 2, procure à cet élément des propriétés chimiques exceptionnelles. Il réagit avec presque tous les éléments du tableau périodique, y compris certains gaz rares, ainsi qu’avec la plupart des substances organiques. Cette réactivité particulière explique la difficulté de sa manipulation, qui nécessite l’emploi à basse température de hauts polymères fluorés ou de métaux comme le cuivre ou l’aluminium. Au-delà de 300 0C, seuls des alliages à base de nickel ou des métaux précieux comme le platine ou l’iridium peuvent être utilisés.
Le mélange d’hydrogène et de fluor brûle quelle que soit sa composition. Tous les métaux sont attaqués en donnant naissance à des fluorures dans lesquels le métal possède un degré d’oxydation élevé. Un certain nombre d’entre eux, dans lesquels la liaison métal-fluor est essentiellement covalente, sont gazeux, comme le trifluorure de bore, le tétrafluorure de silicium ou l’hexafluorure d’uranium.
Le fluor réagit également avec les autres halogènes pour donner des combinaisons telles que I3, Br3, Cl3. Ces composés à liaisons essentiellement covalentes peuvent présenter, cependant, un caractère ionique qui leur confère une certaine conductibilité à l’état liquide. Le fluor se combine à l’oxygène; dans l’oxyde 2O, l’oxygène fournit un lien de covalence à chaque atome de fluor (F 漣 O 漣 F). Dans l’oxyde 22, c’est au contraire la molécule de fluor qui donne deux électrons à chaque atome d’oxygène (O 良 F 漣FO).
Les fluorures ioniques possèdent des structures apparentées à celles des oxydes. Cette propriété provient des longueurs voisines du rayon ionique de l’ion 2- et de l’ion -. On peut citer, par exemple, les fluorures alcalins LiF, NaF, KF... qui, comme les oxydes alcalino-terreux MgO, CaO, SrO..., possèdent la structure du chlorure de sodium. Les fluorures des métaux divalents (MgF2, Fe2, Ni2...) peuvent posséder la structure rutile comme les oxydes correspondants (VO2, Ti2, Mn2...). Il en est de même des fluorures ternaires: KFeF3, par exemple, est isotype de la perovskite CaTi3. Par le fait même, il existe de nombreux oxyfluorures dans lesquels le fluor peut se substituer partiellement ou totalement à l’oxygène: le minéral pyrochlore possède la composition CaNaTa26F. Malgré cette analogie, les fluorures ioniques et les oxydes correspondants diffèrent sensiblement par leurs propriétés électriques. En effet, les premiers sont électriquement isolants et les seconds souvent conducteurs. Par ailleurs, alors que de nombreux oxydes présentent une aimantation importante à la température ambiante, il est généralement nécessaire de refroidir les fluorures à de très basses températures pour qu’ils aient la même propriété.
Les composés fluorés organiques jouent un rôle considérable. Leur stabilité particulière contraste avec l’instabilité du fluor lui-même. Dans ces composés, le fluor complète sa couche p en y admettant un autre électron d’un radical organique.
Les réactions de fluoration des composés organiques utilisent généralement l’hydrogène fluoré lui-même ou un de ses composés d’addition:

La substitution des hydrogènes des fonctions carbure peut être totale. Elle conduira à des composés d’une stabilité exceptionnelle tels que C4 ou C3 漣 (CF2)2 漣 C3. Elle peut également être partielle comme dans CH3 漣 CH2.
Une classe importante de composés organiques chlorofluorés a pris le nom commercial de Fréon. On les note au moyen de trois indices: Fabc ; c indique le nombre d’atomes de fluor dans la molécule, b le nombre plus un d’atomes d’hydrogène et a le nombre moins un d’atomes de carbone. Lorsque a est nul, on ne le représente pas. Le trichloromonofluorométhane CCl3F est le 11, le dichlorodifluorométhane CCl22 est le 12 et le chloropentafluorométhane C2Cl5 est le 115.
Les composés organiques fluorés sont susceptibles d’être polymérisés. Ainsi la polymérisation du tétrafluoroéthylène conduit au Téflon. Celle du fluorotrichloroéthylène donne des lubrifiants qui résistent mieux à la chaleur que les hydrocarbures correspondants.
Action physiologique
Le fluor présente une très grande toxicité. Sa présence dans l’air pour des teneurs inférieures à deux parties par million provoque de graves troubles respiratoires; on doit les combattre par l’inhalation d’oxygène, qui évite le développement d’œdèmes pulmonaires. Ce danger est cependant minimisé, car son odeur pénétrante permet de le détecter à des concentrations de 0,02 p.p.m. Le fluor ainsi que l’acide fluorhydrique provoquent de graves brûlures de la peau.
Applications
Le fluor et surtout ses dérivés connaissent de multiples applications dans des domaines variés.
Le fluor est utilisé en thérapeutique. Son emploi le plus courant est la prophylaxie de la carie dentaire. À cet effet, certains pays introduisent systématiquement du fluor dans les eaux de consommation. Le fluorure de sodium sert pour le traitement des retards de calcification. Le fluor est également utilisé dans des médicaments de nature organique, où il peut, selon les cas, exalter ou diminuer certaines actions biologiques. Citons entre autres exemples la 9 見-fluorohydrocortisone, anti-inflammatoire puissant, dont l’action est dix fois plus forte que celle de l’hydrocortisone.
La plus ancienne utilisation d’un composé fluoré est sans doute la gravure sur verre réalisée à l’aide d’acide fluorhydrique dès le XVIIe siècle. Cet acide sert actuellement à de nombreuses synthèses organiques et en particulier à l’alkylation de l’essence.
Les dérivés fluorés les plus utilisés sont les Fréons: ils constituent avec l’ammoniac les principaux fluides frigorigènes. En effet, ces composés possèdent des points d’ébullition extrêmement différents suivant leur composition. Les Fréons servent à la fabrication de mousses synthétiques et sont utilisés comme gaz propulseurs dans les aérosols. Ils exercent une action nocive sur leur environnement: le chlore libéré réagit avec l’ozone et contribue à la destruction de celui-ci.
Les hauts polymères fluorés huileux ou solides, dont le plus commun a pris le nom commercial de Téflon, ont une importance industrielle considérable en raison de leur remarquable résistance à la corrosion.
Certains composés fluorés sont de puissants catalyseurs industriels. C’est le cas de B3 qui, employé dans la condensation des hydrocarbures éthyléniques avec les hydrocarbures saturés, permet l’obtention d’hydrocarbures à indice d’octane élevé.
La séparation de l’uranium 235, isotope dont la fission est à l’origine de l’énergie nucléaire, de son isotope l’uranium 238 nécessite, quel que soit le procédé utilisé (diffusion ou ultracentrifugation), l’emploi d’un composé gazeux de l’uranium. Seul le fluorure U6 possède cette propriété, ce qui explique l’étroite liaison de la chimie du fluor avec les techniques nucléaires. La manipulation de l’hexafluorure d’uranium pose de nombreux problèmes en raison de son hygroscopicité, qui entraîne la formation d’oxydes ou d’oxyfluorures d’uranium solides diminuant le rendement de la séparation et d’acide fluorhydrique provoquant d’importantes corrosions:
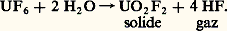
Le fluor peut être également utilisé dans le domaine spatial. En effet, la réaction du fluor sur l’hydrogène, qui provoque la formation d’hydrogène fluoré, libère une énergie considérable. Le mélange fluor-hydrogène présente une impulsion spécifique supérieure à celle obtenue avec les mélanges oxygène-hydrogène actuellement employés pour la propulsion des fusées. Si l’utilisation du fluor liquide est limitée par les problèmes de corrosion, il semble cependant que le fluorure d’oxygène 2O, moins corrosif que le fluor, soit actuellement utilisé.
Le dépôt de films minces de fluorures métalliques, comme le fluorure de magnésium sur les lentilles d’appareillages optiques, diminue l’intensité de la lumière réfléchie et augmente donc la luminosité. La cryolite Na3Al6 sert de fondant de l’alumine dans la métallurgie de l’aluminium.
Le fluor représente un tonnage relativement faible dans la production de l’industrie chimique. La chimie du fluor, élément exceptionnel par ses propriétés, est riche de promesses par la diversité de ses applications. Mais, d’ores et déjà, on peut donner une réponse affirmative à la question que posait Moissan: «Le fluor aura-t-il jamais des applications? Il est bien difficile de répondre à cette question. D’ailleurs, je puis le dire en toute sincérité, je n’y pensais guère au moment où j’ai entrepris ces recherches, et je crois que tous les chimistes qui ont tenté ces expériences avant moi n’y pensaient pas davantage. Une recherche scientifique est une recherche de la vérité...»
fluor [ flyɔr ] adj. et n. m.
• 1723; flueur 1534; lat. fluor « écoulement »
1 ♦ Adj. et n. Vx Minéral fusible ou utilisable comme fondant. Mod. Spath fluor. ⇒ fluorine.
2 ♦ N. m. (1823) Mod. Élément atomique (F; no at. 9; m. at. 19) du groupe des halogènes, gaz toxique jaune pâle. Fluor à l'état naturel. ⇒ cryolithe, fluorine. Dentifrice au fluor. Intoxication par le fluor. ⇒ fluorose.
● fluor nom masculin (latin fluor, -oris, écoulement) Corps simple, premier élément de la famille des halogènes. (Élément chimique de symbole F.) ● fluor (expressions) nom masculin (latin fluor, -oris, écoulement) Spath fluor, synonyme de fluorite. ● fluor (synonymes) nom masculin (latin fluor, -oris, écoulement) Spath fluor
Synonymes :
- fluorite
fluor
n. m. CHIM élément appartenant à la famille des halogènes (symbole F), de numéro atomique Z = 9.
— Gaz (F 2: difluor).
Encycl. Le fluor est le plus électronégatif et le plus réactif de tous les éléments; oxydant très énergique, il se combine avec presque tous les éléments, donnant notam. des fluorures (composés dans lesquels le fluor possède le degré d'oxydation -1); l'hexafluorure d'uranium UF 6 est utilisé dans la séparation isotopique de l'uranium par diffusion gazeuse. Les fréons sont des composés du fluor: V. fluorocarboné (encycl.). Le téflon est une matière plastique fluorée que l'on obtient par polymérisation et qui supporte l'attaque de nombreux agents physiques et chimiques. Enfin, le fluor est un oligo-élément de l'organisme dont les propriétés sont encore mal connues. Une intoxication aiguë par le fluor ou ses dérivés peut entraîner des troubles extrêmement graves.
⇒FLUOR, adj. et subst. masc.
I.— Adj., rare. Liquide, fondant.
A.— Vx. Alcali fluor. Alcali volatil liquide. Il faut d'abord scarifier légèrement l'endroit de la blessure, et ensuite y faire des fomentations avec l'alkali volatil (...). En même temps on fait avaler au malade cinq ou six gouttes du même alkali fluor (GEOFFROY, Méd. pratique, 1800, p. 516).
B.— Spath(-)fluor (en métall. ou vx.). Synon. de fluorine. Vase, candélabre de spath fluor (Ac. 1835, 1878). Le spath fluor en octaèdres réguliers (Voy. La Pérouse, 1797, p. 169). Le gypse (...) donne avec le spath fluor un verre qui devient opaque par refroidissement (LAPPARENT, Minér., 1899, p. 529). V. infra dér. fluorhydrique citat. de Bourget.
II.— Subst. masc. Corps simple gazeux, premier élément de la famille des Halogènes, de couleur jaune pâle, d'odeur irritante et d'une très grande activité chimique. Les rayons ioniques du fluor et de l'oxygène, déterminés par S.A. Wasastjerna (1923) (Hist. gén. sc., t. 3, vol. 2, 1964, p. 480). Le fluor est un constituant normal des dents (0,01 %) (...). Il intervient dans la prévention de la carie dentaire de façon certaine, mais selon un mécanisme mal élucidé (TOUIT.-PERL. 1976). V. fluaté citat. de Élie de Beaumont, s.v. fluorure :
• Le bore ayant une grande affinité pour le fluor et formant avec lui une combinaison indécomposable par la chaleur et très volatile, on est porté à supposer que le transport de ce corps s'est fait aussi à l'état de fluorure.
ÉLIE DE BEAUMONT, B. Sté géol. Fr., t. 4, 1847, p. 66.
Prononc. et Orth. :[ ]. Ds Ac. 1762-1932 (au plur. ds 1762 et 1798). Étymol. et Hist. [1687 d'apr. BL.-W.3-5] 1723 (SAVARY DES BRUSLONS, Dict. de Commerce ds DG); 1823 chim. (Saigey ds COURTIN, Encycl. moderne ds QUEM. DDL t. 15). Lat. fluor « écoulement » employé par Agricola (1546, De Re Metallica d'apr. NED) pour désigner des minéraux se présentant dans la nature comme s'ils avaient été formés par confluence de roches. Certains de ces minéraux contenant un composé fréquemment utilisé, le corps simple représenté par ce composé a été dénommé fluor et le composé fluorine. Par ailleurs le lat. fluor est à l'orig. de l'a. fr. flors « menstrues » (cf. T.-L.) et du m. fr. flueur « écoulement » (cf. GDF.). Fréq. abs. littér. :9.
]. Ds Ac. 1762-1932 (au plur. ds 1762 et 1798). Étymol. et Hist. [1687 d'apr. BL.-W.3-5] 1723 (SAVARY DES BRUSLONS, Dict. de Commerce ds DG); 1823 chim. (Saigey ds COURTIN, Encycl. moderne ds QUEM. DDL t. 15). Lat. fluor « écoulement » employé par Agricola (1546, De Re Metallica d'apr. NED) pour désigner des minéraux se présentant dans la nature comme s'ils avaient été formés par confluence de roches. Certains de ces minéraux contenant un composé fréquemment utilisé, le corps simple représenté par ce composé a été dénommé fluor et le composé fluorine. Par ailleurs le lat. fluor est à l'orig. de l'a. fr. flors « menstrues » (cf. T.-L.) et du m. fr. flueur « écoulement » (cf. GDF.). Fréq. abs. littér. :9.
 ]. Ds Ac. 1762-1932 (au plur. ds 1762 et 1798). Étymol. et Hist. [1687 d'apr. BL.-W.3-5] 1723 (SAVARY DES BRUSLONS, Dict. de Commerce ds DG); 1823 chim. (Saigey ds COURTIN, Encycl. moderne ds QUEM. DDL t. 15). Lat. fluor « écoulement » employé par Agricola (1546, De Re Metallica d'apr. NED) pour désigner des minéraux se présentant dans la nature comme s'ils avaient été formés par confluence de roches. Certains de ces minéraux contenant un composé fréquemment utilisé, le corps simple représenté par ce composé a été dénommé fluor et le composé fluorine. Par ailleurs le lat. fluor est à l'orig. de l'a. fr. flors « menstrues » (cf. T.-L.) et du m. fr. flueur « écoulement » (cf. GDF.). Fréq. abs. littér. :9.
]. Ds Ac. 1762-1932 (au plur. ds 1762 et 1798). Étymol. et Hist. [1687 d'apr. BL.-W.3-5] 1723 (SAVARY DES BRUSLONS, Dict. de Commerce ds DG); 1823 chim. (Saigey ds COURTIN, Encycl. moderne ds QUEM. DDL t. 15). Lat. fluor « écoulement » employé par Agricola (1546, De Re Metallica d'apr. NED) pour désigner des minéraux se présentant dans la nature comme s'ils avaient été formés par confluence de roches. Certains de ces minéraux contenant un composé fréquemment utilisé, le corps simple représenté par ce composé a été dénommé fluor et le composé fluorine. Par ailleurs le lat. fluor est à l'orig. de l'a. fr. flors « menstrues » (cf. T.-L.) et du m. fr. flueur « écoulement » (cf. GDF.). Fréq. abs. littér. :9.DÉR. 1. Fluoré, ée, adj. [En parlant d'un composé chimique] Qui contient du fluor. Les satellites les plus constants de l'étain sont les « composés fluorés », principalement les fluo-silicates, quelquefois les fluo-phosphates ou des fluorures (ÉLIE DE BEAUMONT, B. sté géol. Fr., t. 4, 1847, p. 66). Le glucinium est obtenu par électrolyse d'un mélange de sels qui est le plus souvent constitué par de l'oxyfluorure de glucinium, le fluorure de sodium et le fluorure de baryum; on a soin de recueillir les produits fluorés qui prennent naissance à l'état gazeux (GUILLET, Techn. métall., 1944, p. 80). Cf. attaquable ex. 5. — [ ]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, suff. -é. 2. Fluorhydrique, adj. Acide fluorhydrique. Acide composé du fluor et de l'hydrogène. On l'emploie, cet acide [fluorhydrique], à la gravure du verre et à la conservation des pierres. Réagissant sur le sable, l'acide fluorhydrique, venu du spath-fluor, donne un gaz, le fluorure de silicium, qui, au contact de l'eau, fournit l'acide hydrofluosilique. Avec une solution d'un sel de ce dernier, un hypofluosilicate (BOURGET, Actes suivent, 1926, p. 25). On traite 1 g environ de poudre de verre bien sèche par l'acide fluorhydrique et chauffe doucement sur le bain de sable. Le fluorure de silicium SiF4 disparaît et il reste les fluorures métalliques (C. DUVAL, Verre, 1966, p. 13). Cf. attaquable ex. 5 et fluorure ex. Rem. On rencontre ds la docum. le synon. vx fluorique. Une glace légèrement dépolie à l'acide fluorique (STENDHAL, Hist. peint. Ital., t. 2, 1817, p. 333). — [
]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, suff. -é. 2. Fluorhydrique, adj. Acide fluorhydrique. Acide composé du fluor et de l'hydrogène. On l'emploie, cet acide [fluorhydrique], à la gravure du verre et à la conservation des pierres. Réagissant sur le sable, l'acide fluorhydrique, venu du spath-fluor, donne un gaz, le fluorure de silicium, qui, au contact de l'eau, fournit l'acide hydrofluosilique. Avec une solution d'un sel de ce dernier, un hypofluosilicate (BOURGET, Actes suivent, 1926, p. 25). On traite 1 g environ de poudre de verre bien sèche par l'acide fluorhydrique et chauffe doucement sur le bain de sable. Le fluorure de silicium SiF4 disparaît et il reste les fluorures métalliques (C. DUVAL, Verre, 1966, p. 13). Cf. attaquable ex. 5 et fluorure ex. Rem. On rencontre ds la docum. le synon. vx fluorique. Une glace légèrement dépolie à l'acide fluorique (STENDHAL, Hist. peint. Ital., t. 2, 1817, p. 333). — [ ]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, élém. suff. -hydrique. — Fréq. abs. littér. : 2.
]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, élém. suff. -hydrique. — Fréq. abs. littér. : 2.
 ]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, suff. -é. 2. Fluorhydrique, adj. Acide fluorhydrique. Acide composé du fluor et de l'hydrogène. On l'emploie, cet acide [fluorhydrique], à la gravure du verre et à la conservation des pierres. Réagissant sur le sable, l'acide fluorhydrique, venu du spath-fluor, donne un gaz, le fluorure de silicium, qui, au contact de l'eau, fournit l'acide hydrofluosilique. Avec une solution d'un sel de ce dernier, un hypofluosilicate (BOURGET, Actes suivent, 1926, p. 25). On traite 1 g environ de poudre de verre bien sèche par l'acide fluorhydrique et chauffe doucement sur le bain de sable. Le fluorure de silicium SiF4 disparaît et il reste les fluorures métalliques (C. DUVAL, Verre, 1966, p. 13). Cf. attaquable ex. 5 et fluorure ex. Rem. On rencontre ds la docum. le synon. vx fluorique. Une glace légèrement dépolie à l'acide fluorique (STENDHAL, Hist. peint. Ital., t. 2, 1817, p. 333). — [
]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, suff. -é. 2. Fluorhydrique, adj. Acide fluorhydrique. Acide composé du fluor et de l'hydrogène. On l'emploie, cet acide [fluorhydrique], à la gravure du verre et à la conservation des pierres. Réagissant sur le sable, l'acide fluorhydrique, venu du spath-fluor, donne un gaz, le fluorure de silicium, qui, au contact de l'eau, fournit l'acide hydrofluosilique. Avec une solution d'un sel de ce dernier, un hypofluosilicate (BOURGET, Actes suivent, 1926, p. 25). On traite 1 g environ de poudre de verre bien sèche par l'acide fluorhydrique et chauffe doucement sur le bain de sable. Le fluorure de silicium SiF4 disparaît et il reste les fluorures métalliques (C. DUVAL, Verre, 1966, p. 13). Cf. attaquable ex. 5 et fluorure ex. Rem. On rencontre ds la docum. le synon. vx fluorique. Une glace légèrement dépolie à l'acide fluorique (STENDHAL, Hist. peint. Ital., t. 2, 1817, p. 333). — [ ]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, élém. suff. -hydrique. — Fréq. abs. littér. : 2.
]. — 1re attest. 1838 (Ac. Compl. 1842); de fluor, élém. suff. -hydrique. — Fréq. abs. littér. : 2.BBG. — ERNOUT (A.). Philologica. Paris, 1957, 256 p. — STOROST (J.). Zur Herausbildung der Grundsätze... Beitr. rom. Philol. 1972, t. 11, p. 301 (s.v. fluorique).
fluor [flyɔʀ] adj. et n. m.
ÉTYM. 1723; var. flueur, 1534; lat. fluor « écoulement ».
❖
1 Adj. et n. (Vx). Minéral fusible ou utilisable comme fondant. Spécialt. Cristallisation ressemblant aux pierres précieuses. — Mod. || Spath fluor. ⇒ Fluorine.
2 N. m. (1823; existence signalée en 1812 par Ampère; → cit. 2). Mod. Corps simple (isolé en 1886 par Moissan), métalloïde, premier élément du groupe des halogènes (symb. F; p. at. près de 19; no at. 9), gaz jaune verdâtre très dangereux à respirer, se solidifiant à −219 °C. || Le fluor, oxydant puissant. || Fluor à l'état naturel. ⇒ Apatite, cryolithe, fluorine (ou spath fluor), topaze. || Le fluor et ses composés sont utilisés pour enrichir l'uranium naturel en isotope radioactif. ⇒ Hexafluorure. || Composés minéraux du fluor : acide fluorhydrique, fluorures, fluocarbure, fluosilicates, etc. || Le fluor est le plus électronégatif et le plus réactif de tous les éléments.
1 Le fluor aura-t-il jamais des applications ? Il est bien difficile de répondre à cette question. D'ailleurs, je puis le dire en toute sincérité, je n'y pensais guère au moment où j'ai entrepris ces recherches et je crois que tous les chimistes qui ont tenté ces expériences avant moi n'y pensaient pas davantage. Une recherche scientifique est une recherche de la vérité (…)
2 Il (Ampère) aperçoit avec une lucidité merveilleuse la certitude qu'il existe deux corps simples de propriétés analogues, le Chlore et le Fluor. Ses idées furent facilement admises en ce qui concerne le Chlore, mais pour le Fluor dont l'isolement effectif n'eut lieu que quatre-vingts ans plus tard, elles se heurtèrent à une forte opposition et il fut loin de convaincre tous les chimistes.
L. de Broglie, Continu et Discontinu en physique moderne, p. 250.
❖
DÉR. et COMP. Fluoration, fluoré, fluorer, fluorine, fluorose, fluorure. V. Fluorescence. V. aussi Fluo-.
Encyclopédie Universelle. 2012.