- ГАЗ
-
(франц. gaz, от греч. chaos — хаос), агрегатное состояние в-ва, в к-ром его ч-цы не связаны или весьма слабо связаны силами вз-ствия и движутся свободно, заполняя весь предоставленный им объём. B-вa в газообразном состоянии образуют атмосферу Земли, в значит. кол-вах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного в-ва состоят из Г.— нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях Г. представляют собой, как правило, смеси химически индивидуальных Г.Г. целиком заполняют сосуд, в к-ром находятся, и принимают его форму. В отличие от тв. тел и жидкостей, объём Г. существенно зависит от давления и темп-ры. Коэфф. объёмного расширения Г. в обычных условиях (при 0— 100°С) на два порядка выше, чем у жидкостей, и составляет при 0°C 0,003663 К-1. В таблице приведены данные о физических свойствах нек-рых Г.Любое в-во можно перевести в газообразное состояние надлежащим подбором давления p и темп-ры Т. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных р.— Т (в р-T-диаграмме, рис. 1).ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ГАЗОВ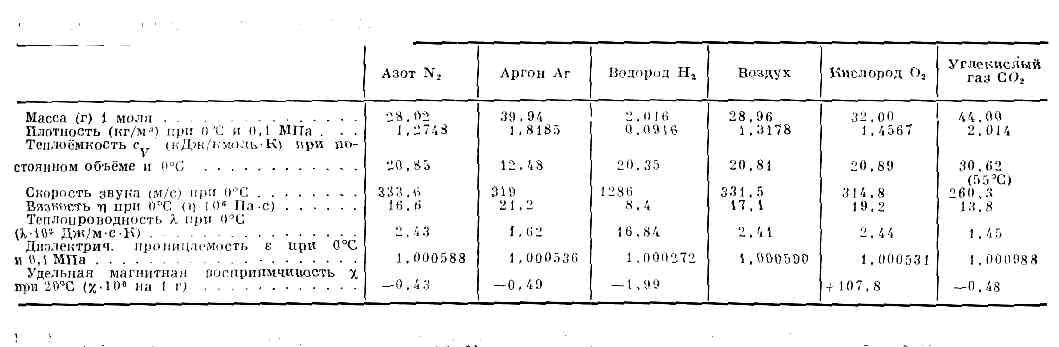 . При Т ниже критической Тк (см. КРИТИЧЕСКОЕ СОСТОЯНИЕ) эта область ограничена кривыми сублимации (возгонки) I и парообразования II. Это означает, что при любом p ниже критического pк существует темп-pa Т, определяемая кривой сублимации или парообразования, выше к-рой в-во становится газообразным. При темп-pax ниже тсмп-ры тройной точки Тр газ может находиться в равновесии с и. фазой в-ва (на кривой I), а между тройной и критич. точкой К — с жидкой фазой.
. При Т ниже критической Тк (см. КРИТИЧЕСКОЕ СОСТОЯНИЕ) эта область ограничена кривыми сублимации (возгонки) I и парообразования II. Это означает, что при любом p ниже критического pк существует темп-pa Т, определяемая кривой сублимации или парообразования, выше к-рой в-во становится газообразным. При темп-pax ниже тсмп-ры тройной точки Тр газ может находиться в равновесии с и. фазой в-ва (на кривой I), а между тройной и критич. точкой К — с жидкой фазой.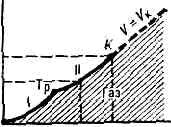 . Рис. 1. p —T-диаграмма состояния в-ва. Со стороны низких Т и р область газообразного состояния ограничена кривыми сублимации (I) и парообразования (II). Тр — тройная точка; К — критич. точка; пунктирная линия — критич. изохора в-вa (объём V=const=Vк).Газ в этих состояниях обычно наз. паром в-ва.При Т ниже Тк можно сконденсировать Г.— перевести его в др. агрегатное состояние (твёрдое или жидкое), напр. повышая давление.При Т>Тк граница газообразной области условна, поскольку при этих Т фазовые превращения не происходят. Иногда за условную границу между Г. и жидкостью при сверхкритич. Т и р принимают критич. изохору в-ва (рис. 1), в непосредств. близости от к-рой св-ва в-ва изменяются, хотя и не скачком, но особенно быстро.В связи с тем что область газового состояния очень обширна, св-ва Г. при изменении Т и р могут меняться в широких пределах. Так, в норм. условиях (при 0°С и атм. давлении) плотность Г. примерна в 1000 раз меньше плотности того же в-ва в твёрдом или жидком состоянии. При комнатной Т и глубоком вакууме (напр., при p=1011 мм рт. ст.) плотность Г. =10-20г/см3. С другой стороны, при высоких р в-во, к-рое при сверхкритич. Т можно считать Г., обладает огромной плотностью (напр., в центре иек-рых звёзд =109 г/см3). В зависимости от условий в широких пределах изменяются и др. св-ва Г.— теплопроводность, вязкость и т. д.Молекулярно-кинетическая теория газов рассматривает Г. как совокупность слабо взаимодействующих ч-ц, находящихся в непрерывном хаотическом (тепловом) движении. На основе этих представлений молекулярно-кинетич. теории удаётся объяснить ми. физ. св-ва Г., особенно полно — св-ва разреж. Г.У достаточно разреж. Г. ср. расстояния между молекулами оказываются значительно больше радиуса действия сил межмол. вз-ствия. Так, при норм. условиях в 1 см3 Г. находится =1019 молекул и ср. расстояние между ними составляет =10 нм, тогда как межмол. вз-ствие несущественно уже на расстояниях св. 0,5—1 нм. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмол. сил. Это сближение принято трактовать как : столкновение молекул. Радиус действия межмол. сил в рассмотренном примере в 10 раз меньше ср. расстояния между молекулами, так что общий объём, в к-ром эти силы могут сказываться (как бы «собств. объём» всех молекул), составляет 10-3 от полного объёма Г. Это позволяет считать собств. объём молекул Г. в норм. условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Г., молекулы к-рого рассматриваются как не взаимодействующие друг с другом материальные точки, наз. и. д е а л ь н ы м. При тепловом равновесии идеального Г. все направления движения его молекул равновероятны, а их скорости v подчиняются распределению Максвелла (рис. 2). Подавляющее большинство молекул имеет значения v, близкие к наиболее вероятной vН при данной Т (соответствует максимуму на рис.: 2), но существует нек-рая часть молекул с малыми и очень большими скоростями. При помощи распределения Максвелла может быть определена т. н. ср. квадратичная скорость молекул Ov2, связанная с Т соотношением:v2=3kT/m, (1)где m — масса молекулы. Ур-ние (1) устанавливает связь между ср. кинетич. энергией одной молекулы и темп-рой газа:mv2/2=3/2kT. (2)Эта зависимость позволяет рассматривать У как меру ср. кинетич. энергии молекул.
. Рис. 1. p —T-диаграмма состояния в-ва. Со стороны низких Т и р область газообразного состояния ограничена кривыми сублимации (I) и парообразования (II). Тр — тройная точка; К — критич. точка; пунктирная линия — критич. изохора в-вa (объём V=const=Vк).Газ в этих состояниях обычно наз. паром в-ва.При Т ниже Тк можно сконденсировать Г.— перевести его в др. агрегатное состояние (твёрдое или жидкое), напр. повышая давление.При Т>Тк граница газообразной области условна, поскольку при этих Т фазовые превращения не происходят. Иногда за условную границу между Г. и жидкостью при сверхкритич. Т и р принимают критич. изохору в-ва (рис. 1), в непосредств. близости от к-рой св-ва в-ва изменяются, хотя и не скачком, но особенно быстро.В связи с тем что область газового состояния очень обширна, св-ва Г. при изменении Т и р могут меняться в широких пределах. Так, в норм. условиях (при 0°С и атм. давлении) плотность Г. примерна в 1000 раз меньше плотности того же в-ва в твёрдом или жидком состоянии. При комнатной Т и глубоком вакууме (напр., при p=1011 мм рт. ст.) плотность Г. =10-20г/см3. С другой стороны, при высоких р в-во, к-рое при сверхкритич. Т можно считать Г., обладает огромной плотностью (напр., в центре иек-рых звёзд =109 г/см3). В зависимости от условий в широких пределах изменяются и др. св-ва Г.— теплопроводность, вязкость и т. д.Молекулярно-кинетическая теория газов рассматривает Г. как совокупность слабо взаимодействующих ч-ц, находящихся в непрерывном хаотическом (тепловом) движении. На основе этих представлений молекулярно-кинетич. теории удаётся объяснить ми. физ. св-ва Г., особенно полно — св-ва разреж. Г.У достаточно разреж. Г. ср. расстояния между молекулами оказываются значительно больше радиуса действия сил межмол. вз-ствия. Так, при норм. условиях в 1 см3 Г. находится =1019 молекул и ср. расстояние между ними составляет =10 нм, тогда как межмол. вз-ствие несущественно уже на расстояниях св. 0,5—1 нм. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмол. сил. Это сближение принято трактовать как : столкновение молекул. Радиус действия межмол. сил в рассмотренном примере в 10 раз меньше ср. расстояния между молекулами, так что общий объём, в к-ром эти силы могут сказываться (как бы «собств. объём» всех молекул), составляет 10-3 от полного объёма Г. Это позволяет считать собств. объём молекул Г. в норм. условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Г., молекулы к-рого рассматриваются как не взаимодействующие друг с другом материальные точки, наз. и. д е а л ь н ы м. При тепловом равновесии идеального Г. все направления движения его молекул равновероятны, а их скорости v подчиняются распределению Максвелла (рис. 2). Подавляющее большинство молекул имеет значения v, близкие к наиболее вероятной vН при данной Т (соответствует максимуму на рис.: 2), но существует нек-рая часть молекул с малыми и очень большими скоростями. При помощи распределения Максвелла может быть определена т. н. ср. квадратичная скорость молекул Ov2, связанная с Т соотношением:v2=3kT/m, (1)где m — масса молекулы. Ур-ние (1) устанавливает связь между ср. кинетич. энергией одной молекулы и темп-рой газа:mv2/2=3/2kT. (2)Эта зависимость позволяет рассматривать У как меру ср. кинетич. энергии молекул.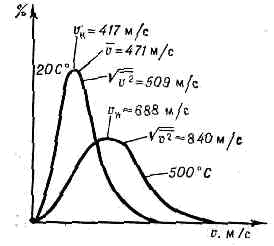 . Рис. 2. Распределение Максвелла для молекул азота при Т— 20 и 500 °С. По оси ординат — доля молекул (в %), обладающих скоростями между v м/с и (v+10) м/с; v — наиб. вероятная скорость, к-рой обладает наибольшее число молекул при данной Т;v — ср. скорость молекул; Ov2 — ср. квадратичная скорость.Поскольку молекулы идеального Г. обладают лишь кинетич. энергией, внутр. энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля). Молекулярно-кинетич. теория рассматривает давление Г. на стенки сосуда, в к-ром он находится, как воздействие ударов молекул, усреднённое по поверхности и времени; количественно р определяется импульсом, передаваемым молекулами в ед. времени ед. площади стенки:p=1/3nmv2, (3)где n — число молекул в единице объёма.Ур-ния (2) и (3) позволяют записать уравнение состояния идеального Г. в виде:p=nkT. (4)Ур-ние (4), записанное для 1 моля Г., наз. Клапейрона уравнением:pVm=RT. (5)Здесь R=kN — универсальная газовая постоянная (N — число молекул в 1 моле), Vm— объём, приходящийся на 1 моль.Ур-ние Клапейрона можно получить и эмпирически, обобщая газовые законы Бойля — Мариотта и Гей-Люссака (см. БОЙЛЯ — МАРИОТТА ЗАКОН, ГЕЙ-ЛЮССАКА ЗАКОНЫ).Из ур-ния (5) следует также, что при одинаковых Т и р идеальные Г., взятые в кол-ве 1 моля, имеют равные объёмы и в ед. объёма любого такого Г. содержится равное число молекул (см. АВОГАДРО ЗАКОН). В условиях теплового равновесия T и p Г. по всему его объёму одинаковы, молекулы движутся хаотично, упорядоченных потоков нет. Возникновение в Г. перепадов (градиентов) Т и р приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физ. величин.Кинетич. св-ва Г.— теплопроводность, диффузию, вязкость — молекулярно-кинетич. теория рассматривает с единой точки зрения: диффузию как перенос молекулами массы, теплопроводность как перенос ими энергии, вязкость как перенос кол-ва движения. Модель идеального Г. для анализа явлений переноса непригодна, ибо в этих процессах существ. роль играют столкновения молекул и их лин. размеры (влияющие на частоту столкновений). Поэтому в простейшем случае явления переноса в Г. рассматриваются для разреж. Г., молекулы к-рого в первом приближении считаются упругими шариками с определ. диаметром s, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении а связан простым соотношением со ср. длиной свободного пробега молекулы l:l=1/ps2n (6)Размер l существенно влияет на процессы переноса в разреж. Г. В частности, если характерный размер объёма, занимаемого Г., больше l, то теплопроводность и вязкость Г. не зависят от р. Наоборот, когда I больше характерного размера, теплопроводность и вязкость Г. с уменьшением р (а значит, и числа столкновений) начинают падать.В более строгой молекулярно-кинетич. теории при анализе явлений переноса в разреж. Г. учитывается вз-ствие молекул при любых расстояниях между ними. Характер вз-ствия определяется т. н. потенциалом вз-ствия (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ). Строгое рассмотрение динамики парных вз-ствий (столкновений) приводит к тому, что в ф-лах для расчёта коэфф. переноса появляются т. н. и н т е г р а л ы столкновений, являющиеся ф-циями только приведённой темп-ры T*=kT/e, к-рая характеризует отношение кинетич. энергии молекул (=kT) к их потенц. энергии (e — глубина потенц. ямы при данном потенциале вз-ствия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетич. энергии, а значит, и темп-ры Г. могут сближаться на разл. расстояния, т. е. как бы изменять свой эфф. размер.Свойства реальных газов. При повышении плотности изменяются св-ва Г.— они перестают быть идеальными. Ур-ние состояния (5) оказывается неприменимым, т. к. ср. расстояния между молекулами Г. становятся сравнимыми с радиусом межмол. вз-ствия. Для описания термодинамич. св-в реальных Г. используются разл. ур-ния состояния, б. или м. строго теоретически обоснованные. Простейшим примером ур-ния, к-рое качественно правильно описывает осн. отличия реального Г. от идеального, служит Ван-дер-Ваальса уравнение, учитывающее, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г.К наиболее теоретически обоснованным (во всяком случае, для состояний, удалённых от критич. точки) относится вириальное ур-ние состояния:pV=RT(1+B/V+C/V2+...). (7)Значения вириальных коэфф. В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэфф. Существенно, что вириальные коэфф. явл. ф-циями только Т. В Г. малой плотности наиб. вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэфф. В. В соответствии с температурным изменением В, при т. н. темп-ре Бойля ТB (см. БОЙЛЯ ТОЧКА). В обращается в нуль и умеренно плотный Г. ведёт себя, как идеальный, т. е. подчиняется ур-нию (5). Существование межмол. вз-ствия в той или иной степени сказывается на всех св-вах реальных Г. Внутр. энергия реального Г. оказывается зависящей от V (от расстояний между молекулами), т. к. потенц. энергия молекул определяется их взаимным расположением.С межмол. вз-ствием связано также изменение темп-ры реального Г. при протекании его с малой пост. скоростью через пористую перегородку (этот процесс наз. дросселированием). Мерой изменения темп-ры Г. при дросселировании служит коэфф. Джоуля — Томсона, к-рый в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. темп-ре инверсии (см. ДЖОУЛЯ — ТОМСОНА ЭФФЕКТ).Внутр. строение молекул Г. слабо влияет на их термич. св-ва — давление, темп-ру, плотность и связь между этими величинами. Для этих св-в в первом приближении существенна только мол. масса. Напротив, калорич. св-ва Г. (теплоёмкость, энтропия и др.), а также его электрич. и магн. св-ва существенно зависят от внутр. строения молекул. Напр., для расчёта (в первом приближении) теплоёмкости Г. при пост. объёме сV необходимо знать число внутр. степеней свободы iвн молекулы. В соответствии с равнораспределения законом на каждую внутр. степень свободы молекулы приходится энергия, равная 1/2 kT. Отсюда теплоёмкость 1 моля Г. равна:
. Рис. 2. Распределение Максвелла для молекул азота при Т— 20 и 500 °С. По оси ординат — доля молекул (в %), обладающих скоростями между v м/с и (v+10) м/с; v — наиб. вероятная скорость, к-рой обладает наибольшее число молекул при данной Т;v — ср. скорость молекул; Ov2 — ср. квадратичная скорость.Поскольку молекулы идеального Г. обладают лишь кинетич. энергией, внутр. энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля). Молекулярно-кинетич. теория рассматривает давление Г. на стенки сосуда, в к-ром он находится, как воздействие ударов молекул, усреднённое по поверхности и времени; количественно р определяется импульсом, передаваемым молекулами в ед. времени ед. площади стенки:p=1/3nmv2, (3)где n — число молекул в единице объёма.Ур-ния (2) и (3) позволяют записать уравнение состояния идеального Г. в виде:p=nkT. (4)Ур-ние (4), записанное для 1 моля Г., наз. Клапейрона уравнением:pVm=RT. (5)Здесь R=kN — универсальная газовая постоянная (N — число молекул в 1 моле), Vm— объём, приходящийся на 1 моль.Ур-ние Клапейрона можно получить и эмпирически, обобщая газовые законы Бойля — Мариотта и Гей-Люссака (см. БОЙЛЯ — МАРИОТТА ЗАКОН, ГЕЙ-ЛЮССАКА ЗАКОНЫ).Из ур-ния (5) следует также, что при одинаковых Т и р идеальные Г., взятые в кол-ве 1 моля, имеют равные объёмы и в ед. объёма любого такого Г. содержится равное число молекул (см. АВОГАДРО ЗАКОН). В условиях теплового равновесия T и p Г. по всему его объёму одинаковы, молекулы движутся хаотично, упорядоченных потоков нет. Возникновение в Г. перепадов (градиентов) Т и р приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физ. величин.Кинетич. св-ва Г.— теплопроводность, диффузию, вязкость — молекулярно-кинетич. теория рассматривает с единой точки зрения: диффузию как перенос молекулами массы, теплопроводность как перенос ими энергии, вязкость как перенос кол-ва движения. Модель идеального Г. для анализа явлений переноса непригодна, ибо в этих процессах существ. роль играют столкновения молекул и их лин. размеры (влияющие на частоту столкновений). Поэтому в простейшем случае явления переноса в Г. рассматриваются для разреж. Г., молекулы к-рого в первом приближении считаются упругими шариками с определ. диаметром s, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении а связан простым соотношением со ср. длиной свободного пробега молекулы l:l=1/ps2n (6)Размер l существенно влияет на процессы переноса в разреж. Г. В частности, если характерный размер объёма, занимаемого Г., больше l, то теплопроводность и вязкость Г. не зависят от р. Наоборот, когда I больше характерного размера, теплопроводность и вязкость Г. с уменьшением р (а значит, и числа столкновений) начинают падать.В более строгой молекулярно-кинетич. теории при анализе явлений переноса в разреж. Г. учитывается вз-ствие молекул при любых расстояниях между ними. Характер вз-ствия определяется т. н. потенциалом вз-ствия (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ). Строгое рассмотрение динамики парных вз-ствий (столкновений) приводит к тому, что в ф-лах для расчёта коэфф. переноса появляются т. н. и н т е г р а л ы столкновений, являющиеся ф-циями только приведённой темп-ры T*=kT/e, к-рая характеризует отношение кинетич. энергии молекул (=kT) к их потенц. энергии (e — глубина потенц. ямы при данном потенциале вз-ствия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетич. энергии, а значит, и темп-ры Г. могут сближаться на разл. расстояния, т. е. как бы изменять свой эфф. размер.Свойства реальных газов. При повышении плотности изменяются св-ва Г.— они перестают быть идеальными. Ур-ние состояния (5) оказывается неприменимым, т. к. ср. расстояния между молекулами Г. становятся сравнимыми с радиусом межмол. вз-ствия. Для описания термодинамич. св-в реальных Г. используются разл. ур-ния состояния, б. или м. строго теоретически обоснованные. Простейшим примером ур-ния, к-рое качественно правильно описывает осн. отличия реального Г. от идеального, служит Ван-дер-Ваальса уравнение, учитывающее, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г.К наиболее теоретически обоснованным (во всяком случае, для состояний, удалённых от критич. точки) относится вириальное ур-ние состояния:pV=RT(1+B/V+C/V2+...). (7)Значения вириальных коэфф. В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэфф. Существенно, что вириальные коэфф. явл. ф-циями только Т. В Г. малой плотности наиб. вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэфф. В. В соответствии с температурным изменением В, при т. н. темп-ре Бойля ТB (см. БОЙЛЯ ТОЧКА). В обращается в нуль и умеренно плотный Г. ведёт себя, как идеальный, т. е. подчиняется ур-нию (5). Существование межмол. вз-ствия в той или иной степени сказывается на всех св-вах реальных Г. Внутр. энергия реального Г. оказывается зависящей от V (от расстояний между молекулами), т. к. потенц. энергия молекул определяется их взаимным расположением.С межмол. вз-ствием связано также изменение темп-ры реального Г. при протекании его с малой пост. скоростью через пористую перегородку (этот процесс наз. дросселированием). Мерой изменения темп-ры Г. при дросселировании служит коэфф. Джоуля — Томсона, к-рый в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. темп-ре инверсии (см. ДЖОУЛЯ — ТОМСОНА ЭФФЕКТ).Внутр. строение молекул Г. слабо влияет на их термич. св-ва — давление, темп-ру, плотность и связь между этими величинами. Для этих св-в в первом приближении существенна только мол. масса. Напротив, калорич. св-ва Г. (теплоёмкость, энтропия и др.), а также его электрич. и магн. св-ва существенно зависят от внутр. строения молекул. Напр., для расчёта (в первом приближении) теплоёмкости Г. при пост. объёме сV необходимо знать число внутр. степеней свободы iвн молекулы. В соответствии с равнораспределения законом на каждую внутр. степень свободы молекулы приходится энергия, равная 1/2 kT. Отсюда теплоёмкость 1 моля Г. равна: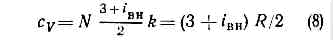 . (здесь число 3 — число степеней свободы молекулы как целого).Для точного расчёта калорич. св-в Г. необходимо знать уровни энергии молекулы, сведения о к-рых в большинстве случаев получают методами спектроскопии. Для большого числа в-в в состоянии идеального Г. калорич. параметры вычислены с высокой точностью, и их значения представлены в виде таблиц до Т = 10—22 тыс. К.Электрич. св-ва Г. связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Г. электрически заряж. ч-ц (ионов и эл-нов). При отсутствии заряж. ч-ц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается.При Т большей неск. тыс. К всякий Г. частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то св-ва её мало отличаются от св-в обычного Г.По магн. св-вам Г. делятся на диамагнитные (к ним относятся, напр., инертные газы, а также H2N2, СO2, Н2О) и парамагнитные (напр., O2). Диамагнитны те Г., молекулы к-рых не имеют пост. магн. момента и приобретают его лишь под влиянием внеш. поля (см. ДИАМАГНЕТИЗМ). Те же Г., у к-рых молекулы обладают пост. магн. моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. ПАРАМАГНЕТИЗМ).Учёт межмол. вз-ствия и внутр. строения молекул необходим при решении мн. проблем физики Г., напр. при исследовании влияния верхних разреж. слоев атмосферы на движение ракет и спутников (см. ГАЗОВАЯ ДИНАМИКА).В совр. физике Г. называют не только одно из агрегатных состояний в-ва. К Г. с особыми св-вами относят, напр., совокупность свободных эл-нов в металле (электронный Г.), фононов в кристаллах или жидком гелии (фононный Г.). Св-ва Г. элем. ч-ц и квазичастиц рассматривает квантовая статистика.
. (здесь число 3 — число степеней свободы молекулы как целого).Для точного расчёта калорич. св-в Г. необходимо знать уровни энергии молекулы, сведения о к-рых в большинстве случаев получают методами спектроскопии. Для большого числа в-в в состоянии идеального Г. калорич. параметры вычислены с высокой точностью, и их значения представлены в виде таблиц до Т = 10—22 тыс. К.Электрич. св-ва Г. связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Г. электрически заряж. ч-ц (ионов и эл-нов). При отсутствии заряж. ч-ц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается.При Т большей неск. тыс. К всякий Г. частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то св-ва её мало отличаются от св-в обычного Г.По магн. св-вам Г. делятся на диамагнитные (к ним относятся, напр., инертные газы, а также H2N2, СO2, Н2О) и парамагнитные (напр., O2). Диамагнитны те Г., молекулы к-рых не имеют пост. магн. момента и приобретают его лишь под влиянием внеш. поля (см. ДИАМАГНЕТИЗМ). Те же Г., у к-рых молекулы обладают пост. магн. моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. ПАРАМАГНЕТИЗМ).Учёт межмол. вз-ствия и внутр. строения молекул необходим при решении мн. проблем физики Г., напр. при исследовании влияния верхних разреж. слоев атмосферы на движение ракет и спутников (см. ГАЗОВАЯ ДИНАМИКА).В совр. физике Г. называют не только одно из агрегатных состояний в-ва. К Г. с особыми св-вами относят, напр., совокупность свободных эл-нов в металле (электронный Г.), фононов в кристаллах или жидком гелии (фононный Г.). Св-ва Г. элем. ч-ц и квазичастиц рассматривает квантовая статистика.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
.