ARSENIC
L’arsenic est l’élément chimique de symbole As et de numéro atomique 33. Bien qu’il soit très répandu dans le règne minéral et dans les organismes vivants, une quarantaine d’éléments sur quatre-vingt-douze sont plus abondants que lui; il ne représente qu’environ cinq millionièmes en masse de la croûte terrestre. Son importance vient de son rôle physiologique; c’est un constituant systématique de la cellule vivante, où il sert de biocatalyseur. De nombreux composés de l’arsenic sont fortement toxiques, les composés minéraux l’étant plus que les composés organiques. Néanmoins, la pharmacologie utilise de nombreux produits arsenicaux.
L’arsenic natif est rare; à l’état naturel il existe principalement sous forme de minéraux sulfurés: le réalgar As4S4, l’orpiment As4S6 et surtout le mispickel dont la composition répond sensiblement à la formule FeAsS alors qu’il s’agit en réalité d’un mélange d’arséniure de fer FeAs2 et de pyrite FeS2 de mêmes structures cristallines; la pyrite arsenicale FeAs2 existe également dans la nature; à ces sulfures s’ajoutent deux oxydes, l’arsénolite et la claudétite, et de nombreux arséniates métalliques. La sublimation facile de l’arsenic élémentaire facilite sa préparation.
La belle couleur jaune d’or de l’orpiment avait attiré l’attention des Anciens: Aristote le connaissait et Pline l’appela auri pigmentum . Les alchimistes savaient griller les sulfures pour préparer l’«arsenic blanc» ou anhydride arsénieux, et il semble que l’arsenic élémentaire ait été isolé dès le XIIIe siècle, mais cela reste incertain jusqu’au XVIIIe siècle. L’importance de l’arsenic est considérable pour les alchimistes à cause de ses relations avec le roi des métaux: l’or; en plus de la couleur du sulfure, on savait, en effet, que l’arsenic ajouté à du cuivre donne un métal blanc qu’on assimilait à l’argent; un pas était donc franchi d’un métal vil vers un métal noble; il ne restait plus alors qu’à «transmuter» l’argent en or.
1. Propriétés
Au sein de la classification périodique des éléments, l’arsenic se situe au milieu de la cinquième colonne: il succède à l’azote et au phosphore typiquement non métalliques dont les degrés d’oxydation fondamentaux sont 漣 III, + III et + V; il précède l’antimoine et le bismuth chez lesquels le caractère métallique s’accentue avec prépondérance presque exclusive du degré d’oxydation + III. L’arsenic est un élément intermédiaire qui se rattache tantôt à un groupe, tantôt à l’autre. Comme l’azote et le phosphore, l’arsenic possède un hydrure AsH3, assez stable, qui est à l’origine d’une importante famille de dérivés organiques. Le phosphore et l’arsenic ont des électronégativités très voisines. Pour ces deux éléments, les composés oxygénés pentavalents sont les plus stables. L’arsenic se rapproche de l’antimoine et du bismuth par sa structure cristalline et par le fait que la variété stable conduit la chaleur et l’électricité. Son caractère métallique apparaît aussi dans les arséniures métalliques, qui ont souvent les propriétés d’un alliage.
Cortège électronique, modes de liaison
Le cortège électronique de l’arsenic se compose de deux électrons K, huit électrons L et dix-huit électrons M, qui constituent le cœur chimiquement inerte de l’atome. La couche de valence possède cinq électrons, répartis en un doublet 4s et trois électrons non appariés, chacun sur une orbitale 4p (cf. tableau).
Ce cortège électronique offre plusieurs possibilités théoriques de liaison avec d’autres atomes, ce qui implique des propriétés structurales différentes. Il faut remarquer que, même dans les arséniures alcalins comme Na3As, l’ion As3- n’existe pas, ce qui fait ressortir le caractère métallique de l’arsenic. La structure des composés tricoordonnés de l’arsenic peut s’expliquer de deux façons. On peut imaginer une hybridation faisant intervenir l’orbitale s et les trois orbitales p ; l’atome possède alors quatre orbitales équivalentes notées sp 3 et qui pointent vers les quatre sommets d’un tétraèdre centré sur l’atome d’arsenic; trois de ces orbitales sont occupées par un doublet de liaison et la quatrième possède une paire électronique non liante. Un autre schéma peut être proposé dans lequel les électrons 4s n’interviennent pas et constituent une paire inerte, la liaison étant assurée par les trois orbitales p pures, non hybridées et dont les directions font entre elles des angles de 900. De nombreux faits expérimentaux montrent que la première hypothèse correspond davantage à la réalité dans presque tous les composés de l’arsenic. Il semble que seuls les anions exceptionnels (AsCl4)- ou (AsBr4)- possèdent une paire inerte. La structure tétraédrale est certaine dans le cas de la molécule As4, des oxydes et des sulfures d’arsenic.
Dans les composés pentavalents, un autre mode de liaison, qui fait intervenir les orbitales d vacantes, a pu être mis en évidence. La structure est alors trigonale, bipyramidale comme dans As5, qui possède trois atomes de fluor aux sommets d’un triangle équilatéral dont le centre est occupé par l’atome d’arsenic, les deux atomes de fluor restants se trouvant de part et d’autre du plan déterminé par les autres atomes. L’intervention des orbitales d justifie également la structure octaédrique de l’arsenihexafluorure de potassium K (AsF6).
Variétés allotropiques
L’arsenic présente trois variétés allotropiques cristallines; deux sont bien définies, la troisième n’est pas caractérisée avec certitude. Par refroidissement brutal (trempe) de la vapeur, on obtient la variété 見 ou arsenic jaune, semblable au phosphore blanc; les molécules As4 qui la composent ont la géométrie d’un trétraèdre régulier. L’arsenic 見 est soluble dans le sulfure de carbone, la solution étant constituée également de molécules As4. Cette variété est toujours métastable et se transforme en arsenic gris ou 塚 sous l’action du brome et de l’iode, ou lorsqu’on l’expose à la lumière, même à la température de l’air liquide. L’arsenic gris est stable et insoluble dans le sulfure de carbone; sa structure est semblable à celle de l’antimoine et du bismuth; elle est constituée de feuillets où chaque atome possède trois plus proches voisins situés dans le même feuillet à 0,251 nm et trois voisins plus éloignés dans le feuillet suivant à 0,315 nm. Par sublimation d’arsenic gris dans un courant d’hydrogène, on obtient l’arsenic noir mal défini, insoluble dans le sulfure de carbone et qui redonne l’arsenic 塚 dès 350 0C.
Les molécules As4 sont stables en phase vapeur jusqu’à 800 0C; au-delà, elles se dissocient en molécules As2, puis en atomes à partir de 1 700 0C. Le passage à l’état gazeux se fait par sublimation; l’arsenic liquide n’a pu être obtenu que sous pression.
La réactivité chimique de l’arsenic varie beaucoup selon son état cristallin; l’arsenic 見 s’oxyde à l’air dès la température ambiante, comme le phosphore blanc, alors que la variété noire résiste jusque vers 80 0C et que l’arsenic gris doit être chauffé à 250 0C pour réagir avec l’oxygène. Cette dernière variété est celle que l’on considère dans l’exposé des propriétés chimiques de l’élément.
L’arsenic s’enflamme spontanément dans le fluor, le chlore et le brome avec formation de trihalogénures; le triiodure se forme à chaud. Le carbone, l’azote et l’hydrogène ne donnent pas de réaction directe, et les acides non oxydants n’agissent pas. L’acide nitrique, selon sa concentration, conduit à des solutions d’arsenic tri- ou pentavalent, et les bases alcalines fondues provoquent la formation d’arsénites avec dégagement d’hydrogène.
2. Composés
Composés oxygénés
La combustion de l’arsenic, le grillage des pyrites arsenicales dans un courant d’air donnent d’abondantes fumées blanches qui étaient déjà connues au Moyen Âge. Ces fumées sont constituées d’oxyde d’arsenic trivalent et, par condensation à la température ambiante, on recueille une masse vitreuse opaque de densité 3,7 communément appelée «arsenic blanc» ou même simplement «arsenic». Ce produit cristallise spontanément avec le temps dans le système cubique; la densité s’élève alors à 3,87. Cette variété cristalline peut être recueillie sous forme d’octaèdres à partir d’une solution chlorhydrique d’anhydride arsénieux; elle existe dans la nature sous forme d’arsénolite (fleur d’arsenic); chaque groupe As46 occupe dans le cristal les positions des atomes de carbone dans une structure de type diamant. Cette variété est toujours métastable aux températures supérieures à 漣 13 0C. Elle se transforme réversiblement en variété monoclinique, stable aux températures plus élevées. La structure stable à chaud possède un système cristallin moins symétrique; elle est feuilletée, identique à celle de la claudétite naturelle, et sa densité est de 4,15. En phase vapeur, la formule est As46 jusque vers 800 0C; au-delà, la dissociation commence et, à 1 800 0C, il n’existe plus que des molécules As23. En solution, des mesures d’ébulliométrie confirment la formule As46, et, par diffraction électronique, on a pu montrer que chaque groupe a une structure voisine de celle de As4, chaque liaison As 漣 As étant simplement transformée en liaison As 漣 O 漣 As. Cet oxyde est peu soluble dans l’eau. L’acide arsénieux n’a pas pu être isolé et son existence en solution reste hypothétique. L’existence de nombreux métaarsénites MAs2 laisse penser qu’il s’agit de l’acide correspondant HAs2 ou AsO(OH), mais en présence d’ions Ag+ une solution arsénieuse laisse précipiter l’orthoarsénite triargentique Ag3As3: il pourrait donc s’agir de l’acide As(OH)3 ou H3As3. Enfin, des mesures physiques effectuées sur les solutions tendent à prouver l’existence d’ions [As (OH)6]3-: l’exposé des propriétés de cet acide est indépendant de sa structure réelle qu’on peut supposer être, pour simplifier, H3As3. L’acide arsénieux est très faible et la première constante d’ionisation a été évaluée à 5 . 10-10. En réalité, les solutions arsénieuses sont amphotères:

La combinaison de ces deux formes de dissociation permet d’écrire une relation entre les différentes formes ioniques:

L’influence du pH est donc considérable sur cet équilibre et les sels d’arsenic ne peuvent exister qu’en milieu très acide. Les solutions d’anhydride arsénieux traitées par l’acide sulfurique laissent déposer le sulfate d’arsényle (AsO)2S4, qui représente un degré d’hydrolyse intermédiaire entre les deux cas extrêmes exposés ci-dessus. Le sulfate d’arsenic As2(SO4)3 peut être préparé par action de l’anhydride sulfurique à 100 0C. L’acétate As(CH3COO)3 est connu; à l’air humide, il s’hydrolyse totalement en acide acétique et oxyde d’arsenic.
Les arsénites alcalins sont très solubles, ceux des métaux alcalino-terreux le sont moins, ceux des métaux lourds ne le sont pas. Les arsénites à l’état dissous présentent la propriété d’être adsorbés par les gels d’hydroxydes métalliques, ce qui justifie l’ingestion d’hydroxyde de fer comme antidote en cas d’intoxication.
Les solutions arsénieuses sont à la fois faciles à réduire et à oxyder; les sels stanneux précipitent l’arsenic élémentaire, et un sel ferrique ou une solution d’iode suffit pour faire passer l’arsenic à l’état pentavalent. Les solutions d’anhydride arsénieux traitées par l’ozone ou l’eau oxygénée laissent déposer après évaporation des cristaux d’acide arsénique (H3As4, 1/2H2O). L’anhydride arsénique, contrairement à l’anhydride phosphorique, est difficile à obtenir autrement qu’en déshydratant l’acide, à température inférieure à 200 0C pour éviter les pertes d’oxygène.
L’acide arsénique est un triacide dont les constantes de dissociation sont respectivement k 1 = 5,6 . 10-3; k 2 = 1,7 . 10-7; k 3 = 3,0 . 10-12. Les arséniates sont proches des phosphates par des solubilités semblables et de nombreuses relations d’isomorphie. En présence d’un mélange de chlorures de magnésium et d’ammonium, les solutions d’arsenic (+ V) laissent déposer l’arséniate ammoniaco-magnésien, semblable au phosphate homologue MgNH4As4, 7H2O, qui, après calcination, se transforme en pyroarséniate Mg2As27 utilisé en gravimétrie.
Il existe un oxyde mixte As24 qui doit être regardé comme un arséniate arsénieux et qu’il faudrait écrire AsIII (AsV4).
Sulfures
Les sulfures As4S3, As4S4, As4S6 et As4S10 peuvent être préparés par voie sèche à partir des éléments en proportions convenables. Par action de l’hydrogène sulfuré sur des solutions contenant de l’arsenic tri- ou pentaoxydé, on obtient facilement As46, beaucoup plus difficilement As410, car les solutions d’arséniates sont rapidement réduites en arsénite par l’hydrogène sulfuré. Le sulfure trivalent se dissout dans les solutions de polysulfure d’ammonium en se transformant en thioarsénite et dans les bases en donnant un mélange d’arsénite et de thioarsénite:

Ce sulfure traité par le carbonate de sodium se transforme en réalgar, As4S4 qui est un sulfure mixte. Le pentasulfure est peu stable: dès 100 0C, il perd du soufre et se transforme en sulfure arsénieux.
Composés halogénés
Les quatre trihalogénures sont connus; on peut les préparer par halogénation directe. L’hydrolyse est rapide et totale pour le fluorure et le chlorure, moins rapide pour le bromure et lente dans le cas de l’iodure. Il faut remarquer qu’au cours de l’hydrolyse les oxyhalogénures, stables dans le cas du phosphore, n’apparaissent pas; aucun n’a pu être préparé. Un seul pentahalogénure, le fluorure, a été caractérisé avec certitude.
Hydrures et dérivés organiques
L’action du zinc en milieu sulfurique dilué transforme un composé quelconque de l’arsenic en hydrogène arsénié ou arsine de formule As H3; cette propriété est utilisée en chimie analytique (cf. chap. 4). Ce gaz (température de fusion 漣 116,3 0C, température d’ébullition 漣 62,4 0C) peut aussi être obtenu par hydrolyse des arséniures de sodium ou d’aluminium, faciles à préparer par fusion des deux constituants en proportion convenable. Par synthèse directe, on n’a pas pu jusqu’à présent préparer l’arsine, dont la chaleur de formation à partir de l’arsenic et de l’hydrogène est positive, comme celle de l’hydrure d’antimoine. L’ammoniac et les phosphures sont au contraire des composés à formation exothermique. L’arsine est décomposée par la chaleur dès 250 0C, c’est un agent réducteur qui précipite l’argent métallique des solutions de nitrate, brûle dans l’air et peut être oxydé au degré V par les solutions d’iode. L’arsine ne possède pas comme l’ammoniac de fonction basique, et les sels d’arsinium non substitués sont inconnus. Ce composé est fortement toxique; très pur, il est presque inodore, mais, en général, il possède une odeur alliacée puissante, ce qui facilite sa détection.
Par substitution de radicaux aliphatiques ou aromatiques aux atomes d’hydrogène de l’arsine, puis, par halogénation ou oxydation, plusieurs milliers de composés arsenicaux organiques ont été préparés. Ils représentent la plus importante famille de composés organométalliques. Cela est dû à l’intérêt médical de ces produits et à l’importance de la recherche pharmacologique à travers le monde. Historiquement, c’est en 1760 que Cadet de Gassicourt, distillant un mélange d’anhydride arsénieux et d’acétate de potassium sec, recueillit l’«huile fumante de Cadet», essentiellement constituée d’oxyde de cacodyle:
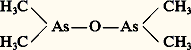
Ces composés arsenicaux organiques se répartissent en deux groupes selon que la molécule contient ou non deux atomes d’arsenic unis par une simple ou une double liaison. Les composés qui ne comportent pas de liaison As 漣As ou As=As se divisent en plusieurs familles. Les arsines primaires, secondaires ou tertiaires, aliphatiques ou aromatiques, sont semblables aux amines dérivées de l’ammoniac; il faut leur rattacher les sels d’arsinium quaternaires substitués. Les composés oxygénés ont des formules variées qui contiennent un ou deux atomes d’arsenic tri- ou penta-coordonnés; les formules types peuvent s’écrire: RAs 略O, (R)2As 漣O 漣As(R)2, (R)3 漣As 略O; on peut rattacher à ce groupe les acides arsoniques RAsO(OH)2 et les acides arsiniques (R)2 略 AsO(OH). Les composés halogénés répondent aux formules type RAsX2, R2AsX, RAsX4, R2AsX3, R3AsX2.
Dans le cas de simple liaison entre deux atomes d’arsenic, les composés sont semblables aux hydrazines substituées et aux azoïques lorsqu’il s’agit de double liaison; cette dernière famille, celle des arsénoïques, a connu un développement considérable qui est dû à l’intérêt thérapeutique que présentent les dérivés de l’arsénobenzène C6H5 漣As 略As 漣C6H5.
Les arsines aliphatiques primaires sont très facilement oxydables et s’enflamment spontanément à l’air; cette propriété s’atténue chez les arsines plus substituées. Contrairement à l’hydrogène arsénié, des arsines ont une fonction basique faible en solution. La monométhylarsine, liquéfiée à + 2 0C, peut être oxydée par l’oxygène sec en CH3As 略O, hydrolysable en acide méthylarsonique. L’iode transforme la monométhylarsine en diiodure CH3AsI2, composé stable, qui résiste plusieurs heures à une température de 300 0C. Les arsines aromatiques ont une stabilité thermique exceptionnelle (la triphénylarsine distille à 360 0C sans décomposition), mais elles s’oxydent très facilement et il faut les conserver dans une atmosphère d’azote.
Les sels d’arsinium quaternaires sont obtenus par une méthode dérivée de celle de Hoffman pour les amines, en traitant la triarsine par l’iodure d’alcoyle correspondant. L’halogène peut être éliminé par action de l’oxyde d’argent humide; il reste alors une base, blanche, déliquescente, se carbonatant très rapidement et aux propriétés voisines de celles des bases alcalines; certains de leur sels sont très insolubles, en particulier [(C6H5)4As] (ReO4), qui sert de façon usuelle au dosage gravimétrique du rhénium.
Les acides arsoniques sont des diacides assez forts; leurs constantes d’acidité sont de l’ordre de 10-4 et 10-9. Les liaisons entre un noyau aromatique et l’atome d’arsenic sont solides et l’acide phénylarsonique peut être traité par les acides nitrique ou sulfurique concentrés et chauds sans que cette liaison soit affectée. Les acides arsiniques sont très faibles et leurs constantes de dissociation ne dépassent pas 10-7 et 10-13; ce sont les composés les moins toxiques de l’arsenic. Parmi les diarsines, le cacodyle est particulièrement célèbre; il fut préparé par Bunsen dès 1842; il s’enflamme spontanément à l’air, mais est thermiquement stable jusque vers 400 0C. Un composé curieux, qui a reçu le nom d’arsénométhane, a été isolé en réduisant le méthylarsonate de sodium par l’acide hypophosphoreux; il s’agit d’un produit huileux jaunâtre cristallisant au-dessous de 12 0C; sa formule brute peut s’écrire (CH3As)n . Les mesures de cryoscopie ou d’ébullioscopie donnent à n la valeur 5; la densité de vapeur correspond à n = 5 vers 200 0C et à n = 3 vers 270 0C. Sa structure est inconnue.
3. Intérêt biologique de l’arsenic et de ses composés
Le trioxyde est extrêmement toxique, la dose létale étant de l’ordre de 0,1 gramme. De très nombreux autres composés arsenicaux, triou pentavalents, peuvent être absorbés par l’organisme soit au niveau de la peau, soit par la paroi intestinale. L’excrétion est toujours lente et se fait presque uniquement par la voie urinaire. En cas d’absorption prolongée de produits arsenicaux, par intoxication progressive, il y a fixation par les ongles et les cheveux qui sont, pour cette raison, systématiquement analysés en toxicologie.
Plusieurs composés arsenicaux sont utilisés en thérapeutique; leur toxicité, même à faible dose, n’étant pas négligeable, on prévoit généralement des périodes de traitement entrecoupées de périodes de repos.
La liqueur de Fowler, constituée par une solution d’arsénite de potassium, titre environ 1 p. 100 en anhydride arsénieux; on l’utilise comme stimulant de la nutrition. L’anhydride arsénieux améliore le souffle en altitude et les chasseurs de chamois tyroliens ont la réputation d’en consommer régulièrement. Plusieurs dérivés arsenicaux aromatiques sont des antiparasitaires importants, actifs vis-à-vis des tripanosomes et des spirilles. Ces composés jouent un rôle dans la prophylaxie et le traitement de la maladie du sommeil. De nombreux composés voisins sont proposés, parmi lesquels le paraaminophénylarsinate monosodique ou Tripoxyl (formule 1) et le N-phénylglycinamide-p -arsinate de sodium (formule 2). L’acétarsone (formule 3) a été employé dans le traitement de l’amibiase et dans celui de la syphilis. Associé à la quinine, l’acétarsone a été préconisé dans le traitement du paludisme.
Les arsénoïques sont les premiers composés auxquels on a reconnu une action antisyphilitique et, par la suite, on en a utilisé de très nombreux. Historiquement, le premier dont on découvrit les vertus fut l’arsénobenzol (Salvarsan, formule 4). On utilisa ensuite le novarsénobenzol, dans lequel l’un des groupes NH2 est remplacé par 漣NH 漣CH2Na. Ces composés sont également de bons antiparasitaires; leur importance est bien moindre depuis la découverte des antibiotiques.
4. Chimie analytique
La recherche qualitative de l’arsenic et son dosage revêtent un aspect particulier du fait de leur importance en toxicologie et en pharmacologie, où des résultats fidèles et précis sont exigés. Au laboratoire, l’arsenic peut être isolé à l’état de sulfure arsénieux jaune, précipité en milieu acide par un courant d’hydrogène sulfuré. Le dosage des solutions arsénieuses se fait à l’aide d’une solution d’iode, titrée en présence d’un excès de bicarbonate de sodium qui élimine l’acide iodhydrique au moment même de sa formation, ce qui déplace l’équilibre et rend la réaction quantitative:
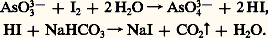
Plusieurs méthodes ont été proposées pour caractériser l’arsenic sans risque d’erreur, la confusion avec l’antimoine étant la plus fréquente. Le test de Reinsch consiste à plonger une lame de cuivre dans une solution chlorhydrique à étudier; l’arsenic s’y dépose sous forme d’arséniure Cu5As2. Le composé le plus facile à utiliser est l’hydrogène arsénié préparé par attaque de l’échantillon à analyser par du zinc et de l’acide sulfurique spécialement purifiés pour en éliminer l’arsenic; dans ces conditions, l’attaque se fait mal et doit être provoquée en ajoutant une goutte de solution de sulfate de cuivre également exempt d’arsenic. L’arsine est entraînée par le courant d’hydrogène qui se dégage; un tampon de laine de verre, placé sur le circuit gazeux, intercepte les particules solides et les gouttelettes liquides qui auraient pu être entraînées. Cette méthode, dite de Marsh, est universellement utilisée en toxicologie. Le courant d’hydrogène, éventuellement porteur de produits arséniés, traverse un tube de silice fortement chauffé en un point; l’arsine s’y décompose et l’arsenic se condense dans la partie froide du tube où un miroir se forme. L’antimoine réagit de la même manière, mais n’est pas soluble à froid dans une solution d’hypochlorite de sodium, ce qui permet la distinction avec l’arsenic. On peut comparer l’anneau d’arsenic formé avec une série d’anneaux étalons obtenus avec des échantillons contenant des quantités connues d’arsenic.
Des méthodes de dosages conductimétriques de haute précision, à l’aide d’une solution très diluée d’iode, font espérer une précision de 1 p. 100 dans le cas d’une masse d’arsenic qui peut être inférieure à 1 microgramme. Frédéric Joliot-Curie, nommé expert dans une affaire d’empoisonnement criminel, a mis au point une méthode d’irradiation des échantillons qui provoque la formation d’isotopes radioactifs de l’arsenic; en suivant à l’aide d’un compteur Geiger la désintégration de ces isotopes, la recherche des traces d’arsenic peut atteindre une précision bien supérieure.
5. Préparation et applications
L’arsenic blanc est un sous-produit de la calcination des minerais de cuivre et de plomb dont la production excède en général la demande. La préparation de l’arsenic élémentaire ne pose pas de problème car la réduction des composés oxygénés ou sulfurés ainsi que la purification se font sans difficulté. Les sulfures peuvent être grillés dans un courant d’air (l’anhydride arsénieux se sublimant) ou réduits par le charbon de bois. Le réalgar est chauffé directement avec du cyanure de potassium qui se transforme en thiocyanate:

Les arséniures contenus dans le mispickel se décomposent par chauffage et l’arsenic est recueilli directement. Dans tous les cas, la purification se fait par sublimation en présence de carbonate de sodium.
Les composés arsenicaux, outre leur intérêt thérapeutique, servent de pesticides (arséniates de calcium et de cuivre), certains arsénites, simples ou complexes, sont employés comme pigments en peinture ; c’est en particulier le cas du vert de Scheele Cu(AsO2)2 et surtout du vert de Paris Cu(CH3COO)2, 3Cu(AsO2)2. Enfin, l’arsenic entre dans la composition des plombs de chasse auxquels il confère de la dureté.
arsenic [ arsənik ] n. m.
• 1314; bas lat. d'o. gr. arsenicum
1 ♦ Alchim. (Vx) et Cour. Composé toxique de l'arsenic (2o). Arsenic blanc (anhydride arsénieux : mort aux rats), jaune, rouge (sulfures).
2 ♦ (1704) Chim. Élément (As; no at. 33; m. at. 74,92) du même groupe que l'azote, le phosphore et l'antimoine. L'arsenic naturel est cassant. Sulfure d'arsenic. ⇒ orpiment, réalgar. Sels d'arsenic : arséniures.
● arsenic nom masculin (latin arsenicum, du grec arsenikon) Corps simple d'apparence métallique, très répandu dans les minerais métalliques. (Élément chimique de symbole As.) Numéro atomique : 33 Masse atomique : 74,92 Température de fusion sous 36 atmosphères : 817 °C Masse volumique (variété stable) : 5,7 g°cm3 Nom donné à l'anhydride arsénieux, poison violent. Toute espèce de composé arsenical vénéneux.
arsenic
n. m.
d1./d Cour. Acide arsénieux, poison violent.
d2./d CHIM élément (symbole As), de numéro atomique Z = 33.
— Métalloïde (As) d'apparence métallique, de couleur gris acier, que l'on rencontre sous forme de sulfure et qui s'emploie pour durcir les métaux (plomb de chasse) et doper les semiconducteurs. (Ses composés, en général toxiques, entrent dans la fabrication des insecticides et des colorants.)
⇒ARSENIC, subst. masc.
CHIMIE
A.— Corps simple solide, de symbole As, d'aspect métallique, de couleur gris acier possédant à la fois des propriétés de métal et de métalloïde.
B.— Cour. Nom donné à divers composés de l'arsenic.
1. Vx. Arsenic jaune, orpiment; arsenic rouge, réalgar :
• 1. Le plomb est l'aïeul de tous les métaux. (Car l'or n'est pas un métal, l'or est la lumière). — Il ne faut au plomb que quatre périodes de deux cents ans chacune pour passer successivement de l'état de plomb à l'état d'arsenic rouge, de l'arsenic rouge à l'étain, de l'étain à l'argent. — Sont-ce là des faits?
HUGO, Notre-Dame de Paris, 1832, p. 204.
2. Nom impropre de l'anhydride arsénieux As2O3, poison violent. Synon. arsenic blanc, mort aux rats.
— MÉD. (toxicologie), lang. cour. Ce même composé, utilisé comme toxique, à l'aspect d'une poudre blanche, assez soluble dans l'eau, pratiquement insipide, peut être facilement confondu avec de la farine :
• 2. — Ah! voilà justement où est l'art : pour être un grand chimiste en Orient, il faut diriger le hasard; on y arrive. Mme de Villefort était rêveuse, et écoutait. — Mais, dit-elle, l'arsenic est indélébile; de quelque façon qu'on l'absorbe, il se retrouvera dans le corps de l'homme, du moment où il sera entré en quantité suffisante pour donner la mort.
A. DUMAS Père, Le Comte de Monte-Cristo, t. 1, 1846, p. 763.
• 3. Un beau jour, la justice arrive, on saisit une tisane, on y trouve de l'arsenic au fond; vous et votre mari, vous êtes arrêtés, jugés, condamnés, comme ayant voulu tuer le sieur Pons, afin de toucher votre legs...
BALZAC, Le Cousin Pons, 1847, p. 186.
• 4. — Mon Dieu! dit le vicomte, sait-on jamais, en ce monde, qui vit ou qui meurt? Vous sortez en voiture, un essieu se casse et une roue vous passe sur le corps; vous êtes à pied, un cavalier inhabile, montant un cheval fougueux, vous renverse, ou bien votre cuisinière se trompe, et croyant user de farine dans la confection d'un ragoût, y verse un paquet d'arsenic destiné à détruire les rats du grenier.
PONSON DU TERRAIL, Rocambole, t. 3, Le Club des valets de cœur, 1859, p. 253.
— PHARM. Ce composé est utilisé à très faible dose à des fins thérapeutiques (maladies nerveuses, affections de la peau) :
• 5. J'ai consulté hier le docteur Béchet qui a été fort aimable et très sérieux. Il m'a dit que je souffrais des nerfs, mais que ma poitrine n'était pas attaquée, que je n'avais aucune crainte à avoir — et m'a donné une ordonnance que je ferai exécuter demain matin, encore de l'arsenic, je crois.
MALLARMÉ, Correspondance, 1866, p. 229.
• 6. À table d'hôte, j'avais pour voisin un jeune Anglais qui me faisait pitié avec son vin de Bugeaud et ses pilules d'arsenic...
COPPÉE, Prose, Contes en prose, 1882, p. 195.
— TECHNOL. Composé utilisé pour clarifier le verre.
Rem. Les naturalistes employaient l'arsenic pour préserver de la putréfaction les animaux empaillés; il était employé également pour la conservation des peaux.
C.— ALCHIM. Arsenic des philosophes. ,,Le mercure ou la matière dont on tire le mercure ou le soufre`` (LITTRÉ).
DÉR. Arsénié, adj.Qui contient de l'arsenic. Médication arséniée. Synon. arsenical; en partic. qui est combiné avec l'arsenic. Hydrogène arsénié. Gaz incolore, d'odeur alliacée nauséabonde, très toxique, de formule As H3 (cf. arsine). (1803, BOISTE; suff. -é).
PRONONC. ET ORTH. — 1. Forme phon. :[ ]. PASSY 1914 et BARBEAU-RODHE 1930 admettent en outre [
]. PASSY 1914 et BARBEAU-RODHE 1930 admettent en outre [ ]. Cette forme est vieillie (cf. ROUSS.-LACL. 1927, MART. Comment prononce 1913, FOUCHÉ Prononc. 1959). Le rétablissement du [k] final apparaît à partir de BESCH. 1845. 2. Forme graph. — Tous les dér. de arsenic admettent l'accent aigu (et la prononc. correspondante), mais ne l'ont pas toujours : on trouve arsénical et arsenical, arsénicophage et arsenicophage, etc. V. BUBEN, Influence de l'orthographe sur la prononciation du français moderne, Bratislava, 1935, p. 35, relève le caractère sav. des mots admettant l'accent.
]. Cette forme est vieillie (cf. ROUSS.-LACL. 1927, MART. Comment prononce 1913, FOUCHÉ Prononc. 1959). Le rétablissement du [k] final apparaît à partir de BESCH. 1845. 2. Forme graph. — Tous les dér. de arsenic admettent l'accent aigu (et la prononc. correspondante), mais ne l'ont pas toujours : on trouve arsénical et arsenical, arsénicophage et arsenicophage, etc. V. BUBEN, Influence de l'orthographe sur la prononciation du français moderne, Bratislava, 1935, p. 35, relève le caractère sav. des mots admettant l'accent.
 ]. PASSY 1914 et BARBEAU-RODHE 1930 admettent en outre [
]. PASSY 1914 et BARBEAU-RODHE 1930 admettent en outre [ ]. Cette forme est vieillie (cf. ROUSS.-LACL. 1927, MART. Comment prononce 1913, FOUCHÉ Prononc. 1959). Le rétablissement du [k] final apparaît à partir de BESCH. 1845. 2. Forme graph. — Tous les dér. de arsenic admettent l'accent aigu (et la prononc. correspondante), mais ne l'ont pas toujours : on trouve arsénical et arsenical, arsénicophage et arsenicophage, etc. V. BUBEN, Influence de l'orthographe sur la prononciation du français moderne, Bratislava, 1935, p. 35, relève le caractère sav. des mots admettant l'accent.
]. Cette forme est vieillie (cf. ROUSS.-LACL. 1927, MART. Comment prononce 1913, FOUCHÉ Prononc. 1959). Le rétablissement du [k] final apparaît à partir de BESCH. 1845. 2. Forme graph. — Tous les dér. de arsenic admettent l'accent aigu (et la prononc. correspondante), mais ne l'ont pas toujours : on trouve arsénical et arsenical, arsénicophage et arsenicophage, etc. V. BUBEN, Influence de l'orthographe sur la prononciation du français moderne, Bratislava, 1935, p. 35, relève le caractère sav. des mots admettant l'accent. ÉTYMOL. ET HIST. — 1. a) 1393 « composé arsenical vénéneux » (Ménagier, éd., II, 64 : et se vos mesgnies vous rapportent que les ras dommagent vos blés, lars, fromages et autres garnisons, dictes à maistre Jehan qu'il les puet destruire en six manières : ... 6° Prenez une once de riagal; deux onces fin arsenic : un quarteron gresse de porc); b) 1611 « orpiment, réalgar, sulfure arsénieux, minerai du métal simple appelé arsenic en chimie » (COTGR.); 2. 1704 chim. régule d'arsenic « corps simple métalloïde » (Trév.); confondu par FUR. 1690 avec l'acide arsénieux qu'on obtient au cours du traitement du minerai ou à partir du métal pur; 1762 arsenic « id. » (Ac.).
Empr. au lat. arsenicum attesté au sens 1 b d'abord sous la forme arrhenicum dep. le Ier s. (CALPURNIUS SICULUS, Ecl., 5, 83 ds TLL s.v., arrhenicum, 636, 5), puis arsenicon (CAELIUS AURELIUS, Chron. 4, 8, 117, ibid., 53), arsenicum dep. ISIDORE (Orig., 19, 17, 12, ibid., 55), attesté au sens 1 a en lat. médiév. (ALBERT LE GRAND, Animal. 22, 124 ds Mittellat. W. s.v., 985, 22).
STAT. — Fréq. abs. littér. :73.
BBG. — ALEX. 1768. — BOUILLET 1859. — BRARD 1838. — BRUANT 1901. — CHARLES 1960. — CHESN. 1857. — Comm. t. 1 1837. — CRIQUI 1967 →. — DUVAL 1959. — Électron. 1963-64. — ESN. 1966. — FROMH.-KING 1968. — GALIANA Déc. sc. 1968. — GRAND. 1962. — Lar. comm. 1930. — Lar. méd. 1970. — Lar. mén. 1926. — LITTRÉ-ROBIN 1865. — MASSON 1970. — Méd. 1966. — Méd. Biol. t. 1 1970. — MONT. 1967. — Nucl. 1964. — NYSTEN 1824. — PAMART (P.). De l'alchim. à la chim. Vie Lang. 1969, n° 204, p. 141. — POUGH Index 1969. — PRIVAT-FOC. 1870. — Sc. 1962. — ST-EDME t. 1 1824. — UV.-CHAPMAN 1956.
arsenic [aʀsənik] n. m.
ÉTYM. 1314, in Arveiller; lat. arsenicum, du grec arsenikon.
❖
1 Alchim. (vx) et cour. Composé toxique de l'arsenic (2.). || Arsenic blanc (anhydride arsénieux), jaune, rouge (sulfures : orpiment, réalgar).
2 (1704). Chim. (mod.). Élément (symb. As; no at. 33; p. at. 74, 91) existant sous trois formes allotropiques (dens. 1,97, 4,73 et 5,73), la forme ordinaire se sublimant à 613 °C. ⇒ Arsénio-. || L'arsenic se rencontre à l'état natif sous forme de sulfure (⇒ Orpiment, réalgar), d'arséniure et d'arséniosulfures (autrefois dits arsenic); son principal minerai est l'arsénopyrite (⇒ Mispickel). || L'arsenic s'emploie dans la fabrication du plomb de chasse (alliage de plomb et d'arsenic); ses composés sont utilisés dans l'industrie des insecticides, des colorants, ainsi qu'en médecine. || Empoisonnement par les composés de l'arsenic. ⇒ Arsenicisme. || Arsenic et Vieilles Dentelles, titre d'une pièce et d'un film américains (Arsenic and Old Lace).
0 Quel est le poison (…) C'était de l'arsenic.
Flaubert, Mme Bovary, III, 8.
➪ tableau Noms de remèdes.
❖
DÉR. Arsenical, arsenicisme, arsénique, arsénite, arséniure, arsine. — V. Arséniate, arsénié, arsénieux.
COMP. V. Arsénio-.
Encyclopédie Universelle. 2012.