MITOSE
L’aphorisme omnis cellula e cellula a permis aux biologistes de comprendre que, au cours des générations cellulaires successives, la transmission de l’information génétique obéissait à des mécanismes d’une grande précision. La mitose est l’un d’entre eux: il caractérise les cellules eucaryotes.
Les cellules, qui composent tout organisme vivant, s’édifient, croissent et se divisent selon un programme inscrit dans les molécules bicaténaires d’ADN (acide désoxyribonucléique) bicaténaire que comportent les chromosomes et qui constituent leur génome. Les informations définissant et contrôlant les activités de la cellule sont portées par certaines séquences de désoxyribonucléotides de l’ADN ou gènes.
Toutes les cellules somatiques d’un organisme eucaryote dérivent les unes des autres et ainsi détiennent un même patrimoine génétique. Cela exige que la transmission de l’information concomitante d’une génération cellulaire à la suivante se fasse selon des mécanismes et des régulations extrêmement précis impliquant des risques minimes d’erreurs.
La mitose est l’un de ces mécanismes. Elle assure un partage rigoureux, entre deux cellules filles, du matériel informationnel préalablement dupliqué dans la cellule parentale.
La duplication du matériel génétique porteur de l’information se produit au cours de la période précédant la mitose ou interphase: deux molécules d’ADN identiques entre elles sont synthétisées à partir d’une molécule parentale à laquelle elles sont également identiques selon un mécanisme d’une extrême précision: la réplication de l’ADN. Une fois cette réplication réalisée, chaque chromosome comporte non plus une seule mais deux molécules d’ADN: chacun des chromosomes dupliqués est formé de deux chromatides, associées en une région appelée centromère. Il y a une molécule d’ADN dans chaque chromatide (fig. 1), puis les chromatides sont ensuite réparties entre deux cellules filles grâce aux mécanismes de la mitose. Réplication de l’ADN en interphase, puis mitose sont les deux événements principaux assurant une transmission fidèle de l’information au cours d’un cycle cellulaire de division.
Dans celui-ci, l’interphase est la période la plus longue; tout au long de cette période, la cellule synthétise des molécules de types variés, nécessaires à son maintien, à sa croissance et aussi à la division qui suivra l’interphase et qui se produira en général quand le volume de la cellule aura pratiquement doublé.
On divise l’interphase en trois étapes, en prenant comme période de référence celle, déjà mentionnée, où il y a synthèse d’ADN et que l’on désigne par phase S (S = synthesis). D’autres molécules que l’ADN sont aussi synthétisées durant cette période, comme, par exemple, les histones, protéines qui s’associent à l’ADN pour former, selon une architecture précise, l’édifice moléculaire complexe qu’est le chromosome. Les phases précédant et suivant la phase S sont désignées par phase G1 et phase G2 (G = gap ou intervalle); elles ne comportent pas de synthèse d’ADN, mais de nombreuses autres molécules s’y trouvent élaborées (fig. 1).
La phase G1 s’étend entre le moment où la cellule est individualisée, à la suite de la mitose d’une cellule parentale, et celui où elle synthétise de l’ADN, événement qui marque le début de la phase S. En G1, les chromosomes d’une cellule ne comportent chacun qu’une molécule d’ADN. Des molécules de types variés sont synthétisées en grand nombre en G1; la cellule augmente de volume au cours de cette période. La durée de G1 varie beaucoup selon les types cellulaires; comme on le verra plus loin, de nombreuses régulations se produisent en début de G1.
Lorsque la réplication de l’ADN est complète, la phase S se termine et la cellule est en phase G2, période en général courte, qui s’étend jusqu’au début de la mitose. En G2, les chromosomes d’une cellule sont dupliqués: ils comportent deux molécules d’ADN situées chacune dans une de leurs deux chromatides. Des synthèses se produisent en phase G2 et certains de leurs produits sont nécessaires au déroulement ultérieur de la mitose: c’est le cas, par exemple, de molécules impliquées dans la condensation des chromosomes, phénomène caractéristique de la mitose, qui débute, en fait, dès la fin de la phase G2.
La phase G1 est en fait celle dont la durée varie le plus, alors que les phases S, G2 et M ont des durées relativement constantes: pour des cellules de mammifères en culture, par exemple, S dure environ 8 h; G2, 4 h; M, de 1 à 2 h. Certaines cellules restent très longtemps en G1. Elles traversent ainsi une période au cours de laquelle elles ne s’accroissent pas et ne se divisent pas; cette période est désignée par G0 et les cellules en G0 sont appelées quiescentes.
Lorsque la cellule entre en mitose, la plupart des molécules nécessaires au déroulement de celle-ci sont déjà présentes. Il n’y a plus de transcription dans des cellules en mitose. Ce sont principalement des remaniements dans l’architecture d’édifices moléculaires ou des transformations biochimiques de molécules préexistantes qui sont responsables des changements structuraux que l’on observe au cours de la mitose.
Le partage du cytoplasme parental, qui accompagne la mitose et permet l’individualisation de deux cellules filles, est appelé cytodiérèse ; il se fait selon un mécanisme distinct de celui de la mitose, mais des corrélations temporelles et spatiales existent entre ces deux événements.
Le nombre de mitoses qui se déroulent dans un organisme durant la vie de l’individu est impressionnant: on a calculé que le maintien constant du nombre de globules rouges de notre organisme implique que deux millions de mitoses par seconde se produisent dans les cellules souches des globules. Un être humain adulte comporte environ cent mille milliards de cellules, dont les taux et les vitesses de renouvellement varient selon les catégories cellulaires, mais ne peuvent devenir anarchiques sans compromettre la santé ou même la vie de l’individu. La cancérisation n’est-elle pas liée à une prolifération anarchique de certaines catégories de cellules? On imagine le nombre et la complexité des régulations que nécessite le maintien d’une situation normale. On tentera dans cet article de montrer à quel niveau, biochimique et moléculaire, les mécanismes de partage de l’information et leurs régulations sont actuellement étudiés et compris. On verra combien de questions restent encore sans réponse en dépit des recherches intensives sur ce sujet.
Étude structurale de la mitose et de la cytodiérèse
La mitose se déroule de façon continue, mais on distingue des stades successifs caractéristiques pour en faciliter l’étude.
Bien que répondant à un même schéma général, les modalités de la mitose et la chronologie des événements qui s’y succèdent varient selon les types cellulaires. Cependant, lorsqu’une cellule entre en mitose, des changements structuraux caractéristiques se produisent au cours de son déroulement.
Les aspects tels qu’on les observe au microscope à lumière sont décrits depuis plus de cent ans (Flemming, 1879, 1880). Les chromosomes condensés et l’édifice cytosquelettique qui s’édifie au moment de la mitose pour diriger le partage des chromosomes sont, en effet, visibles avec cet instrument, ce qui a permis d’étudier le phénomène soit in vivo, soit sur des coupes de cellules fixées. Plus récemment, on a pu observer les structures mitotiques à une échelle plus fine, grâce aux microscopes électroniques, traditionnels (100 kV) ou à haute tension (de 1 à 2,5 millions de volts), et étudier leur nature chimique in situ, au microscope à fluorescence, après traitements immunocytochimiques.
Classiquement, la mitose est découpée en cinq stades successifs s’enchaînant de façon programmée; chacun d’eux est marqué par des changements structuraux caractéristiques; ces stades sont la prophase, la prémétaphase, la métaphase, l’anaphase et la télophase (fig. 2).
– Prophase : les chromosomes se condensent et deviennent visibles dans le noyau ; le fuseau s’édifie dans le cytoplasme (fig. 2 a et 2 b).
La prophase commence lorsque les chromosomes deviennent visibles dans le noyau sous forme de fins filaments enchevêtrés; les chromatides se condensent progressivement (alors que, dans les cellules en interphase, les chromosomes moins condensés ne sont pas visibles individuellement et leur ensemble constitue la chromatine ). On reconnaît les deux chromatides des chromosomes dupliqués, séparées l’une de l’autre par une faible distance, sauf dans la région du centromère où elles sont réunies; c’est dans cette région que sont observés, dans les cellules de Mammifères, de petits amas de matériel amorphe, accolés à chacune des chromatides: ce sont les ébauches des kinétochores, structures dont le rôle sera discuté plus loin.
Le nucléole disparaît progressivement au cours de la prophase.
En même temps que les chromosomes se condensent, un édifice cytosquelettique constitué majoritairement de microtubules de 25 nm de diamètre s’édifie dans le cytoplasme au voisinage du noyau. Des faisceaux de ces microtubules sont visibles au microscope à lumière, et constituent les fibres décrites grâce à cet instrument. Cet édifice en forme de fuseau se met en place de façon un peu différente selon que les cellules possèdent ou non des centrioles. Lorsque les cellules possèdent des centrioles (cas des cellules animales ou de végétaux inférieurs), ceux-ci sont dupliqués pendant l’interphase (à la fin de G1 ou en début de S) précédant la mitose. En début de prophase, les deux paires de centrioles s’éloignent l’une de l’autre en contournant le noyau. Chacune est entourée d’un matériel amorphe, le matériel péricentriolaire, dont le volume augmente. L’ensemble centrioles/matériel péricentriolaire constitue un complexe centriolaire (centrosome de la microscopie à lumière, fig. 3).
Des microtubules (ou fibres) rayonnent autour des complexes centriolaires. Très longs dans certains types cellulaires, comme les œufs d’échinodermes, ils constituent une figure appelée aster. La mitose est alors «astrale».
À mesure que les asters s’éloignent l’un de l’autre, les microtubules orientés d’un aster vers l’autre s’allongent et leurs extrémités distales (les plus éloignées des complexes centriolaires) s’interpénètrent dans la région équatoriale de l’édifice ainsi formé. Lorsque les deux asters sont en positions diamétralement opposées par rapport au noyau, ils définissent deux pôles dans la cellule (fig. 2 b).
Les microtubules orientés d’un complexe centriolaire vers l’autre, ou microtubules polaires (fibres polaires), ne dépassent pas l’équateur de l’édifice symétrique ou fuseau qui est alors constitué et où ils s’interpénètrent.
Les autres microtubules de l’aster s’allongent moins que les microtubules polaires. C’est cependant en prophase qu’ils sont les plus longs. Certains de ces microtubules astériens (fibres astériennes) butent contre l’enveloppe nucléaire qu’ils dépriment localement.
Dans les cellules dépourvues de centrioles (la plupart des cellules de végétaux supérieurs, certains protozoaires par exemple), on observe en microscopie électronique, en début de prophase, de nombreux microtubules entourant le noyau. Cette région de la cellule est appelée zone claire en raison de l’aspect qu’elle présente en microscopie à lumière. Les microtubules, dont les orientations sont d’abord irrégulières, s’ordonnent parallèlement et deviennent plus nombreux à mesure que la prophase avance. À la fin de la prophase, deux pôles sont définis de part et d’autre du noyau, d’où émanent des microtubules polaires pour constituer, comme dans les cellules animales, une ébauche de fuseau. La mitose, dans ce cas, est appelée «anastrale».
– Prémétaphase : l’enveloppe nucléaire se fragmente; les chromosomes condensés s’intègrent au fuseau et s’orientent par rapport aux pôles (fig. 2 c et 2 d).
La prémétaphase débute avec la rupture de l’enveloppe nucléaire qui se fait simultanément en plusieurs points, et d’abord dans les régions déprimées par les microtubules astériens dans le cas des mitoses astrales. Les fragments d’enveloppe forment des vésicules aplaties qui se dispersent dans la cellule, ainsi que les constituants de la lamina.
L’ébauche du fuseau édifiée en prophase occupe alors la région où se trouvait le noyau qu’elle contournait, les chromosomes se trouvent mêlés aux microtubules polaires dont le nombre augmente au cours de la prémétaphase.
Les chromosomes poursuivent leur condensation. Les kinétochores, dont les ébauches sont parfois détectées en prophase, se différencient. Ils sont situés en positions symétriques et opposées contre chacune des chromatides des chromosomes dupliqués et, le plus souvent, dans la région du centromère. Dans les cellules de mammifères, ils ont la forme de plaques ellipsoïdales trilamellaires (fig. 4), mais leur configuration est parfois différente dans d’autres types cellulaires.
Des microtubules attachés aux kinétochores complètent le fuseau en prémétaphase. Ils s’étendent des kinétochores aux pôles, et leur trajet est parallèle à celui des microtubules polaires: ce sont les microtubules kinétochoriens (fibres kinétochoriennes ou chromosomiques de la microscopie à lumière). Leur nombre varie de un à plusieurs dizaines par chromosome selon les types cellulaires.
Ces microtubules jouent un rôle important dans l’intégration des chromosomes au fuseau polaire précédemment constitué. Perpendiculaires au plan des kinétochores et dirigés vers chacun des pôles, ils orientent les chromosomes par rapport à ceux-ci; parallèles aux microtubules polaires, ils sont susceptibles d’interactions en rapport avec les mouvements des chromosomes.
Les chromosomes sont en effet animés de mouvements au cours de la prémétaphase; ces mouvements asynchrones et souvent oscillants les déplacent en définitive vers l’équateur du fuseau, alors que leur position et leur orientation par rapport aux pôles était quelconque en début de prémétaphase: ce déplacement est appelé «congression» par les auteurs anglo-saxons.
– Métaphase : les chromosomes au maximum de leur condensation sont disposés en «plaque équatoriale» (fig. 2 e, 5 a et 5 b).
Lorsque tous les chromosomes ont atteint la région équatoriale du fuseau et que leurs centromères, ou plus précisément leurs kinétochores, sont situés dans un même plan équatorial, la cellule est en métaphase. Chacun des kinétochores différenciés contre chacune des deux chromatides sœurs d’un chromosome est orienté vers l’un des pôles du fuseau, tout comme les microtubules kinétochoriens attachés à ces kinétochores.
La symétrie de l’appareil mitotique par rapport au plan équatorial du fuseau et l’orientation précise des chromosomes par rapport aux pôles auxquels ils sont attachés par les microtubules kinétochoriens caractérisent la métaphase.
Le fuseau, très volumineux à ce stade, envahit souvent la majeure partie du volume cellulaire. Entre les deux jeux de kinétochores d’orientations opposées, on définit une zone étroite appelée interzone. Les régions du fuseau situées entre chaque jeu de kinétochores et le pôle lui faisant face sont des demi-fuseaux, symétriques par rapport au plan équatorial.
– Anaphase : les chromatides se séparent et se partagent en deux lots identiques qui se déplacent vers les pôles opposés du fuseau (fig. 2 f et 2 g, 5 c et 6).
L’anaphase commence lorsque les chromatides sœurs des chromosomes dupliqués, réunies jusque-là dans la région du centromère, se séparent l’une de l’autre, les centromères étant tous situés dans le plan équatorial du fuseau en métaphase avant que ne se produise cette séparation. Chaque chromatide devient alors un chromosome indépendant dit chromosome fils comportant une seule molécule d’ADN.
Les deux jeux identiques de chromosomes fils se déplacent en directions opposées vers les pôles du fuseau. Les kinétochores sont en tête, et les bras des chromosomes sont en arrière, ce qui donne à ces structures une forme en V. Le déplacement des chromosomes est synchrone, et se fait à une vitesse variant de un à quelques 猪m/seconde.
Les microtubules kinétochoriens et les demi-fuseaux raccourcissent à mesure que les chromosomes se rapprochent des pôles.
La seconde partie de l’anaphase, se situant par exemple au moment où les chromosomes ont parcouru la moitié du trajet les conduisant aux pôles, est marquée par un allongement parfois important du fuseau et de l’interzone; les deux pôles s’éloignent alors l’un de l’autre; le fuseau double parfois sa longueur. Les microtubules polaires s’allongent au cours de ce phénomène, si bien qu’ils continuent à s’interpénétrer dans la région équatoriale du fuseau.
– Télophase : les noyaux fils se constituent autour des chromosomes parvenus aux pôles (fig. 2 h, 5 d et 7 b).
Les deux lots de chromosomes parviennent chacun à un pôle du fuseau où ils se groupent en amas serrés. Des composants de la lamina et des vésicules aplaties limitées par une membrane s’associent à la surface de ces amas. Ces structures s’organisent et fusionnent entre elles afin de constituer une enveloppe nucléaire, dans laquelle apparaissent les pores, et qui est doublée du côté nucléoplasmique par une lamina. À la fin de la télophase, les chromosomes sont entièrement entourés par une enveloppe nucléaire de structure caractéristique [cf. CELLULE].
Les chromosomes se décondensent progressivement dans les noyaux fils qui augmentent de volume. La chromatine prend peu à peu un aspect interphasique. Le nucléole réapparaît.
Le temps nécessaire à la décondensation des noyaux fils est équivalent à celui de la prophase. Les noyaux fils sont considérés comme étant en interphase lorsque la transcription reprend; chacun d’eux est alors en phase G1 d’un nouveau cycle cellulaire.
Lorsque l’enveloppe nucléaire est constituée, les microtubules fusoriaux de l’interzone perdent tout contact avec les pôles. Ces microtubules interzonaux, résidus des microtubules polaires, se groupent en un ou plusieurs faisceaux enrobés dans leur région médiane par une substance amorphe. Dans les cellules animales, une telle substance enrobe dans leur région centrale des microtubules groupés en un seul faisceau, constituant ainsi le corps médian (fig. 7 b); dans les cellules végétales, plusieurs faisceaux persistent dans la région centrale de la cellule et sont enrobés, en leur milieu, par un matériel amorphe dont la constitution chimique, tout comme celle du corps médian des cellules animales, n’est pas connue.
La cytodiérèse , ou partage du cytoplasme, est un phénomène distinct de la mitose mais qui se produit en corrélation avec elle au cours de l’anaphase et de la télophase.
Pour que deux cellules filles s’individualisent à la fin de la division, le cytoplasme parental se partage en deux parties qui contiennent chacune un des noyaux fils et un certain nombre d’organites cytoplasmiques (approximativement la moitié des organites de la cellule parentale si les deux cellules filles sont de taille égale).
Les modalités de la cytodiérèse diffèrent selon qu’il s’agit de cellules animales ou végétales.
Chez les cellules animales, la cytodiérèse se fait par étranglement du cytoplasme de la cellule mère. Au milieu ou à la fin de l’anaphase, la membrane plasmique s’invagine tout autour de la cellule selon un plan correspondant à la région équatoriale du fuseau. Le sillon circulaire ainsi formé est le sillon de division. Celui-ci se creuse progressivement durant la télophase et se resserre autour du faisceau de microtubules interzonaux dans la région du corps médian.
Un pont cytoplasmique persiste parfois entre les deux cellules filles, tout autour de ce faisceau, alors que ces cellules sont déjà en interphase (fig. 7 b). Il finit par se rompre. Les deux cellules filles se séparent alors et les microtubules disparaissent.
Lorsque l’invagination de la membrane plasmique se produit pour former le sillon, des filaments de 5 à 7 nm de diamètre arrangés concentriquement sont observés dans le cortex cytoplasmique sous-jacent. Ils constituent l’anneau contractile, de 0,1 à 0,2 猪m d’épaisseur. Ces filaments sont de l’actine (fig. 13).
De la myosine est aussi mise en évidence dans l’anneau contractile et, comme on le verra, son fonctionnement est dû à des interactions entre ces protéines contractiles.
Dans les cellules végétales, la cytodiérèse se fait par édification d’une structure qui sépare en deux parties le cytoplasme de la cellule mère et qui commence à s’édifier à la fin de l’anaphase, selon un plan équatorial, au voisinage des faisceaux de microtubules interzonaux et du matériel amorphe qui les enrobe dans leur région centrale. Des vésicules d’origine golgienne viennent s’accoler à ces faisceaux. En fusionnant, ces vésicules constituent le phragmoplaste, qui s’édifie de façon centrifuge du centre de la cellule parentale vers la périphérie; les membranes des vésicules, en fusionnant, forment les membranes plasmiques des deux cellules filles, là où le cytoplasme de la cellule mère est partagé. Le contenu des vésicules constitue l’ébauche de la cloison dans la région séparant les deux parties néoformées des membranes plasmiques. Des ponts très fins ou plasmodesmes persistent entre les cellules filles et établissent entre elles des communications permanentes (fig. 8).
Mécanismes moléculaires de la mitose
Si la mitose est étudiée depuis longtemps au microscope à lumière, et plus récemment à l’échelle des ultrastructures au microscope électronique, bien des questions restent à élucider sur les mécanismes des événements dynamiques qu’elle comporte.
C’est en utilisant des techniques variées, immunocytochimiques, biochimiques, physiologiques, génétiques et de la biologie moléculaire que des résultats, encore très fragmentaires, sont obtenus.
On résumera ici quelques-uns d’entre eux, en montrant que c’est à l’échelle de l’organisation moléculaire des structures que les problèmes de la mitose sont abordés.
Construction et configuration spatiale du fuseau dépendent en grande partie des centres organisateurs de microtubules des cellules en mitose et des propriétés de la tubuline.
L’entrée d’une cellule en mitose est caractérisée, entre autres, par la réorganisation de son cytosquelette. Microtubules et filaments d’actine sont alors dépolymérisés, ce qui entraîne un changement de forme de la cellule qui devient sphérique. Les molécules de tubuline devenues disponibles sont utilisées pour former le fuseau bipolaire de division, cytosquelette spécifique de la cellule en mitose, dont la construction commence dès le début de la prophase. Les microtubules en sont le constituant le plus abondant. Ils sont indispensables au déroulement de la mitose qui s’arrête si leur polymérisation est inhibée par des drogues comme la colchicine ou la vinblastine par exemple (ces drogues sont des antimitotiques utilisés dans la thérapeutique du cancer).
– Centres organisateurs de microtubules : initiation et orientation des microtubules fusoriaux .
L’initiation de la polymérisation des microtubules du fuseau et leur orientation dépendent tout d’abord de la position et des interactions des centres organisateurs de microtubules des cellules en mitose; bien individualisés du point de vue structural, ces centres initiateurs sont les amas de matériel amorphe situés aux pôles du fuseau (autour des paires de centrioles dans les cellules possédant ces organites) et les kinétochores différenciés dans la région du centromère des chromosomes dupliqués.
Le rôle de centre organisateur joué par ces structures est suggéré d’abord par des observations anatomiques: les microtubules polaires et astériens ont une de leurs extrémités ancrée dans le matériel amorphe polaire; les microtubules kinétochoriens ont une de leurs extrémités attachée aux kinétochores.
Ce rôle est confirmé par des expériences réalisées in vivo et in vitro. In vivo, une irradiation par un fin rayon laser du matériel péricentriolaire de cellules de mammifères en prophase, lésant ce matériel à un pôle du fuseau, a pour conséquence de réduire considérablement le nombre de microtubules issus de ce pôle dans le demi-fuseau correspondant lorsque la mitose se poursuit. Une autre expérience consiste à traiter sur le vivant des cellules en mitose par une drogue, le nocodazole, qui inhibe la polymérisation de la tubuline et provoque une dépolymérisation rapide mais réversible des microtubules. Lorsque le traitement par le nocodazole est arrêté, des microtubules s’édifient rapidement à partir du matériel péricentriolaire et à partir des kinétochores.
In vitro, lorsque des complexes centriolaires sont isolés à partir de cellules animales en mitose et sont placés dans un milieu approprié contenant des molécules de tubuline, des microtubules se forment à partir du matériel péricentriolaire des complexes. De même, si des chromosomes métaphasiques, isolés de façon telle qu’aucun microtubule ne reste attaché à leurs kinétochores, sont ensuite placés dans un milieu contenant de la tubuline, des microtubules s’édifient à partir des kinétochores (fig. 9).
Cependant, in vivo et dans les conditions normales, le rôle de centre initiateur des kinétochores est contesté par certains auteurs. Ceux-ci pensent que les kinétochores ont la propriété de capter, après rupture de l’enveloppe nucléaire, les extrémités libres de microtubules polaires avec lesquels ils sont susceptibles d’entrer en contact lorsque l’ébauche du fuseau occupe l’emplacement du noyau, provoquant ainsi l’orientation des chromosomes par rapport aux pôles.
Il faut noter que les centrioles ne semblent pas directement impliqués dans le processus de nucléation: si on les irradie par un rayon laser dans des cellules en prophase, le déroulement de la mitose n’est pas perturbé: les cellules ne possédant pas de centrioles ont du reste une mitose tout à fait normale (mitoses anastrales).
On ignore le mécanisme de la nucléation des microtubules dans les centres initiateurs. L’ARN, mis en évidence dans le matériel péricentriolaire où il est associé à des protéines, joue sans doute un rôle important, puisque, après traitement par une ARNase d’appareils mitotiques isolés de cellules de mammifères, le matériel péricentriolaire perd sa propriété de centre organisateur de microtubules.
De même, la formation et les propriétés des kinétochores sont en relation avec la présence d’ADN: en effet, dans des cellules de mammifères en mitose, un traitement par des ADNases désorganise la structure des kinétochores et les rend inactifs.
– Élongation des microtubules du fuseau : équilibre dynamique tubuline/microtubules.
Une fois nucléés dans les centres organisateurs, les microtubules s’allongent dans une direction déterminée par rapport à ce centre, et le fuseau acquiert sa configuration spatiale. Le degré d’allongement des microtubules fusoriaux dépend à la fois des propriétés de la tubuline et des conditions du milieu où elle polymérise. On sait qu’un équilibre dynamique existe entre microtubules et molécules libres de tubuline [cf. CELLULE]. Les microtubules ne sont pas des structures stables: leurs molécules se renouvellent sans cesse, et la longueur des microtubules est fonction de la concentration en tubuline du milieu.
Ce phénomène est étudié in vitro: lorsqu’il y a équilibre entre molécules libres et polymérisées en microtubules, la longueur de ceux-ci reste constante; au-dessus ou audessous de la quantité de tubuline correspondant à cet état d’équilibre, les microtubules sont allongés ou, au contraire, dépolymérisés. On montre aussi in vitro que, outre la concentration en tubuline du milieu, d’autres facteurs peuvent déplacer l’équilibre dans les sens de la polymérisation et de la dépolymérisation: l’existence de protéines associées aux microtubules (MAP’S) favorise l’état polymérisé; une forte concentration en Ca2+ produit au contraire une dépolymérisation.
Les microtubules fusoriaux sont en équilibre avec des molécules de tubuline libres, et leur longueur est en partie contrôlée par la concentration en tubuline du milieu où ils baignent. D’autres facteurs jouent aussi un rôle dans leur degré d’élongation: par exemple, des protéines associées aux microtubules fusoriaux sont observées. Elles ont l’aspect de filaments fins et courts, plus ou moins régulièrement espacés et hérissant la surface des microtubules entre lesquels ils forment parfois des ponts. La présence de ces protéines augmente la stabilité des microtubules et explique peut-être pourquoi les microtubules kinétochoriens résistent mieux aux agents dépolymérisants que les microtubules polaires.
Quant à la concentration en calcium du milieu fusorial (matrice du fuseau), elle est régulée par une protéine régulatrice du taux de calcium, la calmoduline, que l’on met en évidence dans le fuseau par immunofluorescence (fig. 10).
– Polarité des microtubules fusoriaux : à mesure que le fuseau s’édifie, des interactions entre certains de ses constituants interviennent pour lui donner son architecture spatiale: de telles interactions sont probablement responsables, par exemple, de l’orientation des chromosomes par rapport aux pôles et de la disposition parallèle des microtubules polaires et kinétochoriens qui se produisent en prémétaphase. La polarité des microtubules détermine en partie leurs possibilités d’interactions et, par là même, leurs potentialités fonctionnelles.
Les microtubules ont en effet une polarité: leurs deux extrémités n’ont pas la même configuration moléculaire. Cela résulte de l’asymétrie de la molécule de tubuline, qui comporte deux sous-unités différentes, 見 et 廓. Lorsque la tubuline polymérise pour former un microtubule, toutes les molécules sont orientées dans le même sens, selon l’axe du microtubule. Il en résulte que l’une de ses extrémités comporte des sous-unités 見 alors que l’autre possède des sous-unités 廓.
In vitro, dans des conditions où il y a élongation des microtubules, celle-ci peut se faire par leurs deux extrémités. Dans ce cas, l’une des extrémités s’allonge plus rapidement que l’autre: on la désigne par extrémité +; à l’opposé se trouve l’extrémité 漣, à élongation lente (fig. 11).
On montre que les microtubules fusoriaux ont tous la même polarité. Les microtubules polaires ont leur extrémité 漣 dans la région polaire; leur extrémité + est distale par rapport aux pôles, et elle est située dans la région équatoriale du fuseau où s’interpénètrent les deux familles de microtubules polaires issus de pôles opposés. L’élongation de ces microtubules en anaphase se fait par leur extrémité +.
Les microtubules kinétochoriens ont la même polarité que les microtubules polaires: leur extrémité 漣 se trouve dans la région polaire et l’extrémité + est attachée aux kinétochores. Cela pose un problème très discuté, car on pense que l’élongation des microtubules se fait préférentiellement par l’extrémité distale par rapport au centre de nucléation, qui est ici celle à croissance lente (face=F0019 漣); cette situation n’est cependant pas incompatible avec un allongement qui se ferait soit par l’extrémité + attachée au kinétochore, soit par l’extrémité 漣.
Mouvements de la mitose : des hypothèses sont faites sur leurs mécanismes.
Un des plus anciens problèmes posés par la mitose est celui des mouvements des chromosomes: mouvements de la prophase et de la prémétaphase et, surtout, mouvements de l’anaphase.
Afin de comprendre leurs mécanismes, de nombreuses méthodes sont employées: des expériences sont réalisées in situ par micromanipulation, ou bien sur des appareils mitotiques isolés et fonctionnels; les constituants du fuseau sont par ailleurs inventoriés et étudiés in vitro pour connaître leurs possibilités d’interactions. Les résultats de ces travaux, s’ils font entrevoir des solutions possibles, ne permettent pourtant pas une interprétation définitive.
Les mouvements de la prophase et de la prémétaphase ne sont pas compris actuellement. Leurs mécanismes impliquent sans doute des interactions entre centres organisateurs de microtubules, microtubules polaires et microtubules kinétochoriens qui sont parallèles les uns aux autres lorsque les chromosomes s’orientent par rapport aux pôles et qui ont tous même polarité, mais on ne sait rien des forces qui sont à l’origine de ces mouvements.
Plusieurs interprétations sont données au sujet des mouvements de l’anaphase: mouvements des chromosomes vers les pôles du fuseau et éloignement de ces pôles accompagnant l’allongement du fuseau.
D’après la théorie de l’équilibre dynamique, l’équilibre qui existe entre les microtubules fusoriaux et les molécules libres de tubuline explique tous les mouvements de l’anaphase: la dépolymérisation des microtubules kinétochoriens, qui se produit lorsque les chromosomes se rapprochent des pôles, contrôle la vitesse du mouvement, fournit l’énergie nécessaire et libère des molécules de tubuline qui sont utilisées pour allonger les microtubules polaires, ce qui provoque l’allongement du fuseau et l’éloignement des pôles.
Il est improbable que l’équilibre dynamique soit responsable de l’ensemble de ces phénomènes où interviennent sans doute d’autres constituants du fuseau. Cependant, des expériences dans lesquelles la dépolymérisation des microtubules kinétochoriens est bloquée ou au contraire accélérée au cours de l’anaphase montrent que cette dépolymérisation contrôle la vitesse des mouvements des chromosomes vers les pôles. La dépolymérisation est elle-même contrôlée in vivo par le taux de calcium présent dans cette région du fuseau, taux régulé par la calmoduline. Quant à l’origine des forces qui provoquent les mouvements des chromosomes vers les pôles, celle-ci n’est pas clairement démontrée.
L’hypothèse selon laquelle un système actine-myosine intervient est improbable: dans des appareils mitotiques isolés d’œufs d’oursin en segmentation, les mouvements des chromosomes ne sont pas bloqués par des anticorps antimyosine.
Il est possible que ces mouvements résultent d’interactions entre microtubules kinétochoriens et filaments d’actine, se faisant dans les demi-fuseaux, par l’intermédiaire de protéines associées aux microtubules et à activité ATPasique: l’hydrolyse de l’ATP fournit alors l’énergie nécessaire au mouvement.
L’allongement du fuseau et l’éloignement des pôles qui interviennent dans la seconde partie de l’anaphase résultent de glissements les uns par rapport aux autres des microtubules polaires de polarités opposées dont les extrémités + s’interpénètrent à l’équateur du fuseau (fig. 2 f et g). Les ponts observés entre ces microtubules sont des protéines associées de type dynéine, à activité ATPasique. L’hydrolyse de l’ATP produit les forces nécessaires au glissement. Des inhibiteurs de l’activité ATPasique de la dynéine, protéine associée aux microtubules des cils et des flagelles, arrêtent en effet l’élongation anaphasique du fuseau dans des appareils mitotiques isolés.
Mouvements des chromosomes et allongement du fuseau impliquent probablement des mécanismes différents dont l’analyse n’est pas encore terminée. Cette étude est difficile pour plusieurs raisons: l’appareil mitotique est une structure éphémère, contrairement au muscle, aux cils et aux flagelles, dont la motilité est plus aisément étudiée; de plus, les forces nécessaires au mouvement des chromosomes sont faibles: l’hydrolyse de vingt molécules d’ATP fournit en moyenne une force suffisante pour déplacer un chromosome vers un pôle à une vitesse de 1 猪m/minute.
Condensation des chromosomes mitotiques : elle est en relation avec la phosphorylation de l’histone H1.
L’entrée en mitose d’une cellule est caractérisée par la condensation de ses chromosomes. L’architecture moléculaire du chromosome métaphasique est étudiée par différentes méthodes, et des modèles sont proposés pour figurer la manière dont le nucléofilament est reployé pour réaliser cet état de condensation [cf. CHROMOSOMES].
Lorsque la condensation des chromosomes mitotiques se produit, il y a phosphorylation de certaines histones, en particulier de l’histone H1, qui comporte au moins de 6 à 7 sites de phosphorylation situés dans les régions basiques C et N terminales. Des interactions se produisent alors entre les molécules d’histones phosphorylées et provoquent des reploiements des chromosomes qui se condensent de ce fait. L’histone H3 est aussi phosphorylée durant la mitose.
La phosphorylation des histones des chromosomes débute en fait dès la fin de la phase G2 de l’interphase.
Fragmentation et reconstitution de l’enveloppe nucléaire : ces phénomènes sont en relation avec la dépolymérisation réversible des protéines de la lamina.
La lamina est la couche mince de nature protéique qui est accolée à la membrane nucléaire interne, du côté nucléoplasmique. L’analyse biochimique de la lamina montre qu’elle comporte majoritairement trois protéines, qui sont des phosphoprotéines. Ces protéines forment un édifice moléculaire qui s’associe à certaines régions des chromosomes et aux pores nucléaires dans le noyau interphasique intact [cf. CELLULE].
Au cours de la mitose, les protéines de la lamina se séparent les unes des autres et sont à l’état de monomères lorsque l’enveloppe nucléaire se fragmente en vésicules à la prémétaphase. Deux de ces protéines sont alors à l’état soluble alors que la troisième reste associée aux vésicules provenant de la fragmentation.
Les trois protéines se réassocient pour former la lamina, en télophase, lorsque l’enveloppe nucléaire se reconstitue au contact des deux amas de chromosomes parvenus aux pôles du fuseau.
La dissociation réversible des protéines de la lamina est en relation avec leur degré de phosphorylation: à l’état dépolymérisé, ces protéines ont un degré de phosphorylation très supérieur à celui qui les caractérise lorsqu’elles forment l’édifice moléculaire organisé qu’est la lamina (fig. 12).
Déphosphorylation et phosphorylation réversibles des trois protéines de la lamina, entraînant leur dissociation ou leur assemblage en édifice organisé, sont des phénomènes biochimiques déterminant probablement la fragmentation de l’enveloppe nucléaire en prémétaphase et sa reconstruction en télophase. Le degré de phosphorylation de ces protéines est lui-même sous le contrôle de kinases , enzymes catalysant la phosphorylation de protéines.
Mécanismes de la cytodiérèse
Mitose et cytodiérèse sont des événements distincts mais coordonnés dans le temps et dans l’espace .
Mitose et cytodiérèse aboutissent ensemble à la formation de deux cellules filles de nouvelle génération issues de la division d’une cellule parentale. Les mécanismes de ces deux événements sont cependant bien distincts et nécessitent, comme on l’a vu plus haut, l’élaboration d’édifices moléculaires spécifiques: appareil mitotique pour le partage des chromosomes, anneau contractile ou phragmoplaste pour la division du cytoplasme. Mitose et cytodiérèse sont cependant coordonnées dans le temps, cela dans la majorité des types cellulaires, et coordonnées dans l’espace.
– Coordination temporelle: la cytodiérèse commence en général en fin d’anaphase et se poursuit en télophase; certaines variations sont cependant observées; il existe aussi des cas où la mitose n’est pas accompagnée de cytodiérèse: des cellules multinucléées se forment alors (cas de certaines algues par exemple).
– Corrélation géométrique: le plan selon lequel se fait la division du cytoplasme parental est toujours perpendiculaire à l’axe passant par les deux pôles du fuseau, et il passe par l’équateur de celui-ci.
L’appareil mitotique occupant en général une position centrale dans la cellule parentale, il en résulte que les deux cellules filles sont sensiblement de même taille. Si l’appareil mitotique est excentrique (cas des divisions de l’ovogenèse ou de certaines cellules embryonnaires), les cellules filles sont de taille inégale.
Des hypothèses, basées sur des résultats expérimentaux, tentent d’interpréter la signification fonctionnelle de ces corrélations au sujet desquelles bien des points restent à élucider. La plupart des travaux concernent les cellules animales qui se divisent par étranglement grâce à la progression centripète d’un sillon de division.
Dans les cellules animales, les stimuli provoquant l’initiation du clivage sont en rapport avec l’appareil mitotique.
De nombreuses expériences montrent que l’appareil mitotique joue un rôle dans l’initiation de la cytodiérèse; ainsi, si cet appareil est déplacé dans la cellule, par micromanipulation par exemple, à un stade précédant l’anaphase (il y a des variations à ce sujet selon les types cellulaires), le plan de clivage du cytoplasme correspond au plan équatorial du fuseau dans sa nouvelle position.
N’importe quelle région du cortex cellulaire est donc apte à former un sillon de division, et la région où celui-là est initié est déterminée par la position relative du fuseau aux premiers stades de la mitose. Ultérieurement, la cytodiérèse initiée selon un certain plan progresse en général dans le même sens à mesure que se déroule la mitose, même si l’appareil mitotique est déplacé ou désorganisé par actions mécanique ou chimique.
La nature et l’origine des interactions entre appareil mitotique et cortex cellulaire, provoquant l’initiation de la cytodiérèse, font l’objet d’hypothèses.
Selon certains auteurs, le clivage est initié par interactions mécaniques entre le cortex cellulaire et certaines parties du fuseau, en particulier les asters. Les microtubules astériens, en contact par leur extrémité distale avec la région périphérique de la cellule, y provoquent des distorsions responsables de l’activation de ces régions. On considère que la stimulation touche soit les régions corticales polaires des cellules, créant ainsi un effet à distance qui est répercuté à la région équatoriale, soit la région équatoriale directement. Rappelons que dans certaines cellules animales, comme les œufs d’échinodermes par exemple, les asters sont très volumineux en prophase, les extrémités des microtubules astériens atteignant la surface cellulaire jusque dans la région équatoriale de la cellule. Cela n’est cependant pas toujours le cas, et les asters sont de dimensions plus réduites dans beaucoup de types cellulaires.
Une autre possibilité est que l’initiation de la cytodiérèse et les changements structuraux caractérisant la formation du sillon de division dépendent de changements biochimiques localisés du cortex cellulaire, provoqués par l’apport dans ces régions de métabolites comme le Ca2+, des sels minéraux ou quelque autre facteur non identifié.
Les microtubules fusoriaux et plus particulièrement astériens, très longs en prophase, servent alors de guides pour orienter préférentiellement vers ces régions des vésicules contenant du Ca2+ par exemple: de telles vésicules sont en effet mises en évidence dans la matrice et au voisinage de l’appareil mitotique.
Des arguments en faveur de cette interprétation sont fournis notamment par des expériences faites sur des œufs d’amphibiens; l’apparition d’un sillon de division peut être provoquée dans ces œufs, en l’absence d’appareil mitotique (ce dernier étant ôté de la cellule par micromanipulateur ou désorganisé par action d’antimitotiques comme la colchicine), en injectant du Ca+2, des solutions salines ou des fragments de cytoplasme sous-cortical provenant de la région du sillon de cellules en division.
Les mécanismes de la cytodiérèse des cellules animales sont basés sur des interactions actine-myosine .
Une fois la cytodiérèse initiée, l’appareil mitotique ne semble pas indispensable à la progression centripète du sillon de division qui se poursuit en général même si le fuseau est désorganisé par action de la colchicine par exemple.
Ce sont des interactions entre actine et myosine de l’anneau contractile qui sont à l’origine des forces provoquant la contraction de l’anneau et le partage du cytoplasme parental par étranglement.
L’anneau contractile comporte en effet des filaments d’actine de 5 à 7 nm de diamètre arrangés concentriquement. La myosine et l’ 見-actinine y sont aussi mises en évidence par immunofluorescence. Si on désorganise les filaments d’actine par action de la cytochalasine B, la progression du sillon est arrêtée. L’injection d’anticorps antimyosine dans des œufs d’oursin provoque la relaxation de l’anneau.
On ignore la disposition précise de ces molécules dans l’anneau. Selon une hypothèse schématisée ci-dessous (fig. 13), l’ 見-actinine attache une des extrémités des filaments d’actine à la membrane plasmique; de courts filaments de myosine s’intercalent entre deux filaments d’actine de polarités opposées. Les interactions actine-myosine provoquent des glissements des filaments d’actine les uns par rapport aux autres, entraînant la contraction de l’anneau, selon un mécanisme comparable à celui de la contraction musculaire.
L’anneau contractile ne change pas d’épaisseur à mesure qu’il se resserre, ce qui implique que le nombre de filaments qui le composent diminue progressivement en se dépolymérisant.
Les mécanismes de la cytodiérèse des cellules végétales à paroi sont différents.
Comme on l’a vu plus haut, la cytodiérèse des cellules végétales, entourées par une paroi rigide, se fait par édification d’une plaque cellulaire, partageant le cytoplasme de la cellule parentale et comportant les parties néoformées des membranes plasmiques et des parois des cellules filles (fig. 8).
Les mécanismes de formation de la plaque cellulaire sont peu connus. Les microtubules télophasiques orientent sans doute les vésicules d’origine golgienne vers la région équatoriale de la cellule où elles fusionnent entre elles. On connaît mal les interactions éventuelles de ces vésicules avec la substance dense qui enrobe dans cette région les microtubules. Les vésicules fusionnent d’abord dans la région centrale, constituant une portion du phragmoplaste. Lorsque celui-ci s’étend en périphérie (fig. 8), de nouveaux microtubules s’édifient tout autour de cette région centrale, et des vésicules s’y accolent et fusionnent progressivement. On ignore comment ces microtubules périphériques sont initiés.
Les vésicules contiennent des polysaccharides. Ceux-ci sont des précurseurs des constituants de la paroi, comme on peut le montrer par autoradiographie par exemple.
La cytodiérèse répartit de façon à peu près égale les organites cytoplasmiques entre les cellules filles.
Le partage des organites cytoplasmiques parentaux entre les deux cellules filles ne se fait pas avec la même précision que celui des chromosomes, surtout si ces organites sont nombreux. Cependant, leur distribution ne se fait pas au hasard, cela pour plusieurs raisons.
Tout d’abord, la distribution topographique des organites cellulaires (mitochondries, appareil de Golgi, lysosomes, ribosomes), n’est pas quelconque. Le cytosquelette, microtubules, filaments d’actine, filaments intermédiaires, détermine l’organisation du cytoplasme et la distribution des organites qu’il contient.
Ensuite, lorsque les organites se déplacent dans le cytoplasme, ce qui se produit continuellement, la direction de leurs mouvements est aussi déterminée par des éléments du cytosquelette de façon à assurer une distribution topographique déterminée.
Pendant les périodes de croissance cellulaire (surtout la phase G1 du cycle cellulaire), le nombre des organites s’accroît en même temps que la taille de la cellule. Leurs mouvements, guidés par les microtubules, les distribuent topographiquement dans le cytoplasme dont le volume augmente. Cette distribution est telle que la cytodiérèse, quand elle se produit, partage en deux lots approximativement égaux les organites ainsi disposés.
Lorsque les cellules ne contiennent qu’un seul organite d’une catégorie donnée, chaque cellule fille hérite d’une moitié de celui-là; c’est le cas d’algues comme le spirogyre, qui ne possèdent qu’un chloroplaste: celui-ci s’allonge avant que la cytodiérèse ne partage la cellule en division et se dispose de façon telle que chaque cellule fille emporte en définitive une moitié de ce chloroplaste parental.
Problèmes cytophysiologiques
– Mitoses d’eucaryotes primitifs : l’étude des eucaryotes primitifs montre que les mécanismes de la mitose se sont compliqués au cours de l’évolution.
Les mitoses de certains eucaryotes primitifs n’ont pas le même degré de complexité que la mitose des organismes supérieurs telle qu’elle vient d’être décrite.
Des organismes comme les dinoflagellés, certains champignons inférieurs, certains protozoaires se divisent en effet selon des modalités très variées. Une des originalités de ces divisions, si on les compare à la mitose des eucaryotes supérieurs, est que l’enveloppe nucléaire ne se fragmente pas mais conserve son intégrité au cours de la division. Pour cette raison, on parle dans ce cas de mitoses fermées: les chromosomes qui se partagent ne quittent jamais le milieu intranucléaire. A contrario, lorsque l’enveloppe disparaît, laissant s’établir un contact direct entre les chromosomes, l’ébauche du fuseau et le milieu intracellulaire, comme on l’a vu précédemment (fig. 2), il s’agit de mitoses ouvertes).
– Croissance et division cellulaires: régulation et coordination .
Croissance et division cellulaires sont des événements distincts mais coordonnés, et leur régulation est un problème important de la biologie. D’une façon générale, lorsqu’une cellule entre en mitose, son volume a pratiquement doublé, cela en 10 à 20 heures chez la plupart des cellules de Mammifères. Pour une catégorie cellulaire donnée, les cellules qui entrent en mitose ont toutes sensiblement la même taille, alors que les cellules issues de mitose sont de tailles plus variées.
On montre que l’événement initial, à partir duquel se déclenchent successivement et dans l’ordre les phases S, G2 et M, se situe en fin de G1. Ce premier point de régulation du cycle de division est appelé start (départ) chez les levures et point de restriction chez les mammifères.
Chez les levures, le point «start» est déclenché par le produit du gène cdc 28 . Chez les cellules de mammifères, on considère que le point de restriction est atteint lorsqu’une protéine très labile, appelée protéine U (U = unstable ), se trouve à un certain degré de concentration dans la cellule. Ainsi, la durée de G1 est prolongée expérimentalement si les cellules se trouvent en milieu carencé ou en présence d’inhibiteurs de synthèse protéique, conditions qui ne permettent pas une accumulation suffisante de la protéine U.
La phase G1 est considérée comme celle où ont lieu la plupart des régulations de la croissance cellulaire, cela avant la réalisation du point start ou du point de restriction; pratiquement, toutes les cellules qui entrent en phase S ont déjà même volume.
Des interactions, dont l’origine est à l’étude, sont mises en évidence entre la croissance cellulaire et les événements chromosomiques du cycle (réplication, mitose). Ainsi, si on bloque la synthèse d’ADN en phase S, la croissance s’arrête peu après; si la croissance est bloquée en G1, par absence de synthèse protéique ou de facteurs de croissance dans le milieu, l’initiation de la réplication n’a pas lieu (cf. CROISSANCE [Biologie]).
D’autres facteurs interviennent dans la régulation du cycle.
Un certain nombre de produits, dont les concentrations varient selon les périodes du cycle, et qui peuvent eux-mêmes être à l’origine de réactions biochimiques, sont considérés comme jouant un rôle régulateur sans que l’on puisse toujours discerner s’il s’agit de phénomènes primaires ou secondairement induits. Sans entrer dans le détail, quelques-uns d’entre eux sont mentionnés ici.
Le calcium est considéré par de nombreux auteurs comme un facteur fondamental de régulation d’événements du cycle. Des variations du taux de calcium intracellulaire sont en effet observées selon les phases, voire, probablement, selon les régions d’une cellule. Le rôle joué par le calcium pour activer un large éventail de processus cellulaires est bien connu: activation d’enzymes, influence sur l’équilibre dynamique tubuline/microtubules, et rôle dans la polymérisation et la dépolymérisation des microtubules fusoriaux au cours de la mitose, par exemple.
La régulation du taux de calcium intracellulaire implique des interactions entre des constituants cellulaires variés: ainsi, les changements de perméabilité de la membrane plasmique observés au cours du cycle déterminent-ils une augmentation de pénétration du Ca2+ au cours de la phase S et de la mitose. Le taux de Ca2+ intracellulaire est par ailleurs régulé, grâce à une protéine cytoplasmique qui s’associe au Ca2+, la calmoduline, dont on a indiqué plus haut la présence dans le fuseau (fig. 10). Du Ca2+ est aussi stocké dans les cavités du réticulum endoplasmique ou dans les vésicules qui se trouvent dans la matrice du fuseau de division; il est alors déchargé, comme on l’a vu à propos de la cytodiérèse par exemple, en fonction des besoins et de stimuli localisés.
Des variations de concentration en nucléotides cycliques (cAMP, cGTP) sont observées au cours du cycle: la concentration en cAMP diminue nettement en phases S et M. Ces nucléotides sont formés de façon réversible à partir de l’AMP et du GTP grâce à l’activité d’enzymes: adénylate cyclases, guanylate cyclases, enzymes elles-mêmes activées par le Ca2+ tout comme la phosphodiestérase, qui intervient dans le métabolisme de ces nucléotides cycliques; là encore, la régulation de leur taux est en rapport avec la concentration en Ca2+ du milieu intracellulaire.
On réalise donc la complexité des mécanismes moléculaires et des régulations qu’implique un cycle cellulaire de division. Dès qu’elle est issue d’une mitose parentale et jusqu’au moment où elle se divise elle-même, une cellule réalise ce parcours difficile, dicté par son propre programme génétique et par les interactions qu’elle contracte avec son environnement. Peu d’erreurs sont tolérées sans qu’il en résulte des désordres importants. Ce parcours, dont nous n’apercevons encore que quelques segments, plus de 20 millions de cellules de notre organisme (sur les 100 000 milliards qu’il comporte) l’effectuent à chaque seconde de notre vie, pour maintenir constant le nombre de nos cellules et pour remplacer celles qui disparaissent par vieillissement ou par lésions accidentelles.
mitose [ mitoz ] n. f.
• 1887; gr. mitos « filament »
♦ Biol. Division de la cellule où chaque chromosome se dédouble (⇒ caryocinèse), de sorte que les deux cellules résultant de cette division possèdent, en nombre égal, les mêmes chromosomes que la cellule d'origine. Phases de la mitose : prophase, métaphase, anaphase, télophase. La première division de la méiose est une mitose. Inducteur de la mitose (⇒ mitogène) . — Adj. MITOTIQUE [ mitɔtik ], 1897 .
● mitose nom féminin (grec mitos, filament) Mode général, assez complexe, de division de la cellule, caractérisé par la duplication de tous ses éléments et par leur répartition égale dans les deux cellules filles. ● mitose (expressions) nom féminin (grec mitos, filament) Mitose équationnelle, seconde division de la méiose. Mitose réductionnelle, première division de la méiose. ● mitose (synonymes) nom féminin (grec mitos, filament) Mode général, assez complexe, de division de la cellule, caractérisé...
Synonymes :
- caryocinèse
mitose
n. f. BIOL Ensemble des phénomènes de transformation et de division des chromosomes aboutissant, à partir d'une cellule mère, à la formation de deux cellules filles ayant le même nombre de chromosomes.
Encycl. Précédée par l' interphase, pendant laquelle a lieu la duplication de la masse d'A.D.N., la mitose débute par la prophase: les chromosomes s'individualisent et se fissurent longitudinalement en deux chromatides. Ensuite, la métaphase commence par la formation du fuseau achromatique à partir des asters, puis les chromosomes se groupent dans le plan équatorial du fuseau. L' anaphase se caractérise par la scission totale des chromosomes fils et la migration des chromatides vers les extrémités du fuseau. La mitose s'achève par la télophase: les chromosomes perdent leur individualité, le fuseau disparaît et une membrane plasmique se forme, qui sépare les deux cellules filles identiques à la cellule mère. V. méiose.
⇒MITOSE, subst. fém.
BIOL. Mode de division le plus fréquent de la cellule vivante, au cours duquel le noyau se dédouble avant le corps cellulaire. Synon. caryocinèse. Mitose anormale; mitose simple, équationnelle, somatique. Un seul [noyau] grossit et subit ultérieurement les mitoses qui amènent la formation d'un jeune thalle (PLANTEFOL, Bot. et biol. végét., t.2, 1931, p.42). La division est dite indirecte lorsque le noyau se scinde après apparition des chromosomes. On décrit deux modes de division indirecte: — la mitose (...) est une division généralement équationnelle car elle aboutit à un partage égal des chromosomes du point de vue quantitatif et qualitatif dans chacune des deux cellules-filles. — La méiose (...) correspond à la succession de deux mitoses: la première étant réductionnelle, la seconde étant équationnelle (HUSSON, GRAF, Biol. gén., 1965, p.91).
REM. Mitogénétique, adj. ,,Qui provoque les mitoses`` (GARNIER-DEL 1972). Rayons mitogénétiques. Blondlot a décrit en 1903 sous le nom de rayons N des radiations provenant de diverses sources, en particulier des muscles et du tissu nerveux, et Gurwitsch, en 1923, sous le nom de r. mitogénétiques, d'autres radiations provenant aussi de tissus vivants. L'existence de ces deux dernières sortes de r. est très discutée (GARNIER-DEL 1972, s.v. rayon).
Prononc.: [mito:z]. Étymol. et Hist. 1893-94 (TESTUT, Traité d'anat. hum., t.3, p.1198). Terme sc. créé en all. par W.FLEMMING in Zellsubstanz, Kern- und Zelltheilung — 1882 — XXIV, 376 et att. en angl. dep. 1887 d'apr. NED Suppl.2, s.v. mitosis, à l'aide du gr. 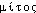 «fil» et d'un suff. -osis, corresp. au fr. -ose.
«fil» et d'un suff. -osis, corresp. au fr. -ose.
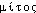 «fil» et d'un suff. -osis, corresp. au fr. -ose.
«fil» et d'un suff. -osis, corresp. au fr. -ose.DÉR. Mitotique, adj. Qui se rapporte à la mitose. Cycle mitotique; coefficient mitotique; activité, division mitotique. La division indirecte ou mitotique reste (...) le mode le plus frappant de la multiplication des cellules cancéreuses (ROUSSY ds Nouv. Traité Méd. fasc. 5, 2 1929, p.355). L'appareil mitotique, fait des asters et du fuseau, est généralement plus basophile que le reste du cytoplasme. On a pu (...) y déceler chimiquement de l'ARN et des protéines globuleuses (Hist. gén. sc., t.3, vol.2, 1964, p.622). Index mitotique. Taux des cellules en mitose dans un tissu donné (compté au millimètre carré ou pour cent cellules examinées). Il est souvent intéressant également de déterminer l'index mitotique, c'est-à-dire le nombre de mitoses dans une surface donnée (J. VERNE, Vie cellul., 1937, p.44). — [mitotik], [- -]. — 1re attest. 1897 (A. PRENANT, Compte rendu de HEIDENHAIN et COHN ds L'Année biol., p.33); de mitose, suff. -ique. A supplanté la forme mitosique 1897 (C.-B. DAVENPORT, Compte rendu de MEAD, ibid., p.36). L'angl. mitotic de même sens est att. dep. 1888 ds NED.
-]. — 1re attest. 1897 (A. PRENANT, Compte rendu de HEIDENHAIN et COHN ds L'Année biol., p.33); de mitose, suff. -ique. A supplanté la forme mitosique 1897 (C.-B. DAVENPORT, Compte rendu de MEAD, ibid., p.36). L'angl. mitotic de même sens est att. dep. 1888 ds NED.
 -]. — 1re attest. 1897 (A. PRENANT, Compte rendu de HEIDENHAIN et COHN ds L'Année biol., p.33); de mitose, suff. -ique. A supplanté la forme mitosique 1897 (C.-B. DAVENPORT, Compte rendu de MEAD, ibid., p.36). L'angl. mitotic de même sens est att. dep. 1888 ds NED.
-]. — 1re attest. 1897 (A. PRENANT, Compte rendu de HEIDENHAIN et COHN ds L'Année biol., p.33); de mitose, suff. -ique. A supplanté la forme mitosique 1897 (C.-B. DAVENPORT, Compte rendu de MEAD, ibid., p.36). L'angl. mitotic de même sens est att. dep. 1888 ds NED.BBG. — QUEM. DDL t.9 (s.v. mitotique).
mitose [mitoz] n. f.
ÉTYM. Fin XIXe; angl. mitose, Fleming, 1882, du grec mitos « filament ».
❖
♦ Biol. Division indirecte de la cellule dans laquelle chaque chromosome se dédouble (⇒ Caryocinèse), de sorte que les deux cellules résultant de cette division possèdent, en nombre égal, les mêmes chromosomes que la cellule d'origine. || Phases de la mitose : prophase, métaphase, anaphase, télophase. || Mitose équationnelle; mitose réductionnelle. ⇒ Méïose. || Agents inhibiteurs de la mitose. ⇒ Antimitotique.
0 La multiplication cellulaire se fait de la même façon chez l'homme que chez les animaux et les végétaux, grâce à de curieux mouvements du noyau, qui ont servi précisément à désigner ce mode de division indirecte, connu sous le nom de karyokinèse ou mitose.
Vallery-Radot, le Grand Mystère…, I.
❖
DÉR. Mitotique.
COMP. Amitose.
Encyclopédie Universelle. 2012.