POLONIUM
Le polonium (symbole Po, numéro atomique 84) est un élément radioactif découvert par Pierre et Marie Curie, en 1898, dans la pechblende de Joachimsthal. Ayant observé que la radioactivité des minerais d’uranium était supérieure à celle que l’on pouvait attendre d’après leur teneur, ils entreprirent des traitements chimiques sur la pechblende pour isoler les éléments inconnus, qui devaient être très radioactifs et présents seulement en quantités infimes. Très rapidement, ils constatèrent qu’une fraction de l’activité se concentrait dans les sulfures précipités en milieu acide et purent établir l’existence d’un nouvel élément, homologue du tellure, auquel ils donnèrent le nom de polonium, la Pologne étant la patrie d’origine de Marie Curie. Ce métal est le premier élément découvert par des méthodes radiochimiques.
Émetteur 見 pratiquement pur, le polonium a de nombreuses applications. Il a été utilisé comme source de rayonnement 見 par Irène et Frédéric Joliot-Curie dans les expériences qui ont conduit à la découverte de la radioactivité artificielle en 1934. Associé au béryllium [cf. BÉRYLLIUM], il constitue une source de neutrons produits par la réaction nucléaire:
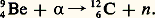
Les propriétés ionisantes de son rayonnement 見 sont mises à profit pour éliminer les charges électrostatiques qu’acquièrent les isolants, pour fabriquer des sondes utilisées dans les mesures de potentiels d’interface. Enfin, la chaleur dégagée par sa désintégration peut être transformée en électricité à basse tension.
Le polonium doit être manipulé avec beaucoup de précaution car il exerce sur l’organisme une action très toxique par son rayonnement 見. Ingéré ou inhalé, il se fixe sur la rate, les reins, le foie et dans les cellules du sang. La dose maximale de tolérance de 210Po dans le corps est de 4,5 憐 10 size=1漣12 g (0,02 microcurie).
Isotopes
L’isotope découvert par Pierre et Marie Curie est celui de masse 210 qui appartient à la famille radioactive naturelle uranium-radium [cf. URANIUM]. C’est le plus important; on le nomme radium F (RaF). Il se désintègre avec une période de 138,3 j par émission 見 en se transformant en plomb 206 (radium G) stable. Les particules 見 émises ont une énergie de 5,3 MeV, ce qui correspond à un parcours de 3,87 cm dans l’air à 15 0C, et à la pression normale, de 22 猪m dans l’aluminium et d’environ 27 猪m dans la gélatine des plaques photographiques. Le nombre de paires d’ions créées dans l’air le long du parcours de chaque particule est égal à 152 000. Le rayonnement 見 de 210Po est accompagné d’un rayonnement 塚 de très faible intensité (1,25 quantum de 0,8 MeV pour 105 désintégrations).
Un curie (Ci) de 210Po (3,7 憐 1010 désintégrations . s size=1漣1) correspond à 222,2 猪g d’élément. Le débit de chaleur équivalent est de 113,865 joules par heure, soit 0,032 watt. Marie Curie et André Debierne ont effectué une détermination directe du nombre d’Avogadro en mesurant le volume d’hélium correspondant à un nombre connu de particules 見 (noyau de l’atome d’hélium) émises par une source de 210Po.
Actuellement, vingt-sept isotopes ont été identifiés et tous sont radioactifs. Leurs nombres de masse varient de 192 à 218. Parmi ces isotopes, sept existent dans la nature comme produits de filiation du thorium ou de l’uranium (cf. tableau).
Les autres isotopes ont été synthétisés essentiellement en bombardant du bismuth ou du plomb par des neutrons ou des hélions accélérés, ou encore par réactions d’ions lourds sur des cibles plus légères:
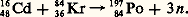
La première production artificielle de polonium a été réalisée en 1936 par Livingood, en irradiant du bismuth avec des deutons d’une énergie de 5,4 MeV:

Les périodes de 208Po, 2,93 ans, et de 209Po, 103 ans, sont les plus longues. Les isotopes 195, 197, 199, 201, 203, 211, 212 ont des isomères.
État naturel et préparation
Le polonium 210 est présent dans les minerais uranifères en équilibre radioactif à la concentration de 7,6 憐 10 size=1漣11 g/g d’uranium. Son abondance dans l’écorce terrestre peut donc être évaluée à environ 10 size=1漣13 p. 100. Sa période est assez longue pour que des traces puissent être extraites directement des minerais d’uranium, mais le traitement de ces derniers est très laborieux en raison de leur très faible teneur (environ 0,05 mg de 210Po par tonne de pechblende de Joachimsthal). Aussi les sources naturelles de 210Po que l’on traite habituellement sont-elles soit le radio-plomb, plomb contenant en très faible proportion du radium D (210Pb), qui est un sous-produit du traitement des minerais uranifères, soit le radium D récupéré par lavage de vieilles ampoules de radon [cf. URANIUM]. Le radium D, dont la période est de 21 ans, produit par désintégration le RaE et le RaF; on peut donc extraire le 210Po accumulé dans ses solutions. Le procédé le plus simple consiste à effectuer un dépôt spontané sur une lame d’argent en milieu faiblement chlorhydrique, nitrique ou acétique. Le dépôt est pratiquement exempt de RaD et de RaE. En revanche, ce dernier élément accompagne le polonium si le dépôt est réalisé sur nickel. Le polonium déposé sur support d’argent peut ensuite être isolé par dissolution dans l’acide nitrique de la lame et précipitation de l’argent à l’état de chlorure par addition d’acide chlorhydrique. Les quantités de polonium extraites des sources naturelles n’ont généralement pas excédé quelques centaines de millicuries.
Actuellement, des quantités pondérables (échelle du mg) sont synthétisées à partir du bismuth que l’on soumet au flux neutronique intense d’un réacteur nucléaire. Le polonium 210 est formé suivant le processus:

la section efficace de la capture des neutrons thermiques étant de 0,020 憐 10 size=1漣24 cm2 pour le bismuth. La séparation polonium-bismuth peut être réalisée en distillant directement le polonium par chauffage du bismuth irradié entre 750 et 850 0C. Il est possible également d’effectuer un traitement par voie aqueuse, qui consiste essentiellement, après avoir porté le bismuth irradié en solution chlorhydrique, à augmenter le rapport Po/Bi par dépôt spontané sur une quantité de bismuth moindre. Cette opération est répétée et on isole finalement le polonium soit par volatilisation, soit en le précipitant de ses solutions chlorhydriques acides par réduction avec le chlorure stanneux.
Le métal très pur a été préparé à l’échelle du milligramme par décomposition du monosulfure PoS à 275 0C, sous pression très réduite, et volatilisation du polonium entre 450 0C et 500 0C. On obtient également le métal par dépôt spontané en milieu faiblement chlorhydrique, nitrique ou acétique sur des lames d’argent, de nickel ou de métaux moins nobles. La densité des sources ainsi préparées peut atteindre 2 à 4 millicuries par millimètre carré. Le métal est encore obtenu par électrolyse sur cathode en milieu acide ou alcalin et par réduction en milieu chlorhydrique avec le chlorure stanneux ou en solution alcaline avec l’hydrazine ou l’hydroxylamine. Le potentiel normal du couple Po/PoIV en solution nitrique est évalué à E0 = + 0,77 volt. Le polonium est donc un métal noble qui se situe entre le tellure et l’argent dans la série des potentiels normaux.
Propriétés physico-chimiques
L’isotope 210 a servi à déterminer la plupart des propriétés physico-chimiques du polonium. Pendant longtemps, les recherches n’ont pu être effectuées que sur des quantités impondérables (de l’ordre de 10 size=1漣11 à 10 size=1漣6 g) selon les méthodes radiochimiques. Depuis que l’on produit artificiellement 210Po par irradiation du bismuth, des expériences à l’échelle du milligramme sont possibles. Mais l’activité spécifique de 210Po étant de 4 500 Ci/g, l’interprétation des résultats est parfois très délicate en raison des perturbations dues aux effets radiolytiques du rayonnement 見: échauffement, ionisation de l’air avec formation d’ozone, décomposition de l’eau et production de radicaux, d’hydrogène, d’eau oxygénée, destruction plus ou moins rapide des composés organiques, coloration, luminescence, déplacement d’atomes dans les composés solides, etc. C’est pourquoi l’isotope 208 et plus encore l’isotope 209, dont les périodes sont relativement longues, seraient d’un grand intérêt pour les recherches chimiques s’ils pouvaient être produits en quantités pondérables. L’activité spécifique de 209Po est seulement de 8 Ci/g, donc 600 fois moindre que celle de 210Po.
Propriétés physiques
Le polonium est un métal mou, coloré en gris-argent, devenant rouge ou jaune en couches très minces. Deux variétés cristallines ont été identifiées aux rayons X. La forme 見, stable à la température ordinaire, est cubique: densité 9,196 à 36 0C, rayon atomique 0,169 nm. Vers 36 0C, apparaît la forme 廓, de structure rhomboédrique: densité 9,398 à 39 0C. Le point de fusion (en couche mince) est de 254 0C; la température d’ébullition est évaluée à 962 0C.
Déposé en quantités impondérables, le polonium se vaporise à des températures assez basses, dépendant de la nature du support. Dans le vide, la vitesse de vaporisation du polonium sur le nickel est mesurable dès 108 0C; après un chauffage de 5 min à 350 0C, 90 p. 100 de la quantité déposée sont enlevés. Sur le platine, la vaporisation commence vers 350 0C, à une température un peu plus basse sur l’or et seulement entre 500 et 560 0C sur le palladium. La température de vaporisation croît avec le vieillissement du dépôt; elle varie avec le mode de préparation de la source et également avec la nature de l’atmosphère gazeuse dans laquelle la vaporisation a lieu. Des sources très pures, de grandes densités d’activité, peuvent être obtenues en volatilisant dans un tube de quartz (vers 1 000 0C) le polonium déposé sur un support métallique (Ni, Pt, Pd, Ag). Les vapeurs sont entraînées par un courant d’azote ou d’argon et condensées sur une surface froide, qui peut être une surface métallique ou un film en matière plastique. Le coefficient de diffusion du polonium à la température ordinaire dans les métaux Al, Fe, Ni, Cu, Ag, Au et Pb est inférieur à 10 size=1漣14 cm2/j.
Plus d’une centaine de raies ont été identifiées dans le spectre visible et ultra-violet; les raies les plus intenses sont de 245,0 nm, 255,8 nm, 300,3 nm, 417,0 nm et 449,3 nm. Le potentiel d’ionisation de l’atome neutre de polonium est estimé à 8,43 eV.
Propriétés chimiques
Conformément à sa structure électronique: couches K, L, M, N complètes, 5s 2, 5p 6, 5d 10, 6s 2, 6p 4, le polonium est situé dans le groupe VI b de la classification périodique; il est l’homologue supérieur du tellure et le voisin du bismuth [cf. BISMUTH]. Aussi partage-t-il un certain nombre de propriétés avec ces deux éléments.
À l’air et à la température ordinaire, le métal se recouvre lentement d’une pellicule jaune d’oxyde. Par réaction avec le chlore et le brome, il forme les tétrahalogénures. Il se dissout dans HCl 2N en formant PoCl2 qui colore la solution en rouge, puis PoII s’oxyde en PoIV et la solution devient jaune. Le métal est attaqué rapidement par l’acide nitrique concentré, mais difficilement par l’acide dilué, par suite de la très faible solubilité de son nitrate, qui est seulement de 1,9 憐 10 size=1漣5 mole/l dans H3 0,1 N. Avec l’acide sulfurique fumant le métal forme un composé rouge, probablement PoS3, très instable et qui se décompose en donnant le monoxyde PoO noir.
La valence la plus stable du polonium en solution aqueuse est IV; ses autres valences sont VI, II, – II. L’existence de la valence III très instable est possible.
Composés
En milieu faiblement acide, neutre ou faiblement alcalin, les sels de polonium sont hydrolysés avec formation de sels basiques et d’un hydroxyde insoluble dans l’eau. Ainsi, avec l’augmentation du pH, apparaissent successivement les formes Po4+, Po2+ et PoO(OH)2. Même en quantités impondérables, le polonium est à l’état colloïdal dans les solutions voisines de la neutralité et peut être aisément centrifugé. L’hydroxyde est amphotère et se dissout dans les solutions concentrées de soude ou de potasse à l’état de polonites Na2Po3 ou K2Po3 analogues aux tellurites. Le polonium IV a une tendance marquée à former des complexes avec les anions: sa coordinence est 6. Les hexachloropolinites et hexabromopolinites alcalins M2PoCl6 et M2PoBr6 sont isomorphes des composés correspondants du tellure.
Le polonium est réduit en milieu acide par l’anhydride sulfureux S2 ou l’hydrazine à l’état bivalent instable. La réduction à l’état métallique est obtenue avec des réducteurs plus énergiques tels que le chlorure stanneux, le chlorure titaneux ou l’acide hypophosphoreux en solution chlorhydrique et l’hydrazine en solution alcaline.
En solution faiblement chlorhydrique, PoIV est réduit par l’hydrogène sulfuré et forme le monosulfure PoS noir, insoluble dans le sulfure d’ammonium. Le pyrogallol agit également comme réducteur, et le polonium est insolubilisé à l’état de pyrogallate de PoII. Lors des réductions de PoIV à PoII, le passage par un état trivalent très peu stable n’est pas exclu.
On a préparé un hydrure, PoH2, très volatil et divers poloniures qui indiquent l’existence de l’anion Po2 size=1漣.
L’oxydation du polonium à la valence VI par le bichromate ou les sels cériques a été observée à l’échelle des indicateurs, mais les tentatives à l’échelle pondérable ont échoué, très probablement par suite de l’action réductrice produite par le rayonnement 見 intense. Le potentiel normal du couple PoIV/PoVI dans HCl 6N est égal à + 1,5 volt environ. Un peroxyde Po3 très pur serait formé par dépôt anodique sur or en milieu non réducteur (nitrique, sulfurique, acétique ou sodique).
Les séparations du polonium d’avec ses homologues et ses voisins peuvent être réalisées par échange sur résines et extraction par solvants. En solution chlorhydrique, nitrique ou même sulfurique, PoIV peut être extrait par des solvants oxygénés comme l’éther isopropylique, la méthylisobutylcétone (hexone) ou le phosphate tributylique. La présence d’oxydants forts (bichromate, sels cériques) inhibe l’extraction par l’hexone. Par ailleurs, le polonium forme des chélates avec l’acétylacétone, la dithizone, le cupferron ou la thénoyltrifluoroacétone qui sont extractibles par des solvants non polaires.
Les structures de nombreux composés, préparés par voie humide ou par voie sèche, ont été établies. Certains sont très volatils dès la température ordinaire, notamment l’hydrure déjà cité, le polonium-diméthyle et le polonium-carbonyle.
Le dosage du polonium s’effectue par les méthodes radiométriques. Des mesures calorimétriques sont possibles sur des quantités de 210Po atteignant ou dépassant 100 millicuries.
polonium [ pɔlɔnjɔm ] n. m.
• 1898; de Pologne, pays d'origine de Marie Curie
♦ Chim., phys. Élément atomique (Po; no at. 84; m. at. [27 isotopes] 192 à 218) dont tous les isotopes sont radioactifs. Le polonium, produit de désintégration du radium.
● polonium nom masculin (de Polonia, Pologne, pays d'origine de Marie Curie) Première substance radioactive découverte par Pierre et Marie Curie (1898) dans la pechblende. (Élément chimique de symbole Po.) [On connaît 27 isotopes, tous radioactifs, dont les nombres de masse varient entre 192 et 218.]
polonium
n. m. CHIM élément radioactif (symbole Po) de numéro atomique Z = 84.
⇒POLONIUM, subst. masc.
PHYS. NUCL. Élément radioactif (symbole Po, poids atomique 210, n° atomique 84), proche chimiquement du bismuth, qui se décompose en émettant des particules alpha. Les Curie furent rapidement convaincus qu'ils se trouvaient en présence de quantités infimes d'éléments nouveaux, émetteurs de rayonnements beaucoup plus puissants que l'uranium. Avant la fin de l'année 1898, ils décelèrent, sans l'isoler, un premier élément inconnu qu'ils nommèrent le polonium, et un deuxième, le radium (GOLDSCHMIDT, Avent. atom., 1962, p. 14).
Prononc. et Orth. :[ ]. Att. ds Ac. 1935. Étymol. et Hist. 1898 (M. et Mme CURIE, Sur une substance nouvelle radioactive contenue dans la pechblende ds C. r. de l'Ac. des Sc., t. 127, p. 177 : Si l'existence de ce nouveau métal se confirme, nous proposons de l'appeler polonium, du nom du pays d'origine de l'un de nous). Dér. de Polonia, forme latinisée de Pologne, nom du pays d'origine de Mme Curie.
]. Att. ds Ac. 1935. Étymol. et Hist. 1898 (M. et Mme CURIE, Sur une substance nouvelle radioactive contenue dans la pechblende ds C. r. de l'Ac. des Sc., t. 127, p. 177 : Si l'existence de ce nouveau métal se confirme, nous proposons de l'appeler polonium, du nom du pays d'origine de l'un de nous). Dér. de Polonia, forme latinisée de Pologne, nom du pays d'origine de Mme Curie.
 ]. Att. ds Ac. 1935. Étymol. et Hist. 1898 (M. et Mme CURIE, Sur une substance nouvelle radioactive contenue dans la pechblende ds C. r. de l'Ac. des Sc., t. 127, p. 177 : Si l'existence de ce nouveau métal se confirme, nous proposons de l'appeler polonium, du nom du pays d'origine de l'un de nous). Dér. de Polonia, forme latinisée de Pologne, nom du pays d'origine de Mme Curie.
]. Att. ds Ac. 1935. Étymol. et Hist. 1898 (M. et Mme CURIE, Sur une substance nouvelle radioactive contenue dans la pechblende ds C. r. de l'Ac. des Sc., t. 127, p. 177 : Si l'existence de ce nouveau métal se confirme, nous proposons de l'appeler polonium, du nom du pays d'origine de l'un de nous). Dér. de Polonia, forme latinisée de Pologne, nom du pays d'origine de Mme Curie.
polonium [pɔlɔnjɔm] n. m.
ÉTYM. 1898; du rad. de Pologne, pays d'origine de Marie Curie, qui, avec Pierre Curie, découvrit cet élément.
❖
♦ Élément radioactif (symb. Po; p. at. 210; no at. 84). || Dans la série du radium, le polonium est identique au radium F de période de 140 jours; par expulsion d'un hélion, il donne le radium G, qui est le plomb stable.
0 Les réactions nucléaires que nous avons envisagées pour l'émission des électrons positifs du bore et de l'aluminium, ont reçu une confirmation dans nos dernières expériences (…)
On irradie une feuille d'aluminium sur une forte source de polonium pendant quelques minutes; quand on retire la feuille elle présente une activité qui décroît de moitié en 3 min. 15 secondes et le rayonnement émis, que l'on peut observer avec un compteur ou l'appareil Wilson, est constitué de positrons.
Encyclopédie Universelle. 2012.