ACTINIUM
L’existence dans la pechblende de l’actinium, élément radioactif de numéro atomique 89, fut établie en 1899 par André Louis Debierne, collaborateur de Pierre et Marie Curie qui venaient, un an auparavant, de découvrir, dans ce minerai d’uranium, le polonium et le radium. Son poids n’ayant pu être déterminé, ce n’est qu’une dizaine d’années après sa découverte, lorsque la théorie des transformations radioactives de Rutherford et Soddy et la loi des déplacements radioactifs de Soddy et Fajans furent établies, que l’actinium a pu être définitivement classé dans le système périodique comme homologue du lanthane. Le symbole chimique de cet élément est Ac.
On connaît dix-neuf isotopes de l’actinium dont les nombres de masse varient de 209 à 231. Ils sont tous radioactifs. Ceux de masse 227 et 228 existent dans la nature. L’actinium 227, qui est l’isotope découvert par A. L. Debierne, est celui dont la vie est la plus longue (période: 21,7 ans). C’est un produit de filiation de 235U. Le rapport en poids entre l’actinium et l’uranium naturel est égal à 2 練 10-10. Son abondance dans l’écorce terrestre peut être évaluée à 8 練 10-16. Cet isotope est le seul qui puisse être obtenu en quantités pondérables. Son extraction des minerais d’uranium n’a toutefois pas permis d’isoler un produit pur car il reste associé, au cours des traitements, aux terres rares qui sont toujours abondamment présentes et auxquelles l’actinium ressemble beaucoup chimiquement. Ces difficultés sont évitées en synthétisant 227Ac par transmutation du radium sous l’action des neutrons au sein d’un réacteur nucléaire. L’actinium est produit suivant la réaction:

Des quantités macroscopiques ont été ainsi formées et isolées à l’état pur.
Le deuxième isotope naturel, 228Ac appelé mésothorium 2, de 6,13 h de période, a été découvert par Otto Hahn en 1908. Produit de filiation du thorium, il est extrait de sa substance mère, le mésothorium 1 (228Ra).
Parmi les autres isotopes, 225Ac offre un intérêt particulier en raison de sa période de 10 jours. Présent seulement en quantités difficilement décelables dans la nature, il est obtenu artificiellement, notamment comme produit de filiation de 233Th, formé en bombardant le thorium avec des neutrons.
L’actinium métallique ne peut, par suite de son électropositivité élevée, être obtenu par électrolyse de solutions aqueuses. Il a été préparé à l’échelle du milligramme par réduction du fluorure Ac3 par la vapeur de lithium sous vide à une température comprise entre 1 100 et 1 275 0C. Le métal est blanc argent et émet spontanément une faible lumière de teinte bleutée, visible dans l’obscurité, due à sa radioactivité. Il cristallise dans le système cubique à faces centrées. Son point de fusion qui est un peu plus élevé que celui du lanthane est 1 050 梁 50 0C. Le point d’ébullition est estimé à environ 3 300 0C. L’actinium forme aisément un amalgame, par exemple par action d’un amalgame de lithium sur une solution citrique de l’élément (pH: de 1,7 à 6,8).
Par ses propriétés chimiques, l’actinium est un élément trivalent qui s’apparente étroitement à son homologue inférieur, le lanthane. Le rayon de l’ion Ac3+ est égal à 0,111 nm, tandis que celui de La3+ est de 0,104 nm. La structure électronique de l’actinium est bien celle que l’on doit attendre pour un homologue du lanthane: couches K, L, M, N complètes 5s 2 5p 6 5d 10 6s 2 6p 6 6d 7s 2. Ainsi l’actinium se comporte d’ordinaire, dans les opérations chimiques, comme un élément encore plus basique que le lanthane, qui est l’élément le plus basique du groupe des lanthanides. Les composés insolubles d’actinium correspondent aux composés insolubles de lanthane: hydroxyde, fluorure, carbonate, oxalate, phosphate, sulfate double de potassium. À l’exception du sulfure, qui est noir, les composés d’actinium sont blancs. Tous ceux dont la structure a pu être identifiée sont isomorphes des composés correspondants du lanthane.
Bien que l’actinium 227 n’émette qu’un rayonnement 廓 de très faible énergie (Emax = 46 KeV) et un rayonnement 見 très peu intense (1,2 見 pour 100 désintégrations), l’activité 見, 廓, 塚 des préparations de 227Ac croît rapidement du fait de l’accumulation de ses descendants, avec lesquels il est en équilibre en cinq à six mois. Aussi les manipulations de ce radioélément exigent de grandes précautions. Ses propriétés radioactives et son métabolisme le classent parmi les éléments dont la radiotoxicité est la plus élevée. La dose permise pour un être humain est seulement de 1 110 becquerels (soit 0,4 練 10-6 mg).
Dans les laboratoires, l’actinium 227 sert à produire le radioactinium (227Th), l’actinium X(223Ra), l’actinon (219Rn) et son dépôt actif, radionucléides dont il est la substance mère.
Pour les études radiochimiques on préfère souvent à 227Ac, l’isotope 228Ac, émetteur 廓, 塚, dont le dosage est plus aisé. L’isotope 225Ac, émetteur 見, conviendrait bien également pour de telles études.
actinium [ aktinjɔm ] n. m.
• 1881; du gr. aktis, aktinos « rayon »
♦ Élément radioactif (Ac; n° at. 89), de la famille des actinides.
● actinium nom masculin Élément radioactif (symbole : Ac), de nombre atomique 89, découvert en 1899 par Debierne. ● actinium (expressions) nom masculin Série de l'actinium, ensemble des noyaux résultant de la désintégration de l'uranium 235.
actinium
n. m. CHIM élément radioactif (Ac), de numéro atomique Z = 89, et de masse atomique 227.
— Métal (Ac) dont les propriétés sont proches de celles du lanthane.
⇒ACTINIUM, subst. masc.
CHIM. Corps simple, fortement émetteur de radiations, chef de file d'une des quatre familles radioactives naturelles. Symbole chim. Ac. :
• 1. ... et, en 1900, M. Debierne a annoncé l'existence d'un nouvel élément, l'actinium, sur lequel on a jusqu'ici peu de renseignements.
Le Journal du radium, janv. 1904, p. 9.
• 2. Les corps radioactifs actuellement connus se groupent autour des quatre éléments : uranium, thorium, radium, actinium, dont ils dérivent; ...
Journal de chimie et de physique, 1909, p. 258.
• 3. Les boues radio-actives (...), qui renferment des traces de radium, de polonium et d'actinium ont été utilisées en application prolongée sur les articulations malades ...
HUDEL ds (F. Widal, P.-J. Teissier, G.-H. Roger, Nouveau traité de médecine, fasc. 1, 1920-1924, p. 567).
Prononc. :[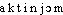 ].
].
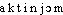 ].
].Étymol. ET HIST. — 1881 chim. « élément radio-actif » (Année sc. et industr., 167 ds QUEM. t. 1 1950 : Il résulte de certaines expériences faites par M. Phipson qu'il doit exister dans le zinc du commerce un nouvel élément métallique auquel l'auteur propose de donner le nom d'actinium à cause du curieux phénomène qu'il appelle l'actinite).
BBG. — BÉL. 1957. — CHARLES 1960. — Électron. 1963-64. — GALIANA Déc. Sc. 1968. — GRAND. 1962. — LAITIER 1969. — MUSSET-LLORET 1964. — Nucl. 1964. — PAMART (P.). De l'alchimie à la chimie. Vie Lang. 1969, n° 204, p. 142. — Sc. 1962. — UV.-CHAPMAN 1956.
actinium [aktinjɔm] n. m.
ÉTYM. 1881; mais le corps a été isolé en 1899-1900, Debierne; du grec aktis, aktinos « rayon ». → Actin-.
❖
♦ Didact. (chim.). Corps simple (Ac) radioactif trouvé dans la pechblende (no at. 89). || Actinium 227, actinium 228 (isotopes naturels).
❖
DÉR. et COMP. Protactinium. V. Actinon.
Encyclopédie Universelle. 2012.
 , -
, - (actin-,
(actin-,