URANIUM
L’uranium (symbole U, numéro atomique 92) est un élément chimique métallique très dense (d = 19), dur, dont la couleur grise rappelle celle du nickel. Pendant les cent cinquante ans qui suivirent sa découverte, en 1789, par Martin Heinrich Klaproth, on lui trouva peu d’applications – essentiellement la fabrication d’émaux –, et il fut étudié principalement parce qu’il était le plus lourd (poids atomique 238,02) des éléments connus. Eugène Melchior Péligot montra, en 1841, que la substance isolée par Klaproth était en réalité l’oxyde U2 et prépara l’uranium métallique par réduction du tétrachlorure UCl4 à l’aide de potassium. En 1938, Otto Hahn et Fritz Strassmann découvrirent que le noyau d’uranium bombardé par un flux de neutrons éclatait en noyaux plus légers comme ceux de baryum (Z = 56) et de krypton (Z = 36) en libérant une énergie considérable. La découverte de ce phénomène appelé fission (cf. chimie NUCLÉAIRE) fut à l’origine des recherches les plus intenses jamais effectuées sur un élément chimique. En 1939, Enrico Fermi, puis Leo Szilard, Herbert Lawrence Anderson et Frédéric Joliot montrèrent que ce processus pouvait s’effectuer de façon continue par l’intermédiaire d’une réaction en chaîne (cf. industrie NUCLÉAIRE). Il fut démontré aussi que seul l’isotope 235 était fissile. La première réaction nucléaire en chaîne fut mise en œuvre le 2 décembre 1942 à l’université de Chicago. Les applications militaires suivirent très rapidement: explosion d’Hiroshima le 6 août 1945, puis développement par les grandes puissances d’un arsenal nucléaire considérable.
L’utilisation de la fission pour la production d’énergie a connu des débuts difficiles: après des prévisions optimistes, il a fallu surmonter de nombreux obstacles pour mettre au point les centrales nucléaires. De plus, d’importantes ressources de combustibles classiques sont apparues. Enfin, les prévisions des besoins en énergie électrique ont été à plusieurs reprises revues à la baisse et il en a été de même pour les prévisions des besoins en uranium.
En 1994, d’après le rapport de l’Agence internationale de l’énergie atomique, l’électricité d’origine nucléaire a représenté 18 p. 100 de la production totale d’électricité (75 p. 100 en France); la consommation d’uranium des réacteurs a été de 60 000 tonnes alors que la production des mines se situait aux alentours de 32 000 tonnes.
En 2000-2005, la part du nucléaire dans la production d’électricité pourrait être retombée aux environs de 15 p. 100, compte tenu des accroissements considérables attendus pour les productions d’électricité à partir de combustibles fossiles.
1. Géochimie, métallurgie extractive
L’uranium a quatre valences possibles, les valences 4 et 6 étant les plus répandues dans les minerais. Les conditions de passage de la valence 4 à la valence 6 dépendent du potentiel d’oxydoréduction du milieu; elles sont voisines des conditions de passage du fer ferreux au fer ferrique. L’uranium hexavalent est beaucoup plus soluble que l’uranium tétravalent; il forme des complexes, les plus fréquents étant les uranylcarbonates et les uranylsulfates.
Distribution géochimique de l’uranium
Dans la lithosphère, la teneur moyenne en uranium est de 3 à 4 parties par million (p.p.m.), mais l’éventail est très large selon les matériaux.
En dehors des minéraux d’uranium proprement dits (tabl. 1), l’uranium se rencontre dans les minéraux majeurs ou accessoires sous forme d’inclusions ou d’additions isomorphiques, avec des teneurs en uranium de l’ordre de la fraction à la dizaine de p.p.m. pour les minéraux majeurs, et de l’ordre de la dizaine à la dizaine de milliers de p.p.m. pour les minéraux accessoires.
C’est dans les roches ignées acides (cf. roches MAGMATIQUES) que les teneurs en p.p.m. d’uranium sont les plus élevées: de 1 à 6 dans les granites et les syénites, de 2 à 7 dans les rhyolites et les trachytes, de 0,2 à 2 dans les gabbros et les diorites, de 0,2 à 4 dans les basaltes et les andésites, de 0,001 à 0,03 dans les roches ultrabasiques, de 0,1 à 30 dans les roches alcalines.
L’altération des sources primaires d’uranium a pour effet de le libérer sous forme hexavalente stable en solution aqueuse. Après un déplacement plus ou moins grand, il est susceptible de se déposer syngénétiquement avec certains sédiments et de se fixer épigénétiquement sous des formes qui dépendent des conditions chimiques du milieu, dans tous les types de roches, y compris les formations sédimentaires non consolidées. Les teneurs en p.p.m. d’uranium y sont de l’ordre de 1 à 13 pour les schistes, de 1 à 80 dans les schistes carburés, de 3 à 27 dans les bauxites, de 0,1 à 9 dans les carbonates, de 1 à 350 dans les phosphates.
Les sols constituent un matériau fixateur important. Leur teneur en uranium correspond généralement à un enrichissement épigénétique en provenance du substratum.
Les teneurs des eaux continentales varient selon la nature du substratum. Elles se situent entre 0,1 et 10 parties par milliard, l’uranium étant sous forme de complexes dont la nature chimique dépend du pH.
La teneur moyenne des eaux de mer est de l’ordre de 3 憐 10-3 p.p.m., certains sédiments marins d’estuaire atteignant 60 p.p.m.
Prospection de l’uranium
On estime que les concentrations d’uranium, pour être exploitables, doivent avoir des teneurs se situant autour de 2 p. 1 000. Dans certains cas, lorsque l’uranium coexiste avec un autre métal (en Afrique du Sud, par exemple, où or et uranium sont exploités sensiblement dans les mêmes formations), la teneur limite peut être beaucoup plus basse. Les teneurs sont donc bien plus faibles que celles qui sont exigées pour l’exploitation des métaux usuels – plomb, zinc, cuivre –, qui sont de quelques unités pour cent.
La prospection de l’uranium, comme toute prospection de métaux, nécessite des études géologiques: pétrographie, stratigraphie, sédimentologie, paléogéographie, études structurales sont mises à contribution [cf. GISEMENTS MÉTALLIFÈRES]. Ces études sont complétées et facilitées par la géophysique, l’émanométrie et la prospection géochimique.
Les techniques diverses de la géophysique groupent la mesure de la résistivité des roches, qui permet de repérer failles et filons, et parfois les mesures sismiques. Mais la méthode géophysique de choix pour la détection des gisements d’uranium est la radiométrie, qui consiste à déceler avec des tubes Geiger-Müller ou des scintillomètres le rayonnement 塚 émis par les descendants de l’uranium qui existent dans tout minerai uranifère. La radiométrie peut se faire à pied, en prospection autoportée, aéroportée ou héliportée. Dans le cas de prospection aéroportée, une caméra à défilement continu, synchronisée avec l’enregistrement des anomalies, permet de mieux les localiser. La radiométrie est d’ailleurs utilisée non seulement en prospection mais aussi lorsqu’il s’agit de délimiter, d’évaluer un gisement, de guider son exploitation et de calculer sa production.
L’émanométrie consiste à étudier les concentrations de radon dans le sol par mesure du rayonnement 見 qu’il émet. Cette technique est particulièrement utile dans le cas de gisements aveugles, non décelables par radiométrie classique.
La prospection géochimique , grâce à l’étude de la teneur des eaux, des sols ou des alluvions, permet de circonscrire des zones d’intérêt, puis de remonter au gisement.
Répartition géographique des gisements
Les réserves officielles en décembre 1983 figurent sur le tableau 2. Elles sont classées par rapport à deux coûts de production: coût inférieur à 80 dollars par kilogramme d’uranium et coût compris entre 80 et 130 dollars par kilogramme.
Dans chaque gamme, on distingue les réserves assurées et les réserves supplémentaires estimées qui correspondent à une extrapolation des gisements connus.
Les réserves de coût inférieur à 130 dollars par kilogramme d’uranium seraient au total de plus de 3 millions de tonnes. Plus de 80 p. 100 de ces réserves se trouvent dans des gisements stratiformes.
L’Australie, qui détient 22 p. 100 de ces réserves dans la partie nord du Territoire du Nord et du Queensland, occupe un rang beaucoup plus modeste en production cumulée, les exploitations importantes n’ayant démarré que récemment.
Les États-Unis viennent au deuxième rang des réserves avec 15 p. 100, mais au premier en production cumulée. Les principaux gisements se trouvent dans des formations sédimentaires du Wyoming, du Colorado ou du Nouveau-Mexique. Une proportion importante de la production se fait à ciel ouvert.
Au Canada, les réserves les plus riches – teneurs de plusieurs pour-cent dans les minerais – se trouvent dans le nord du Saskatchewan. Il existe aussi des réserves importantes, mais à teneurs beaucoup plus basses, dans la région de Blind River (Ontario). Le Canada est, en production cumulée, au deuxième rang.
En Afrique du Sud, deux types de gisements existent: d’une part, les formations aurifères du Rand, qui renferment aussi de l’uranium à très basse teneur, quelques unités pour dix mille (ils ont longtemps constitué la seule ressource et représentent encore les deux tiers des réserves déclarées, mais ils ne peuvent être exploités indépendamment de l’or), et, d’autre part, des gisements liés à des roches intrusives du Sud-Ouest africain, à teneurs très basses également.
Au Niger, les gisements sont situés dans les formations sédimentaires continentales provenant de la désintégration du massif granitique de l’Aïr.
La France, qui ne détient que 3 p. 100 des réserves, est au quatrième rang des producteurs. Les deux tiers des réserves se situent dans des filons intragranitiques, le tiers dans des formations sédimentaires (Hérault et nord de l’Aquitaine).
Aucune exploitation n’est prévue dans un avenir rapproché par le Brésil, qui déclare pourtant des réserves importantes.
Traitement des minerais
Les minerais produits par les exploitations minières ont des teneurs particulièrement basses: de quelques unités pour dix mille à quelques unités pour mille d’uranium. Ils sont donc difficilement transportables dans des conditions économiques sur de grandes distances. À partir de ces minerais, il faut élaborer soit le métal, soit des sels au degré de pureté dit nucléaire, exigés pour l’alimentation des réacteurs. Le passage se fait en deux phases: traitement chimique des minerais, puis fabrication du métal.
Traitement chimique des minerais
Après l’échec des procédés de traitement appliqués classiquement aux minerais de base – gravimétrie et flottation –, le traitement chimique des minerais (fig. 1) s’est imposé partout dans le monde. Ce traitement aboutit à un concentré intermédiaire qui peut titrer de 600 à 700 kilogrammes d’uranium par tonne lorsqu’il s’agit d’un uranate de magnésie, ou de 400 kilogrammes par tonne lorsqu’il s’agit de nitrate d’uranyle; l’effet de concentration se situe donc entre 100 et 2 000 suivant la teneur des minerais, et en moyenne autour de 300.
Les usines sont placées au plus près des mines pour éviter des frais de transport prohibitifs.
Le procédé d’attaque à l’acide sulfurique , de loin le plus répandu, comporte les phases suivantes:
– Concassage et broyage , qui se font avec addition d’eau et selon un schéma tout à fait classique. À chaque stade des circuits, on s’attache à éviter une surcharge des appareils par les produits dont la granulométrie est suffisamment fine. Le broyage aboutit à une pulpe constituée de produits de 450 micromètres environ.
– Attaque après épaississage, pour réduire les consommations de réactifs, et incorporation d’un oxydant (chlorate de sodium) à raison de 1 à 2 kilogrammes par tonne; la pulpe est attaquée pendant quatre à six heures à 60-70 0C par l’acide sulfurique à raison de 30 à 50 kilogrammes d’acide par tonne de minerai. L’uranium passe en solution sous forme de sulfate d’uranyle.
– Lavage s’effectuant à contre-courant à l’eau acidulée dans des épaississeurs, grandes cuves de 15 à 20 mètres de diamètre et de 3 à 4 mètres de hauteur.
En définitive, on obtient une solution de sulfate d’uranyle titrant de 300 à 500 milligrammes par litre.
Jusqu’au stade du lavage, les différents procédés d’attaque sont identiques à quelques détails près. Au-delà, il existe plusieurs méthodes (fig. 1) pour purifier les jus qui contiennent diverses impuretés (silice, fer, alumine, etc.) et pour passer au stade de concentré final (uranate de magnésie ou nitrate d’uranyle).
Si le concentré est un uranate de magnésie, la purification peut se faire par passage sur des résines échangeuses d’ions fixant sélectivement l’uranium sous forme d’un complexe d’uranylsulfate. Par réextraction avec une solution sulfurique de chlorure de sodium, on obtient une liqueur titrant de 5 à 6 grammes d’uranium par litre. On procède ensuite à la précipitation en ajoutant d’abord de la chaux (pH 2-2,5) pour éliminer le sulfate de chaux, puis de la magnésie, qui provoque la formation d’un uranate de magnésie; celui-ci, lavé, filtré et séché, a une teneur de 70 à 72 p. 100 en uranium.
La purification peut s’effectuer sur solvants par échange d’ions également, mais en phase liquide et non mixte.
Si le concentré est un nitrate d’uranyle, on précipite, après lavage, un uranate de chaux qui est filtré, séché et repris par l’acide sulfurique. L’adjonction de nitrate de chaux permet d’éliminer le sulfate de calcium et de passer au nitrate d’uranyle, que l’on purifie par passage sur du tributylphosphate. La réextraction se fait par l’eau, et on concentre par évaporation jusqu’à des teneurs de 400 grammes d’uranium par litre. Le concentré ainsi obtenu est plus pur que l’uranate de magnésie.
Pour certains minerais, notamment aux États-Unis, afin d’éviter une consommation d’acide prohibitive, on utilise l’attaque carbonatée. Par ailleurs, certaines usines produisent un uranate de sodium comme concentré final. Des essais ont aussi été faits pour obtenir par électrolyse des solutions de nitrate d’uranyle, le tétrafluorure d’uranium qui est un stade intermédiaire obligatoire dans la fabrication du métal et aussi dans le processus de passage à l’uranium enrichi.
Fabrication de l’uranium
À partir des concentrés uranifères précédemment obtenus, la fabrication du métal se divise en deux parties (fig. 2): la purification, qui s’opère par voie humide, l’élaboration du métal, effectuée par voie sèche.
En variante, on peut aussi avoir à passer à l’hexafluorure U6 pour alimenter les usines de diffusion gazeuse.
Purification
Les matières premières uranifères alimentant la fabrication sont principalement des concentrés chimiques. Ces produits contiennent de nombreuses impuretés. Pour conférer à l’uranium la «pureté nucléaire», la majeure partie des éléments étrangers doit être éliminée. On utilise la propriété du nitrate d’uranyle de se dissoudre dans certains solvants organiques, ce qui permet une séparation efficace de presque tous les autres éléments. Il faut ensuite remettre l’uranium purifié sous forme solide en vue de l’élaboration du métal.
La purification comprend donc les cinq phases suivantes pour les uranates:
– mise en solution des uranates dans l’acide nitrique;
– extraction par solvant du nitrate d’uranyle brut;
– réextraction par l’eau du solvant chargé de nitrate d’uranyle;
– précipitation de l’uranium purifié;
– préparation du trioxyde U3 par calcination.
Si le concentré traité est un nitrate d’uranyle, il n’y a évidemment que quatre phases.
Le solvant était initialement l’éther; il a été remplacé d’abord par l’hexone (méthylisobutylcétone), puis par le phosphate tributylique, plus efficace et moins dangereux. Ce solvant dense et visqueux est dilué dans du dodécane. La précipitation permet de repasser en phase solide; elle se fait à l’ammoniac. La calcination de l’uranate d’ammonium obtenu est réalisée à 400 0C dans un four continu à bande; on obtient l’U3 sous forme d’écailles oranges.
Élaboration de l’uranium
Deux phases peuvent être distinguées dans l’élaboration de l’uranium métallique: la préparation du tétrafluorure U4 et celle du métal.
La préparation du tétrafluorure , initialement menée en deux stades (réduction en dioxyde, puis fluoration en tétrafluorure dans deux fours différents), est maintenant effectuée dans un seul four, dit LC, qui fonctionne suivant la technique du lit mobile. L’agent de réduction est l’ammoniac gazeux et celui de fluoration est l’acide fluorhydrique. L’avantage essentiel du procédé réside dans le fait que l’oxyde U3 n’étant à aucun moment au contact de l’air la réduction est menée à une température aussi basse que possible, conduisant à un bioxyde extrêmement réactif qui, par réaction avec l’acide fluorhydrique, fournit un fluorure titrant plus de 98 p. 100 en U4. C’est la qualité exigée pour l’opération suivante de réduction en métal, et c’est aussi celle qui convient pour la transformation du tétrafluorure en hexafluorure U6.
La réduction du tétrafluorure en uranium métallique, qui a d’abord mis en œuvre le calcium, se fait maintenant universellement par magnésiothermie, le magnésium étant beaucoup moins cher que le calcium nucléairement pur. Alors que la calciothermie s’amorçait à froid à la façon d’une aluminothermie, la magnésiothermie exige un chauffage du mélange réactionnel jusqu’à 650 0C au moyen d’un four électrique à cloche qui vient coiffer le creuset.
Dans le cas où l’on passe du tétrafluorure à l’hexafluorure, la réaction de fluoruration pour passer à l’hexafluorure se fait dans un réacteur à flamme alimenté en U4 broyé et en fluor préchauffé à 250-300 0C.
2. Propriétés
L’uranium est très actif vis-à-vis de l’oxygène; à l’air, il se recouvre très vite d’une couche d’oxyde et, lorsqu’il est divisé en copeaux, il s’enflamme facilement. Avec l’hydrogène il forme très facilement l’hydrure UH3, très inflammable.
Propriétés nucléaires
L’uranium possède trois principaux isotopes naturels (235U, 238U, 234U) radioactifs qui se désintègrent en émettant des rayonnements 見 et 塚 [cf. RADIOACTIVITÉ] et un isotope artificiel 236U.
L’uranium naturel tel qu’il est extrait de son minerai contient 99,27 p. 100 de l’isotope 238 et 0,71 p. 100 de l’isotope 235. Ce dernier noyau, soumis à l’action d’un flux de neutrons thermiques (énergie inférieure à 0,1 MeV), subit la fission , qui engendre spontanément deux nouveaux noyaux animés chacun d’une très grande énergie cinétique (de 80 à 100 MeV) en émettant simultanément 2 ou 3 neutrons rapides d’énergie moyenne 2 MeV.
L’isotope 238U, sous le même flux de neutrons, est capable d’absorber un neutron thermique pour donner un noyau instable qui, par désintégrations 廓 successives, aboutit à la formation de l’élément artificiel 239Pu; celui-ci est capable, comme l’uranium 235, de subir la fission.
Transformations de phases
L’uranium possède trois variétés allotropiques entre la température ambiante et son point de fusion. Jusqu’à 668 0C, il présente la structure orthorhombique (phase 見); entre 668 et 775 0C, il possède la structure quadratique (phase 廓); enfin, de 775 0C jusqu’au point de fusion 1 130 0C, il présente la structure cubique centrée (phase 塚).
Dans la phase 見 orthorhombique, les paramètres de la maille sont a 0 = 0,2854 nm, b 0 = 0,5868 nm, c 0 = 0,4956 nm.
La disposition des atomes dans la maille peut être observée sur la figure 3.
L’arrangement atomique dans les structures 見 et 廓 est très anisotrope et de ce fait les caractéristiques physiques telles que le coefficient de dilatation, le module d’élasticité, la résistivité dépendront beaucoup des directions cristallographiques. Par exemple, sous l’influence de la température, les paramètres de la maille varient différemment, d’où une anisotropie de dilatation thermique: dans les directions cristallographiques a et c , le coefficient de dilatation linéaire augmente avec la température, tandis que, dans la direction b , ce coefficient diminue. Dans le métal polycristallin, cela se traduit par un coefficient de dilatation moyen en volume positif.
Les principales propriétés physiques de la phase 見 sont portées dans le tableau 3.
La microstructure après coulée sous vide présente de gros grains de 500 à 1 000 猪m, très déformés.
Propriétés mécaniques
L’uranium étant un métal fortement anisotrope, ses propriétés mécaniques varient beaucoup avec le mode de fabrication (coulé, filé, laminé, étiré...), le traitement thermique et les impuretés.
Le tableau 4 résume les principales caractéristiques mécaniques à la température ambiante. En phase 廓, l’uranium est très fragile (l’allongement à rupture est de 2 à 4 p. 100). Par contre, en phase 塚, il est très plastique.
Effets de l’irradiation par les neutrons
L’uranium non allié soumis aux flux de neutrons dans les réacteurs subit des déformations macroscopiques importantes dues à deux phénomènes: la croissance anisotrope et le gonflement.
Croissance anisotrope
La croissance anisotrope se caractérise par un allongement dans la direction cristallographique b et un raccourcissement dans la direction a , cela sans variation de volume ni modification de structure. Ce phénomène a été découvert en 1955; il n’est pas spécifique de l’uranium et on l’observe dans d’autres métaux anisotropes tels que le zirconium et le cadmium. Le mécanisme est resté longtemps inexpliqué; toutefois, sur la base d’observations de microscopie électronique, une théorie de la croissance a pu être élaborée.
Les fragments de fission produisent dans l’uranium des défauts ponctuels: lacunes et interstitiels (cf. CRISTAUX - Défauts dans les cristaux). Ces défauts s’assemblent pour former des amas ou des boucles de lacunes ou d’interstitiels. Lors de l’échauffement du métal produit par la fission, les boucles ont tendance à se répartir préférentiellement sur des plans cristallographiques différents: les interstitiels sur des plans en relation avec la direction b , ce qui conduit à un allongement; les lacunes sur des plans en relation avec la direction a , ce qui amène une contraction. Cette répartition est due aux contraintes thermiques provoquées par l’anisotropie de dilatation suivant les trois axes du réseau orthorhombique: dans la direction a , la contrainte de compression favorisera la formation de boucles lacunaires, tandis que, dans la direction b , la contraction du réseau (coefficient de dilatation négatif) favorisera la condensation de boucles d’interstitiels.
Dans le métal polycristallin possédant une orientation préférentielle introduite par laminage, par exemple, on constate un allongement considérable, qui peut atteindre 400 p. 100 à 250 0C pour une irradiation allant jusqu’à 1 000 MWj/t (mégawatts-jours par tonne).
Le coefficient de croissance G est exprimé par le rapport entre le pourcentage d’allongement et le pourcentage d’atomes fissionnés:
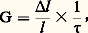
精 (p. 100) est le taux de combustion , soit le rapport du nombre d’atomes ayant subi la fission au nombre total d’atomes. Le nombre G pour l’uranium présentant une forte texture de laminage (texture en relation avec la direction b ) est 15 700 à 20 K et 400 à 310 K.
Gonflement
Lors de la fission de 235U, 12 p. 100 des produits de fission sont constitués par des éléments gazeux, krypton et xénon. Les atomes ainsi créés sont insolubles et peuvent précipiter sous forme de bulles. Par ailleurs, les défauts ponctuels de type lacune, produits en très grand nombre, ont tendance à migrer et à se condenser sur les bulles préexistantes. La conséquence en est un accroissement de volume du métal appelé «gonflement». L’uranium irradié se présente alors sous forme d’une masse spongieuse, comme on peut l’observer sur la figure 4.
Le métal pur irradié à 450 0C jusqu’à 1 000 MWj/t présente un gonflement atteignant 50 p. 100.
La courbe du gonflement en fonction de la température présente un maximum au voisinage de 450 0C et décroît ensuite jusqu’à 550 0C pour croître enfin jusqu’en phase 廓: 700 0C (fig. 5).
Ainsi la croissance et le gonflement rendent-ils l’uranium impropre à une utilisation à l’état pur dans les réacteurs de puissance, et il a été nécessaire de mettre au point des alliages métalliques ou des composés céramiques tels que l’oxyde pour obtenir des matériaux possédant une bonne stabilité sous flux de neutrons.
3. Principaux alliages et composés
L’uranium possède une grande aptitude à former des alliages; certains d’entre eux sont utilisés comme matériaux fissiles dans les éléments combustibles des réacteurs nucléaires. On ne décrira ici que les alliages employés dans les réacteurs de la filière graphite-gaz en France et Magnox en Grande-Bretagne.
Alliages U-Fe-Al
Les alliages U-Fe-Al, utilisés en France sous le nom de sicral F1 et en Grande-Bretagne sous le nom d’uranium ajusté, contiennent de 0,02 à 0,05 p. 100 de fer, de 0,05 à 0,09 p. 100 d’aluminium, avec en plus, pour le premier, de faibles quantités de silicium et de chrome. Ces éléments d’addition permettent l’application d’un traitement thermique de trempe destiné à l’obtention d’une microstructure à grains fins avec des précipités constitués par les composés intermétalliques U6Fe et UAl2.
Cet alliage possède alors une résistance mécanique accrue par rapport à l’uranium pur, ainsi qu’une bonne stabilité sous flux de neutrons. On s’en sert maintenant sous forme de tubes contenant une âme de graphite dans de nombreux réacteurs gaz-graphite (Saint-Laurent, Vandellos).
Alliages uranium-molybdène et dérivés
Les alliages renfermant 0,5 et 1,1 p. 100 en poids de molybdène ont été utilisés en France dans les réacteurs Chinon-1, 2 et 3 situés à Avoine, près de Chinon.
L’alliage à 1,1 p. 100 a été retenu en raison de ses propriétés intéressantes telles que structure à grains fins, absence d’orientation préférentielle et très haute résistance au fluage. Sa morphologie en phase 見 est une microstructure lamellaire biphasée constituée par les deux solutions solides U 見 et U 塚.
Cette structure possède une parfaite isotropie statistique en raison de la finesse du grain, ce qui élimine toute orientation préférentielle après coulée et refroidissement lent. De plus, la résistance au fluage, très élevée à haute température, a permis l’utilisation de ce matériau sous forme d’éléments tubulaires soumis à la pression extérieure du gaz. Ces éléments ont montré une bonne stabilité sous irradiation.
L’alliage U-Mo 1 Al 0,05 Sn 0,05 possède les mêmes propriétés structurales que l’alliage U-Mo 1,1; mais sa résistance à l’irradiation est considérablement plus élevée (fig. 4).
Bioxyde d’uranium
Le bioxyde d’uranium U2 est utilisé dans les réacteurs à eau de type P.H.W. au Canada, P.W.R. et B.W.R. aux États-Unis (cf. réacteurs NUCLÉAIRES); il a été également employé dans les réacteurs à gaz de type A.G.R. en Grande-Bretagne.
Il est élaboré sous forme d’une poudre brun foncé qu’il est nécessaire de fritter pour obtenir un matériau massif. Son point de fusion est d’environ 2 800 0C. Il possède une structure cristalline cubique à faces centrées avec un paramètre de 0,570 nm et présente une excellente stabilité sous flux de neutrons jusqu’à des taux de combustion très élevés: 100 000 MWj/t.
4. Fabrication des éléments combustibles
L’élément combustible comprend le combustible lui-même (uranium ou alliage d’uranium, ou plus souvent oxyde d’uranium ou oxyde mixte d’uranium et de plutonium), et la gaine , ou le revêtement, de ce combustible (acier ou alliage de zirconium ; les autres matières telles que le magnésium et le graphite ne sont pas ou ne sont plus utilisées industriellement).
Cet ensemble gaine-combustible peut être agencé de manières diverses: faisceaux de tubes (appelés crayons combustibles) ou arrangement de plaques. Cet assemblage, ou structure, assure la tenue mécanique de l’ensemble. Le choix des matériaux et de l’arrangement géométrique est lié au type de réacteur (filière), notamment à la nature du combustible (uranium naturel ou enrichi), du réfrigérant (gaz, sodium ou eau) et s’il y a lieu du modérateur (graphite, eau lourde ou eau ordinaire).
Le combustible
En général, le combustible est soit un alliage d’uranium, soit le bioxyde d’uranium, soit un mélange d’oxydes d’uranium et de plutonium.
À partir de lingots massifs de 100 à 500 kg, le métal peut être facilement transformé en produits finis tels que barreaux, tubes, par fusion sous vide vers 1 300 0C. La coulée est effectuée par gravité, par coulée continue, par centrifugation. Le vide est toujours nécessaire pour empêcher l’oxydation et faciliter le dégagement des gaz occlus. Si on désire des plaques ou d’autres profils, on peut filer le métal ou le laminer. Dans le cas des alliages d’uranium, on applique généralement après coulée un traitement thermique (trempe, refroidissement contrôlé...).
L’oxyde d’uranium est obtenu par frittage de poudres d’U2 provenant de la réduction d’oxydes supérieurs U3 ou U38.
Gaine ou revêtement du combustible
Le but de la gaine est d’empêcher les produits de fission gazeux et solides provenant du combustible de se dégager en permanence dans le circuit du fluide caloporteur, d’empêcher la détérioration rapide du combustible sous l’action corrosive de ce fluide, d’assurer enfin le bon transfert des calories dégagées par le combustible au cours de la fission.
La nature du matériau de gaine et sa forme dépendent du type de réacteur.
– Pour les réacteurs à uranium naturel refroidis à l’eau et modérés à l’eau lourde, la gaine doit être en alliage peu absorbant et résister à la corrosion de l’eau. Un alliage de zirconium a été retenu.
– Pour les réacteurs à uranium enrichi, refroidis à l’eau ordinaire, on utilise des gaines en zirconium ou en acier.
– Pour les réacteurs à uranium enrichi, refroidis à l’hélium à haute température (H.T.G.R.), le combustible est de l’oxyde en petites billes, recouvertes de graphite, et l’ensemble est compacté dans du graphite.
– Enfin, pour les réacteurs à neutrons rapides, la gaine est en acier.
Quand il s’agit de gaines métalliques, l’étanchéité est assurée par des soudures effectuées sous argon (procédé T.I.G.) ou par bombardement électronique.
uranium [ yranjɔm ] n. m. ♦ Élément radioactif naturel (U; no at. 92; m. at. 238,03), métal gris, dur, présent dans plusieurs minerais (comme le pechblende) où il est toujours accompagné de radium. ⇒ radioactivité. Isotopes naturels (234U, 235U, 238U) et artificiels (233U, 236U, 237U, 239U) de l'uranium. Séparé des autres isotopes, l'uranium peut donner lieu, sous l'action de neutrons thermiques, au phénomène de fission qui permet une réaction en chaîne. L'uranium 238 se transforme en plutonium 239 fissile (piles atomiques susceptibles de faire fonctionner des centrales thermiques). Uranium enrichi, appauvri.
● uranium nom masculin (de urane) Métal lourd, radioactif. (Élément chimique de symbole U.) Numéro atomique : 92 Masse atomique : 238,03 Masse volumique : 19,07 g°cm3 Température de fusion : 1 132 °C
uranium
n. m. élément métallique (symbole U) de numéro atomique Z = 92.
— Métal (U), qu'on trouve dans la nature sous forme d'oxydes d'uranium. L'uranium est utilisé comme combustible dans les centrales nucléaires.
⇒URANIUM, subst. masc.
CHIM. Corps simple, métal gris toxique, présent dans plusieurs minerais où il est toujours associé au radium; élément radioactif naturel mélange de trois isotopes: uranium 238, uranium 235, uranium 234 (sym. U, numéro atomique 92, masse atomique 238,03). Oxyde, sels d'uranium; uranium naturel; minerai d'uranium. Pour l'énergie atomique naissante, les ressources d'uranium qui semblent abondantes chez nous, ainsi que nos capacités scientifiques et industrielles, nous donnent la possibilité d'atteindre un niveau exceptionnel (DE GAULLE, Mém. guerre, 1959, p. 237). La fission d'un noyau d'uranium est accompagnée d'une grande émission d'énergie, correspondant à la déperdition d'environ une partie pour mille de sa masse (GOLDSCHMIDT, Avent. atom., 1962, p. 23).
♦ Uranium 235. Isotope de l'uranium, fissible, qui constitue le combustible nucléaire le plus courant. L'équipe Joliot, Halban et Kowarski, à laquelle s'était joint Francis Perrin, comprit assez rapidement que, dans l'uranium naturel, seul l'isotope rare, l'uranium 235, subit facilement la fission (GOLDSCHMIDT, Avent. atom., 1962, p. 26).
♦ Uranium enrichi. Uranium traité par séparation des isotopes de manière à augmenter la proportion d'uranium 235. Dans les centrales nucléaires actuelles, seul l'uranium 235 est utilisable; les filières à eau pressurisées développées en France recourent à de l'uranium enrichi (LAV.-POLLET 1982).
♦ Uranium appauvri. Uranium qui a perdu une grande partie de son istope 235 et qui sert, entre autres usages, de métal de blindage contre les rayons X. Les surrégénérateurs, eux, ont deux avantages. D'abord, ils utilisent les « déchets » des centrales actuelles: le plutonium produit par la fission et l'uranium « appauvri », inexploitable dans les réacteurs d'aujourd'hui (L'Express, 11 juill. 1977, p. 66, col. 3).
REM. 1. Uranide, subst. fém., chim. Nom générique de quatre éléments: l'uranium, le plutonium, le neptunium, l'américium, dont le numéro atomique est compris entre 92 et 95 et qui ont des propriétés chimiques voisines (d'apr. MUSSET-LLORET 1964 et Industries 1986). 2. Uraninite, subst. fém., minér. Minerai uranifère de couleur noire à forte teneur en oxyde d'uranium généralement associé à l'oxyde de thorium dont la pechblende est une variété (d'apr. Nucl. 1975). Par altération l'uraninite se transforme en un mélange de minéraux secondaires d'uranium de couleur orange très vif (DE MICH. 1972). 3. Uranite, subst. fém., minér. [N. générique des phosphates et arséniates naturels d'uranium] Pourvue d'un clivage P très net, l'uranite (...) forme des cristaux tabulaires ou des lamelles minces jaune d'or ou jaune de soufre, d'éclat nacré, facilement fusibles au chalumeau (LAPPARENT, Minér., 1899, p. 534). 4. Uranyle, subst. masc., chim. a) Radical UO2, oxyde d'uranium. Uranates : Sels obtenus en traitant un sel soluble d'uranyle par une base alcal[ine] (GRAND. 1962). b) Subst. + d'uranyle. Composé qui renferme ce radical. Oxyde d'uranyle. Ce produit y est dissous et purifié par extraction (...) et un oxyde pur est obtenu par calcination de nitrate d'uranyle (LESC. 1973).
Prononc. et Orth.:[ ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1. 1804 « urane, oxyde d'uranium » (Ann. du Museum national d'hist. nat., t. 3, p. 402); 2. 1841 « métal extrait de l'urane » (E. PÉLIGOT ds C.r. de l'Ac. des sc., t. 13, pp. 420-421: je proposerai de conserver à ce composé le nom d'urane, désignant désormais sous le nom d'uranium le véritable corps simple). Dér. de urane; suff. -ium. Fréq. abs. littér.:450. Fréq. rel. littér.:XIXe s.: a) néant, b) néant; XXe s.: a) néant, b) 1 914. Bbg. STOROST (J.). Mercure - Quecksilber. Beitr. rom. Philol. 1973, t. 12, p. 377.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1. 1804 « urane, oxyde d'uranium » (Ann. du Museum national d'hist. nat., t. 3, p. 402); 2. 1841 « métal extrait de l'urane » (E. PÉLIGOT ds C.r. de l'Ac. des sc., t. 13, pp. 420-421: je proposerai de conserver à ce composé le nom d'urane, désignant désormais sous le nom d'uranium le véritable corps simple). Dér. de urane; suff. -ium. Fréq. abs. littér.:450. Fréq. rel. littér.:XIXe s.: a) néant, b) néant; XXe s.: a) néant, b) 1 914. Bbg. STOROST (J.). Mercure - Quecksilber. Beitr. rom. Philol. 1973, t. 12, p. 377.
 ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1. 1804 « urane, oxyde d'uranium » (Ann. du Museum national d'hist. nat., t. 3, p. 402); 2. 1841 « métal extrait de l'urane » (E. PÉLIGOT ds C.r. de l'Ac. des sc., t. 13, pp. 420-421: je proposerai de conserver à ce composé le nom d'urane, désignant désormais sous le nom d'uranium le véritable corps simple). Dér. de urane; suff. -ium. Fréq. abs. littér.:450. Fréq. rel. littér.:XIXe s.: a) néant, b) néant; XXe s.: a) néant, b) 1 914. Bbg. STOROST (J.). Mercure - Quecksilber. Beitr. rom. Philol. 1973, t. 12, p. 377.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1. 1804 « urane, oxyde d'uranium » (Ann. du Museum national d'hist. nat., t. 3, p. 402); 2. 1841 « métal extrait de l'urane » (E. PÉLIGOT ds C.r. de l'Ac. des sc., t. 13, pp. 420-421: je proposerai de conserver à ce composé le nom d'urane, désignant désormais sous le nom d'uranium le véritable corps simple). Dér. de urane; suff. -ium. Fréq. abs. littér.:450. Fréq. rel. littér.:XIXe s.: a) néant, b) néant; XXe s.: a) néant, b) 1 914. Bbg. STOROST (J.). Mercure - Quecksilber. Beitr. rom. Philol. 1973, t. 12, p. 377.
uranium [yʀanjɔm] n. m.
ÉTYM. 1840; 1804, « urane », Peligot; de urane, et suff. lat. -ium.
❖
♦ Élément radioactif naturel (masse at. : 238,03; no at. : 92; symb. : U), métal gris, dur (dens. 18,68; température de fusion 1 132 °C), présent dans plusieurs minerais où il est toujours accompagné de radium, en particulier dans la pechblende. ⇒ Radioactivité (cit.; et → Hypothétique, cit.; insolation, cit. 1; radiant, cit.). || Isotopes naturels (234U, 235U, 238U) et artificiels (233U, 236U, 237U, 239U) de l'uranium. || L'uranium 238 et l'uranium 235 (ou 238U, 235U) sont tous deux têtes de file d'une série radioactive naturelle ddont le dernier terme stable est le plomb. || Certains des isotopes de l'uranium peuvent donner lieu sous l'action de neutrons thermiques au phénomène de fission (découvert en 1939), très fortement exothermique et qui permet de concevoir une réaction en chaîne entretenue par les neutrons provenant de chaque fission et produisant des quantités considérables d'énergie (piles atomiques, susceptibles de faire fonctionner des centrales thermiques; bombes atomiques : bombe A, 1945). || Dans l'uranium naturel l'isotope le plus abondant, 238U, n'est pas fissible sous l'action des neutrons thermiques; il faut donc en séparer 235U, seul fissible, ou « enrichir » l'uranium naturel en 235U (cependant sous l'action de neutrons rapides issus de la fission de 235U, 238U peut donner naissance au plutonium 239 [239Pu] qui à son tour est fissible [bombe au plutonium]). || L'uranium enrichi sert de combustible aux réacteurs nucléaires produisant de l'électricité. — Au point de vue chimique, l'uranium s'apparente à la famille du chrome. || Dans la métallurgie de l'uranium, on distingue l'uranium α (stable au-dessous de 660 °C), l'uranium β (de 660° à 770 °C), et l'uranium γ (au-dessus de 770 °C). || L'uranium est toxique pour l'organisme.
❖
COMP. 2. Transuranien.
Encyclopédie Universelle. 2012.