MEMBRANES CELLULAIRES
Les membranes cellulaires (ou biomembranes) doivent être clairement distinguées des parois, capsules ou autres enveloppes pouvant entourer les cellules vivantes. Les biomembranes font intégralement partie de la matière cellulaire (ou protoplasme). Lorsque la cellule meurt, les biomembranes se désorganisent, alors que les parois peuvent fort bien subsister (c’est ce que l’on observe par exemple dans le bois des arbres, formé des parois lignifiées de cellules végétales disparues depuis longtemps). Les membranes sont protoplasmiques ; les parois, enveloppes, capsules, sécrétées par les cellules, mais extérieures aux cellules vivantes, sont paraplasmiques.
Toute cellule est délimitée par une biomembrane périphérique (ou plasmalemme ) isolant, dans une certaine mesure, cette cellule du milieu environnant. Toute cellule eucaryote (possédant un véritable noyau) est subdivisée en compartiments distincts, dans lesquels les activités enzymatiques sont différentes. Les biomembranes sont les structures de compartimentation de la masse cellulaire. Chaque compartiment cellulaire est entouré d’une biomembrane; à la périphérie de certains organites (noyau, plaste, mitochondrie), elle est doublée par une seconde biomembrane, parallèle à la première et séparée d’elle par un intervalle.
De très faible épaisseur (de 7,5 à 12,5 nm), la structure membranaire associe des lipides et des protéines dans des proportions variables. Ces constituants sont toujours unis dans la structure membranaire par des liaisons non covalentes. Au point de vue biophysique, toute membrane cellulaire présente une zone centrale hydrophobe entourée de deux zones périphériques plus riches en radicaux hydrophiles . La structure membranaire est à la fois et contradictoirement: 1. une barrière de perméabilité s’opposant à la diffusion libre des ions et autres métabolites d’un compartiment cellulaire à un autre ou à travers le plasmalemme et par conséquent de la cellule au milieu extérieur ou vice versa; 2. un lieu privilégié d’échanges de matière et d’énergie entre compartiments intracellulaires ou entre la cellule et le milieu externe, grâce à de nombreux «transporteurs» de nature protéique (perméases) localisés dans ces biomembranes. Enfin, ce sont encore les biomembranes qui renferment la plupart des récepteurs (protéiques ou pigmentaires) des signaux (chimiques ou physiques) venant du milieu environnant [cf. RÉCEPTEURS MEMBRANAIRES].
1. Organisation des biomembranes
L’ultrastructure membranaire
Les structures membranaires sont trop fines pour être observées au microscope à lumière. La microscopie électronique révèle, sur les coupes ultrafines de cellules ou tissus fixés au glutaraldéhyde puis contrastées par les métaux lourds (tétroxyde d’osmium ou permanganate de potassium) une image tripartite constante pour toutes les biomembranes, quelle qu’en soit l’origine. Cette image tripartite fondamentale montre une zone centrale claire de 4 nm d’épaisseur environ, prise en sandwich entre deux bandes sombres (plus opaques aux électrons); l’ensemble mesure 7,5 à 10 nm d’épaisseur, selon le type de membrane examiné (fig. 1). Quelques mots sur l’interprétation d’une telle image, au niveau moléculaire, seront dits après présentation de l’architecture moléculaire des membranes (cf. Assemblage: le modèle membranaire «en mosaïque fluide» ).
La microscopie électronique a donné récemment de nouvelles images des biomembranes, après cryodécapage des préparations biologiques. Pour ce procédé, on procède à la fixation des cellules par les très basses températures de l’hélium ou du fréon liquides, puis on confectionne une réplique carbonée des surfaces cellulaires mises à nu par la fracture de l’échantillon. Quand on examine au microscope électronique l’une de ces répliques de surfaces (ombrées par pulvérisation métallique), l’image membranaire apparaît alors (fig. 2) sous l’aspect d’un fond lisse homogène dans lequel se trouvent enchâssées des particules sphériques (de 8 à 12 nm de diamètre). Les recherches contemporaines ont établi que le fond lisse correspondait à la matrice lipidique des membranes; les particules sont des protéines membranaires (car elles sont détruites par les protéases et elles fixent les anticorps produits dans le sang des Vertébrés contre les protéines membranaires). Sur les images de membranes obtenues en microscopie électronique après cryodécapage, les particules protéiques sont tantôt dispersées aléatoirement sur toute la surface membranaire, tantôt agrégées en zones de fortes densités, laissant entre elles des plages vides. Ces deux types d’image évoquent une certaine fluidité de la matrice lipidique permettant la diffusion latérale (dans le plan de la membrane) des protéines.
Les constituants des biomembranes
Isolement et purification
Les méthodes contemporaines de la biologie cellulaire permettent d’isoler au laboratoire de nombreuses catégories de membranes, conservant intactes leur morphologie et leurs propriétés physiologiques. La centrifugation différentielle est la méthode de choix: les tissus ou amas de cellules sont broyés à basse température (4 0C) dans un milieu convenable (pression osmotique et pH sont ajustés); l’homogénat est centrifugé à des vitesses croissantes et les accélérations successives communiquées au broyat cellulaire font sédimenter des fractions subcellulaires de moins en moins lourdes (noyaux, chloroplastes, mitochondries, lysosomes...). Les membranes des organites peuvent alors être isolées (après éclatement le plus souvent, par choc osmotique) et purifiées par centrifugation dans divers milieux formant des gradients de densité. Toutes les opérations doivent être menées à basse température et les centrifugeuses doivent être réfrigérées si l’on veut que les membranes isolées ainsi obtenues soient fonctionnelles.
Composition chimique
Deux grandes catégories de substances entrent dans la composition des biomembranes: les lipides et les protéines.
Les lipides membranaires (formant de 30 à 50 p. 100 de la masse, selon le type de membrane) sont en majorité des lipides amphipolaires ; les molécules de ces constituants comportent une partie polarisable ou ionisable, hydrophile, et une partie hydrophobe formée de longs résidus d’acides gras. Cette amphipolarité des lipides membranaires leur confère un pouvoir d’auto-organisation spontanée en milieu aqueux; pour des raisons thermodynamiques d’évolution des ensembles moléculaires vers un état de plus grande stabilité, un mélange de lipides membranaires plongés dans l’eau s’organise spontanément en feuillets bimoléculaires (bicouches) ou en micelles cylindriques séquestrant les parties hydrophobes des molécules au centre des agrégats, le contact avec les molécules d’eau étant assuré par les parties polaires (fig. 3).
Trois classes de lipides amphipolaires se rencontrent dans les membranes: des phospholipides ; des galactolipides (spécifiques des membranes des chloroplastes); des glycosphingolipides (céramides, glycosyl-céramides, gangliosides et sulfatides). Le tableau 1 présente quelques types moléculaires parmi les plus fréquents dans les membranes animales ou végétales. Un exemple de composition en lipide d’une membrane cellulaire est donné au tableau 2. À ces lipides membranaires amphipolaires s’ajoute toujours une faible proportion de lipides neutres: triacylglycérols, paraffines, stérols, stérols glycosylés, etc.
Les protéines membranaires sont classiquement divisées en deux grandes catégories:
– les protéines périphériques (ou extrinsèques), que l’on peut détacher facilement des structures par extraction avec un solvant polaire (solution saline peu concentrée). Ces protéines extrinsèques semblent liées à la structure membranaire par des interactions de nature principalement électrostatique;
– les protéines intégrées (ou intrinsèques), très fortement liées aux membranes par des interactions dites hydrophobes (liaisons entre résidus non polaires des protéines et des lipides), que l’on ne peut extraire et séparer des lipides qu’en brisant la structure membranaire à l’aide de détergents.
Les protéines membranaires sont pour partie des glycoprotéines . Généralement, ces protéines présentent vers l’extérieur de la membrane (vers l’extérieur de la cellule, quand il s’agit du plasmalemme) leurs résidus glycosylés. Ces glycoprotéines supportent (en combinaison avec les glycosphingolipides) les groupes antigéniques qui confèrent aux cellules leur individualité biologique.
Les protéines membranaires (périphériques ou intégrées) peuvent être des enzymes très diverses, des transporteurs de cations, d’anions ou de métabolites divers, des récepteurs hormonaux, des supports pour la fixation des pigments. Ces protéines (en interaction avec les lipides qui les environnent) jouent le plus grand rôle dans la physiologie des membranes.
Assemblage: le modèle membranaire «en mosaïque fluide»
Les données expérimentales les plus récentes sur la morphologie, la biochimie et la physiologie des membranes cellulaires ont permis à Singer et Nicolson de proposer, en 1971, un modèle moléculaire suggérant l’arrangement des lipides et des protéines au sein des biomembranes. Ce modèle en mosaïque fluide fait l’objet d’un très large consensus parmi les biologistes (fig. 4). Il décrit la matrice lipidique fondamentale comme une bicouche de lipides amphipolaires (phospho-ou glycolipides). Les protéines intégrées sont enfoncées plus ou moins profondément dans la matrice et nouent des interactions hydrophobes avec les chaînes d’acide gras du feuillet central de la bicouche lipidique; les calottes polaires des protéines intégrées font saillie (en dôme) au-dessus du plan des résidus polaires de la bicouche (fig. 4). Certaines protéines intégrées traversent la matrice lipidique de part en part. Les glycoprotéines présentent leur face glycosylée à l’extérieur de la bicouche d’un seul côté du plan de la membrane, ce qui crée une certaine asymétrie de la structure. Cette asymétrie peut se trouver renforcée par la présence plus abondante de protéines périphériques sur une des deux faces de la matrice lipidique. La répartition asymétrique des lipides entre les deux feuillets de la bicouche a été démontrée dans quelques membranes (plasmalemme d’érythrocyte par exemple).
Le modèle en mosaïque fluide doit être envisagé de façon dynamique: des travaux utilisant des molécules repérables en résonance magnétique nucléaire ont montré que les lipides membranaires étaient en perpétuel mouvement de diffusion latérale rapide, le long du plan de la membrane; la structure des chaînes d’acides gras est très désordonnée au sein de la bicouche; l’ensemble est très fluide. Au milieu de cette «mer de lipides», les protéines intégrées flottent comme des icebergs et se déplacent également dans le plan de la membrane, mille fois plus lentement cependant que les molécules de lipides. Au cours du temps, la distribution des protéines dans le plan de la membrane change. Les antigènes de surface peuvent par exemple se rassembler, dans certaines circonstances, à un pôle cellulaire (phénomène de capping ).
Des travaux récents de Cullis et De Kruyff suggèrent l’existence de micelles lipidiques cylindriques insérées dans la bicouche, au sein des membranes, dans certaines circonstances, notamment dans les cas de fusion de biomembranes ou de vésiculation (pinocytose, phagocytose).
Les images de surfaces membranaires observées en microscopie électronique après cryodécapage s’accordent très bien avec le modèle en mosaïque fluide. Les images tripartites après fixation au glutaraldéhyde et contraste par les métaux lourds sont interprétées comme le résultat d’une dénaturation des protéines intégrées: les peptides dénaturés viennent se disposer de part et d’autre du feuillet central et l’édifice moléculaire résultant de cette dénaturation fixe les métaux lourds dans les parties polaires de l’ensemble (ce qui est à l’origine des deux bandes noires opaques aux électrons).
La relation structure-fonction au niveau membranaire
L’unité fondamentale de composition et d’architecture moléculaire des biomembranes n’empêche nullement la réalisation au sein des cellules et tissus d’une assez grande variété de types membranaires différenciés. À cette diversification structurale correspond naturellement une différenciation fonctionnelle.
Outre la membrane limitante (plasmalemme ou membrane plasmique) la cellule contient un nombre important d’organites, tel le réticulum endoplasmique, l’appareil de Golgi, les mitochondries, chloroplastes, lysosomes, peroxysomes, etc. Tous ces organites sont entourés de membranes. Topologiquement ces membranes délimitent, de façon continue, un espace intracellulaire et forment une vésicule close, quelle que soit par ailleurs la complication réelle de leur forme. Elles ont une face cytoplasmique (externe) et une face luminale (interne) qui sont baignées par des milieux de composition différente; leurs fonctions sont donc vectorielles (orientées vers l’une ou l’autre face) et leur structure reflète cette asymétrie.
La différenciation des membranes peut notamment porter sur leur composition protéinique. Dans les membranes mitrochondriales, les protéines intégrées sont la cytochrome-oxydase, les cytochromes b, b1, a1, a3, les flavoprotéines, les protéines à fer non hémique. Dans les membranes chloroplastiques, les photosystèmes I et II, leurs antennes collectrices, constituent des ensembles de protéines et de pigments intégrés; dans les deux types de membranes (effectuant des transductions d’énergie) on trouve des ATP-synthétases, qui sont également des protéines intégrées. Les protéines périphériques (ou extrinsèques) varient tout autant d’une membrane à une autre: le cytochrome c est une protéine extrinsèque de la membrane interne des mitochondries; la ferrédoxine, une protéine extrinsèque de la membrane chloroplastique; la spectrine, une protéine extrinsèque du plasmalemme des globules rouges, etc.
Cette diversification chimique et structurale des biomembranes provoque les différenciations fonctionnelles observées dans les cellules vivantes. Tous les phénomènes de la physiologie cellulaire impliquent une participation très importante des biomembranes... On se limitera donc ici à donner un tableau relevant les grands secteurs de la physiologie où la participation des biomembranes est très importante (tabl. 3).
Le lecteur se reportera aux articles traitant plus en détail des phénomènes évoqués pour voir quelle est la fonction des différents constituants membranaires dans le déroulement des processus indiqués au tableau 3.
2. Passage des substances
Le modèle membranaire et le passage des substances
Une caractéristique fondamentale de la substance vivante est son incessant renouvellement. Les molécules de toutes dimensions qui sont enfermées à l’intérieur de la membrane cellulaire se détruisent puis se reconstruisent en permanence à partir d’éléments apportés de l’extérieur. Ces derniers (molécules organiques de petite taille, ions inorganiques, ainsi que l’eau, solvant biologique universel) sont échangés constamment, souvent à très grande vitesse, à travers les membranes cellulaires. Mais celles-ci ne constituent pas des filtres inertes: ce sont des barrières hautement sélectives; elles orientent les échanges, c’est-à-dire qu’elles imposent pour chacune des substances qui les traversent un bilan positif ou négatif selon les besoins de l’équilibre intracellulaire. Ces déplacements, ces transferts nets de substance portent le nom de transports membranaires .
Chez les organismes évolués, les cellules effectuent leurs échanges avec le milieu intérieur dont la composition est plus ou moins constante selon les espèces, mais ne peut varier que dans des limites bien définies sous peine de mettre en danger la vie des cellules [cf. OSMORÉGULATION]. Pour maintenir cette relative fixité du milieu interne, l’organisme dispose d’organes régulateurs périphériques qui contrôlent les gains et les pertes. Ces organes sont, en fait, des épithéliums simples ou pluristratifiés. Certains (tube digestif, rein, branchie ou poumon) sont très répandus chez les Métazoaires, d’autres (glandes nasales des Oiseaux, tubes de Malpighi des Insectes) limités à quelques groupes zoologiques. Par leur fonctionnement autant que par leur structure, ces épithéliums sont orientés ou asymétriques (fig. 5). Le côté externe, généralement lubrifié par des cellules secrétrices de mucus, porte le nom de face muqueuse ; il correspond au pôle apical des cellules; le côté interne, en contact avec les liquides ou sérosités internes, et la face séreuse qui correspond au pôle basal des cellules. Les propriétés physiologiques d’un tel épithélium dépendent des propriétés des membranes cellulaires successives que les substances échangées sont appelées à franchir. Il en résulte que les mêmes lois physico-chimiques seront invoquées pour les épithéliums et pour les membranes cellulaires simples. Cela justifie la dénomination commune de membranes biologiques donnée à toutes ces structures. Pour la même raison, cette dénomination s’étend à la multitude des membranes intracellulaires, car des transports s’effectuent également entre le cytoplasme et les organites (noyau, mitochondrie, etc.) que ces membranes délimitent.
L’universalité de ces phénomènes de transports explique que leur étude constitue l’un des thèmes principaux de la recherche biologique actuelle.
Mesure des transports membranaires
Supposons qu’une membrane biologique M, interposée entre deux milieux 1 et 2, transporte une substance S de 1 vers 2. Si l’on connaît le volume V et la concentration C de la substance S dans l’un de ces compartiments, le produit V . C donne la quantité de S présente dans ce compartiment. Les variations de cette quantité en fonction du temps, déterminées par des dosages successifs, permettent de mesurer le transfert de S à travers M. Afin de pouvoir établir des comparaisons quantitatives, on exprime habituellement la quantité transportée en la ramenant à l’unité de surface de M et à l’unité de temps. On obtient ainsi un flux net Jn (fig. 6).
Ce transport net traduit un bilan. En réalité, les échanges de S s’effectuent dans les deux sens, ne serait-ce qu’en raison des phénomènes de diffusion. Le flux net est la somme algébrique, positive ou négative, de deux flux opposés ou unidirectionnels, allant l’un de 1 vers 2, l’autre de 2 vers 1, soit:
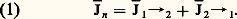
L’analyse fine du mécanisme du transport nécessite la connaissance des flux unidirectionnels. Celle-ci est rendue possible par l’emploi d’un isotope radioactif que l’on incorpore dans les particules S (cf. ISOTOPES, chap. 5). Ainsi, si l’on marque le compartiment 1, le traceur radioactif apparaîtra progressivement en 2; la quantité de radioactivité entraînée par le flux de 1 vers 2 est mesurable à l’aide d’un compteur de radiations. Des formules mathématiques permettent de calculer J1 轢2. Comme le flux net Jn est mesurable indépendamment, l’équation (1) permet de déduire J2 轢1. Cette méthode se fonde sur l’hypothèse – expérimentalement vérifiée dans un certain nombre de cas – que les éléments radioactifs se comportent rigoureusement comme les atomes stables correspondants. Dans les cas particulièrement favorables où il existe deux isotopes radioactifs différents d’un même élément (par exemple 24Na et 22Na pour le sodium), on peut marquer J1 轢2 avec l’un, J2 轢1 avec l’autre sans qu’il soit besoin de mesurer le flux net.
Mécanisme des échanges
Conditions physico-chimiques
Les membranes biologiques sont sélectives, c’est-à-dire qu’elles opposent une restriction plus ou moins grande au passage des substances dissoutes. Hormis cette propriété de plus ou moins grande perméabilité, inhérente à la membrane, deux facteurs physico-chimiques essentiels déterminent l’amplitude du transport: – Le gradient de concentration , C, ou différence de concentration (C1 漣 C2) de la substance S entre les deux compartiments; les particules dissoutes tendent à se mouvoir vers le milieu où la concentration est la plus faible jusqu’à ce que l’égalité de concentration s’établisse entre les deux côtés.
– Le gradient électrique , E, ou différence de potentiel transmembranaire qui caractérise les membranes biologiques électriquement polarisées. Cette différence de potentiel, qui peut atteindre plusieurs dizaines de millivolts, n’influence pas directement le transport des substances électriquement neutres (eau, glucose), mais elle peut agir sur les déplacements des ions (K+, Na+, Cl-, etc.) par le truchement des charges positives ou négatives dont ces ions sont porteurs.
Transports actifs et transports passifs
Les transports biologiques sont répartis en deux types: les transports passifs, qui s’effectuent conformément aux conditions électrochimiques régnant dans le système et qui n’impliquent pas une dépense énergétique de la part de la cellule; les transports actifs qui, au contraire, se produisent à l’encontre du gradient électrochimique. Pour effectuer un transport actif, la cellule doit vaincre ce gradient, donc dépenser de l’énergie. Il est démontré dans nombre de cas que cette énergie provient de l’hydrolyse des liaisons phosphate, riches en énergie, de l’acide adénosine triphosphorique, ATP, qui se transforme en acide adénosine diphosphorique, ADP [cf. OXYDORÉDUCTIONS BIOLOGIQUES]. Des poisons des réactions métaboliques, tels que les cyanures ou le dinitrophénol, inhibent complètement les transports actifs, alors qu’ils sont sans effet immédiat sur les transports passifs.
Les transports passifs (diffusion au sens large) s’effectuent selon divers mécanismes. Dans le cas le plus simple, les particules traversent la membrane par diffusion simple ; les deux flux unidirectionnels sont indépendants l’un de l’autre et ne sont pas affectés par les mouvements de l’eau. H. H. Ussing a montré que les flux sont reliés par la relation (2), dite d’indépendance:

dans laquelle z est le nombre de charges électriques portées par chaque particule, (E1 漣 E2) la différence de potentiel électrique entre les deux faces de la membrane, F le Faraday, R la constante des gaz parfaits, T la température absolue. Pour une substance non ionisée, z = 0, et la relation (2) se simplifie ainsi:

Si la relation (2) n’est pas vérifiée, on peut conclure à la possibilité d’un transport actif.
Dans d’autres cas, la substance S ne traverse pas la membrane librement, mais se combine avec un transporteur mobile, spécifique, qui, en quelque sorte, effectue la navette entre les deux faces de la membrane. Cette association temporaire peut être décrite comme la liaison d’une enzyme avec son substrat. Elle aboutit à une accélération de la diffusion de la substance. C’est pourquoi ce processus porte le nom de diffusion facilitée (fig. 7). Les flux unidirectionnels augmentent rapidement avec la concentration, mais atteignent un maximum, Jmax, quand l’enzyme est saturée (cf. ENZYMES, fig. 2); comme ils interfèrent l’un avec l’autre, du fait que la liaison est réversible, la relation d’indépendance (2) peut ne pas être vérifiée, mais le transport est néanmoins passif. Le transport (flux net) dépend de la valeur des deux flux unidirectionnels. Ces derniers sont du type:

Dans les transports passifs, on finit par atteindre un état d’équilibre tel que J1 轢2 = J2 轢1, c’est-à-dire que le transport s’annule. Les concentrations C1 et C2 sont déterminées par la relation de Nernst, soit:

où C1 = C2 si z = 0.
Un transport actif , au contraire, maintient l’inégalité des deux flux et se poursuit indéfiniment tant que la cellule peut mobiliser des réserves métaboliques. Le transport actif, supposant la mise en œuvre de réactions chimiques complexes, est également réalisé par liaison de la substance transportée avec un transporteur spécifique. Au contraire d’un transport passif, il est très étroitement dépendant du métabolisme. Si l’équation (2) n’est pas vérifiée et si la relation avec le métabolisme est établie, on peut conclure à la présence d’un transport actif.
Transport des électrolytes
La différence de composition entre les milieux intracellulaire, extracellulaire et externe est maintenue par les transports actifs et passifs réalisés par les membranes vivantes.
La membrane de la fibre nerveuse fournit un exemple d’une telle activité [cf. ÉLECTROPHYSIOLOGIE]. Lorsque la fibre n’est pas parcourue par un influx nerveux, les ions K+ et Cl- sont approximativement à l’équilibre thermodynamique, mais les gradients électrique et chimique sont tels que les ions sodium Na+ tendent en permanence à envahir l’intérieur de l’axone: l’équilibre n’est maintenu que parce que le flux passif , entrant, de ces ions est compensé par une sortie active effectuée par une «pompe» à sodium membranaire. Cette situation n’est pas particulière à la cellule nerveuse; elle se retrouve pratiquement dans toutes les cellules animales et également au niveau d’épithéliums où une pompe sodium/potassium fonctionne entre les faces muqueuse et séreuse.
Les travaux de Ussing et de ses collaborateurs sur la peau de grenouille, isolée et «court-circuitée», non seulement démontrent l’existence de cette pompe, mais encore fournissent un moyen commode d’enregistrer le transport actif de sodium (fig. 8). Dans cette préparation on annule le gradient électrochimique entre les deux faces de la membrane. Pour tout ion transporté passivement dans ces conditions (par exemple Cl-), le rapport des flux devient égal à 1 (J1 轢2 = J2 轢1) et le flux net s’annule. Seul le sodium fait exception: la peau continue à le faire passer du liquide muqueux vers le liquide séreux, le flux muqueux-séreux étant largement supérieur au flux séreux-muqueux (Jms 礪 Jsm ). Le flux net de sodium est donc actif. De plus, la peau est alors parcourue par un courant électrique, dit de court-circuit, dont l’intensité est précisément égale à celle des charges positives véhiculées par ce flux net. Il suffit donc d’enregistrer le courant de court-circuit pour connaître à chaque instant la valeur du transport actif de sodium (Jn ). Ce transport, inhibé par les poisons métaboliques et l’anoxie, est, au contraire, stimulé par certaines substances telles que les hormones neurohypophysaires.
Dans de nombreux cas, on a démontré que l’efflux actif du sodium et l’influx actif du potassium sont liés à l’activité d’une enzyme membranaire qui hydrolyse l’ATP et fournit ainsi l’énergie nécessaire. Cette pompe transporte à la fois des ions sodium et potassium, d’où son nom de Na/K-ATPase.
D’autres ions inorganiques font l’objet d’un transport actif: c’est par ce mécanisme que le calcium est absorbé par la paroi intestinale, le chlore sécrété par la muqueuse gastrique (qui fabrique de l’acide chlorhydrique), le potassium évacué par les tubes de Malpighi des Insectes, etc.
Transport de l’eau
L’eau se meut par osmose à travers les membranes dès lors qu’une différence de pression osmotique existe entre les deux faces (cf. OSMORÉGULATION, chap. 1). Étant incompressible, l’eau crée un excédent de pression hydrostatique dans le compartiment vers lequel s’effectue ce transfert, en même temps qu’elle le dilue. On admet, en général, que l’eau est transportée uniquement passivement et conformément aux lois de l’osmose. En effet, un transport actif d’eau serait trop coûteux en énergie pour que, sauf cas exceptionnel, il ait pu être retenu au cours de l’évolution de la vie terrestre.
On a observé (au niveau du tubule proximal rénal, de l’intestin, de la vésicule biliaire, etc.) des transports d’eau s’effectuant en l’absence d’un gradient osmotique ou même vers le milieu le plus dilué. On a cependant pu démontrer dans la majorité de ces cas qu’il ne s’agissait pas d’un transport actif d’eau, mais d’un transport passif provoqué par la mise en jeu d’une pompe ionique. Dans ces structures, la pompe à sodium crée localement, dans la membrane, une atmosphère hyperosmotique qui entraîne un appel d’eau à partir du liquide muqueux; cette eau s’accumule, puis se déplace en masse, avec le sel, vers le milieu séreux. On dit que l’eau ainsi déplacée est «liée au soluté» qui fait l’objet d’un transport actif.
Transport des substances organiques
Les travaux de R. Collander et de C. E. Overton sur les végétaux ont établi que de nombreuses substances organiques pouvaient franchir les membranes vivantes. En règle générale, mais non absolue, ces substances pénètrent d’autant plus facilement qu’elles sont plus liposobubles (en raison de la structure lipoprotéique de la membrane) et que leur molécule est plus petite (les grosses protéines, sauf exception, ne traversent pas et restent à l’intérieur des cellules). Certaines (comme les sucres ou les acides aminés), absolument indispensables aux cellules vivantes, sont transportées via les membranes.
Les sucres montrent un exemple de l’extraordinaire sélectivité membranaire. Seuls les monosaccharides passent facilement, mais les hexoses sont admis plus aisément que les pentoses. Malgré la présence de nombreux groupements 漣 OH dans leur molécule [cf. GLUCIDES], donc malgré leur très faible liposolubilité, ils sont transportés à grande vitesse à travers les parois cellulaires (bactéries) et épithéliales (intestin). Ce transfert, qui présente une saturation, c’est-à-dire une vitesse maximale comme dans la diffusion facilitée, est assuré par combinaison du sucre avec un transporteur membranaire. Le phénomène est actif. La concentration du sucre dans le compartiment récepteur atteint une valeur très largement supérieure à celle du milieu externe d’incubation. Le transport est supprimé par l’anaérobiose et les poisons du métabolisme respiratoire.
Chez les bactéries, l’ensemble des transporteurs spécifiques des sucres a été appelé perméases par G. N. Cohen et J. Monod. Ces substances peuvent être naturellement présentes, donc faire partie du matériel constitutif de la bactérie. Elles sont, au contraire, absentes chez certains mutants, mais on peut provoquer leur apparition (induction ) en cultivant les bactéries en présence du sucre substrat choisi. Leur présence ou leur absence dépend donc de l’équipement génétique de la cellule; leur synthèse peut d’ailleurs être bloquée par des inhibiteurs de la synthèse protéique.
Au niveau de l’intestin, le transport des sucres est lié à celui du sodium, les deux phénomènes se facilitant mutuellement. Le transport du glucose et du sodium est un mécanisme actif secondaire, l’activité de leur symport étant fonction du gradient électrochimique de sodium créé par le fonctionnement de la Na/K-ATPase.
Le transport des acides aminés présente de nombreuses similitudes avec celui des sucres.
En conclusion, si la cinétique des échanges transmembranaires (c’est-à-dire les variations de leur amplitude) peut être mesurée avec une grande précision, le mécanisme de la translocation des substances à travers la membrane fait intervenir l’étude structurale de celle-ci.
3. Membranes et phénomènes bioénergétiques
Importance bioénergétique des membranes
Il est intéressant de souligner une propriété commune à de très nombreuses membranes biologiques: presque toutes renferment en effet des molécules transporteurs d’électrons, constituant des systèmes oxydoréducteurs intramembranaires. On peut distinguer parmi ces transporteurs deux grandes catégories: les transporteurs d’hydrogène (donc de protons et d’électrons), tels les flavoprotéines ou les composés quinoniques, et les transporteurs d’électrons , telles les métalloprotéines à fer ou cuivre. Ces deux types de transporteurs coexistent généralement dans les biomembranes et s’agencent dans la phase lipidique isolante de ces membranes pour constituer des circuits intégrés où les électrons voyagent en suivant le gradient électrique des potentiels d’oxydoréduction, allant des potentiels les plus négatifs vers les potentiels les plus positifs.
Certaines membranes (thylakoïdes des chloroplastes, membranes pourpres des bactéries halophiles) renferment en plus des transporteurs cités ci-dessus des pigments photosensibles, captant certaines radiations lumineuses. Ces pigments transforment l’énergie lumineuse ainsi captée en énergie électrique. Les systèmes de pigments «excités» par la lumière portent en effet quelques-uns de leurs électrons à des potentiels très négatifs, ce qui déclenche dans les membranes une active circulation de ces électrons vers des accepteurs de potentiels plus positifs.
Dans certaines membranes, les transferts d’électrons s’accompagnent d’échanges transmembranaires de protons . Ces échanges, lorsqu’ils existent, créent une force électromotrice (protomotrice) susceptible d’être récupérée par des molécules de couplage: ce sont les ATPases réversibles (ADP-phosphokinases) qui permettent la synthèse endergonique (consommatrice d’énergie) d’adénosine-tri-phosphate (ATP), marquant le gain d’énergie chimique obtenu par un organite (mitochondrie ou chloroplaste) lorsque des électrons circulent dans ses membranes. Inversement, l’hydrolyse de l’ATP par des ATPases membranaires (celles qui sont situées dans le plasmalemme, par exemple) peut fournir l’énergie nécessaire à des échanges transmembranaires de protons ou de cations (symport) aussi bien qu’à des contre-échanges d’anions (antiport) venant contrebalancer les flux précédents, pour des raisons d’équilibre électrique. Les transferts d’électrons dans les membranes occupent donc une place centrale dans toute la bioénergétique cellulaire.
Nous étudierons successivement les principaux systèmes de transferts d’électrons, aujourd’hui connus, dans les membranes des mitochondries, des chloroplastes ou du réticulum endoplasmique ainsi que dans les membranes des bactéries.
Transferts électroniques et bioénergétique
Tout être vivant est traversé en permanence par un flux d’énergie; l’alimentation continue en énergie sert, dans chaque cellule, à couvrir de constantes dépenses énergétiques. Ces dépenses sont occasionnées par la synthèse des corps innombrables du métabolisme cellulaire, le remplacement des molécules constitutives des structures, éliminées par le renouvellement cellulaire (turn-over ), le maintien de la cohérence des innombrables structures «dissipatives» (consommatrices d’énergie) réalisées dans les systèmes thermodynamiques «ouverts» de la matière vivante. Ces dépenses énergétiques assurent également la déformation des éléments contractiles dans les cellules, donc les mouvements cellulaires et les contractions musculaires; les transmissions nerveuses, les pertes calorifiques des êtres vivants sont également source de dépense énergétique.
Trois phénomènes essentiels assurent l’alimentation en énergie des cellules: la respiration, la photosynthèse, la chimioautotrophie (ou chimiosynthèse). Du point de vue de la bioénergétique, ces trois phénomènes présentent une profonde analogie: tous trois font appel à des séries d’oxydoréductions qui se réduisent finalement à des transferts d’électrons intramembranaires. Avant de présenter ci-dessous, de manière plus détaillée, les transferts d’électrons liés à la respiration, à la photosynthèse ou encore à la chimioautotrophie, il peut être utile de rappeler brièvement quelques généralités sur l’énergétique des oxydoréductions biologiques (pour un exposé plus complet, cf. OXYDORÉDUCTIONS BIOLOGIQUES).
On désigne communément sous le nom d’oxydation soit une fixation d’oxygène sur un corps (Cu + 1/2 2CuO), soit une perte d’hydrogène par un corps (CH3 漣 CH2OHCH3 漣 CHO + H2), soit une perte d’électrons par un corps (Fe2+Fe3+ + le -). Cette troisième définition est la plus générale, et les deux premières s’y ramènent aisément: lors de la fixation de l’atome très électronégatif d’oxygène sur une molécule, des électrons quittent celle-ci pour prendre place sur une orbitale de l’atome d’oxygène; en revanche, le départ d’atomes d’hydrogène à partir d’un corps équivaut au départ de protons et d’électrons . On appelle donc oxydation une perte d’électrons et réduction le phénomène inverse, soit un gain d’électrons. La substance qui perd des électrons est appelée réducteur (red); en perdant n électrons, elle est transformée en substance oxydée, donc en oxydant (ox) éventuel.
Dans la nature, quand une substance réduite perd des électrons (donc s’oxyde), ces électrons sont toujours recueillis par une autre substance, oxydante, qui se réduit. Tout transfert d’électron e met donc obligatoirement en jeu deux composés (l’un donneur, l’autre receveur) formant un couple d’oxydoréduction:

Potentiel d’oxydoréduction
Une électrode inattaquable (platine) plongée dans une solution contenant un couple d’oxydoréduction prend un potentiel d’équilibre E (exprimé en volts), dit potentiel d’oxydoréduction, donné par la formule de Nernst:

R est la constante des gaz parfaits (8,32 J.K-1 練 mol-1), F est le faraday (9,65 憐 104 C 練 mol-1), n est le nombre d’électrons échangés.
Dans cette formule, E0 est le potentiel normal du système mesuré à mi-réduction , lorsque les concentrations ox et red sont égales. En bioénergétique, on désigne ce potentiel normal sous le nom de potentiel standard (E 0 lorsqu’il est mesuré à pH = 7 et à 25 0C).
Nous utiliserons ci-dessous les E 0 des couples d’oxydoréduction membranaires.
Énergie libre récupérable lors d’un transfert d’électrons
Le déplacement d’un électron est nécessairement orienté d’un potentiel électronégatif vers un potentiel plus électropositif. On peut évaluer la variation d’énergie libre ( G 0) qui résulte de cette transition électronique comme étant directement proportionnelle à la différence du potentiel d’oxydoréduction entre les deux couples oxydoréducteurs:

Lorsque E 0 est exprimée en volts, F en joules, G 0 est exprimée en joules.
Très grossièrement, on peut diviser les réactions du métabolisme cellulaire en deux catégories: celles qui nécessitent un apport énergétique pour se dérouler (réactions endergoniques) et celles qui se déroulent spontanément avec libération d’énergie libre dans le milieu (réactions exergoniques). La transition d’un électron d’une zone de potentiel électronégatif vers une zone de potentiel plus électropositif constitue globalement une réaction exergonique. Si l’énergie libre délivrée, lors de la transition précédente, permet le déroulement d’une réaction endergonique, les deux réactions fonctionnent simultanément: elles sont dites couplées. Dans tous les phénomènes décrits ci-dessous, certains transferts d’électrons intramembranaires, entre des systèmes oxydoréducteurs de potentiels différents, pourront être couplés avec des biosynthèses endergoniques de composés «riches en énergie».
Transferts électroniques et structure membranaire
Les zones de potentiel différent, entre lesquelles voyagent les électrons impliqués dans les processus bioénergétiques, sont parties intégrantes des membranes. Les modèles moléculaires le plus récemment proposés pour rendre compte de l’architecture des membranes biologiques doivent donc tenir compte des exigences de la bioénergétique: existence possible de zones électriquement chargées à l’intérieur des membranes, coexistence nécessaire au sein d’une même membrane de zones de potentiels électriques différents, donc contiguïté nécessaire, dans les structures, de zones isolantes et de zones conductrices (formant éventuellement des réseaux de circulation électronique). Ces contraintes biophysiques doivent être respectées pour que l’on puisse expliquer le mécanisme intime du couplage énergétique au niveau des membranes, c’est-à-dire, très précisément, le mécanisme de la transduction d’énergie : récupération sous forme d’énergie potentielle chimique bloquée dans l’ATP de l’énergie libre ( G 0) délivrée par le passage des électrons des zones de potentiels relativement négatifs aux zones de potentiels plus positifs. La bioénergétique contemporaine vient de dégager à la fois un modèle moléculaire de membrane et une théorie du couplage énergétique qui permettent, de façon très complémentaire, de rendre compte de manière rationnelle du phénomène de transduction d’énergie au niveau des membranes. Cette nouvelle théorie du couplage évoquée est la théorie chimiosmotique de P. Mitchell, dont les éléments seront exposés plus loin, à l’occasion de la respiration puis de la photosynthèse. Le modèle moléculaire de membrane le plus universellement accepté aujourd’hui, et répondant parfaitement aux contraintes imposées par la bioénergétique cellulaire, est le modèle de Singer et Nicolson (cf. Le modèle membranaire «en mosaïque fluide» , in chap. 1).
L’originalité du modèle membranaire de Singer et Nicolson, tient aux possibilités dynamiques qu’il recouvre, à la diffusion latérale des lipides, au sein de chaque monocouche, à la diffusion latérale des protéines, déterminant des états de dispersion ou bien des états d’agrégation. La température et la fluidité des phases lipidiques contrôlent ces mouvements latéraux. En revanche, les mouvements transversaux (passage d’un lipide d’une monocouche à l’autre – «flip-flop» – ou bien rotation d’une protéine intégrée autour d’un axe horizontal, parallèle au plan de la membrane) sont pratiquement interdits pour des raisons physiques claires (répulsion des groupes hydrophiles chargés par les zones hydrophobes). De ces propriétés découlent un certain nombre de conséquences utiles pour la bioénergétique.
Toute membrane présente une zone centrale hydrophobe, isolante, infranchissable spontanément par les ions minéraux ou les protons. La théorie de Mitchell présuppose l’existence de cette barrière isolante pour expliquer le couplage énergétique. Toute membrane présente aussi, de part et d’autre de ce cœur hydrophobe, des zones hydrophiles où se pressent les têtes polaires des lipides et les protéines périphériques: toutes ces molécules sont mobiles et peuvent fort bien transporter des électrons. La distribution des molécules, tant lipidiques que protéiniques, étant asymétrique dans la membrane, des zones de potentiels électriques différents peuvent fort bien coexister, soudées par la zone centrale isolante. Enfin, l’existence de protéines intégrées, transmembranaires, formant des canaux entre les deux versants distincts des membranes, apporte une solution au franchissement des membranes par les protons ou au transfert des électrons entre zones de potentiels différents. Une autre solution consiste en un déplacement libre de petites molécules quinoniques au sein de la phase lipidique: de telles quinones existent dans les membranes mitochondriales et chloroplastiques.
Transferts d’électrons dans la membrane interne des mitochondries
Le catabolisme respiratoire des substrats carbonés (notamment du glucose) commence toujours par une phase anaérobie, se déroulant dans le cytoplasme des cellules (fig. 9). Au cours de cette première phase, le glucose est converti, par les réactions de la glycolyse , en deux molécules d’acide pyruvique. Celui-ci sert de substrat aux réactions du cycle des acides tricarboxyliques (ou cycle de Krebs) qui se déroulent à l’intérieur des mitochondries. La succession des réactions d’un «tour» de cycle de Krebs aboutit à l’oxydation complète de l’acide pyruvique. Les différentes décarboxylases et déshydrogénases mitochondriales intervenant dans cette oxydation réduisent des cofacteurs enzymatiques: 2 cofacteurs flaviniques (FADH2) et 8 cofacteurs pyridiniques (NADH + H+). Pour que les processus respiratoires ne s’interrompent pas, il est nécessaire que les cofacteurs ainsi réduits soient ensuite ramenés à l’état oxydé. Ce processus de réoxydation des cofacteurs est effectué dans les mitochondries sur les crêtes de la membrane interne de ces organites. Dans ces membranes, les électrons (et les atomes d’hydrogène) arrachés aux substrats respiratoires sont transportés jusqu’à un accepteur final: l’oxygène moléculaire , capté dans l’atmosphère. Ce transfert des électrons au sein des membranes internes des mitochondries a deux conséquences: le processus permet la régénération à l’état oxydé des cofacteurs précédemment réduits, et donc la poursuite ininterrompue du catabolisme respiratoire; les chutes de potentiel électrique accompagnant les transferts d’électrons libèrent suffisamment d’énergie libre pour que soit réalisée grâce à un couplage approprié la biosynthèse endergonique d’ATP K: c’est la phosphorylation oxydative . Ainsi s’effectue la récupération d’énergie par les cellules, lors des processus respiratoires.
Les quatre complexes de transporteurs d’électrons
La membrane interne de la mitochondrie peut être fractionnée au laboratoire en de multiples petits fragments. Pour obtenir ce résultat, on combine l’action de détergents (tel le désoxycholate de sodium) et des précipitations de protéines au sulfate d’ammonium. Les petits fragments de membrane interne peuvent être regroupés en quatre catégories distinctes, contenant des transporteurs d’électrons différents. Ces quatre types de fragments forment les quatre complexes de transporteurs d’électrons présents dans la membrane interne des mitochondries. La composition de ces complexes est donnée dans le tableau 4.
Les molécules transporteurs d’électrons
Ce sont essentiellement des méthodes spectrophotométriques qui ont permis de mettre en évidence et d’identifier les molécules transporteurs d’électrons présentes dans les membranes des mitochondries. La spectrophotométrie de différence (cf. OXYDORÉDUCTIONS BIOLOGIQUES, fig. 4) est la méthode la plus utilisée: cette technique consiste à étudier les spectres d’absorption in vivo des constituants mitochondriaux, en enregistrant à chaque longueur d’onde les différences entre l’absorption des constituants présents à l’état totalement réduit et l’absorption de ces mêmes constituants à l’état totalement oxydé . Des «bandes de réduction», caractéristiques des divers constituants, apparaissent sur les spectres de différence, ce qui permet de les identifier.
Ainsi ont été mises en évidence, dans les membranes internes des mitochondries, des flavoprotéines . Ces enzymes contiennent des groupements flaviniques comme groupements prosthétiques: ce sont la flavine-adénine-dinucléotide (FAD) ou bien la flavine-adénine-mononucléotide (FMN). La fraction active des parties riboflaviniques est le noyau isoalloxazine (cf. OXYDORÉDUCTIONS BIOLOGIQUES, fig. 3).
Les déshydrogénases flaviniques les plus importantes sont la NADH-déshydrogénase à FMN, la succinodéshydrogénase à FAD, et les dihydrolipoyldéhydrogénases du pyruvate et de l’ 見-cétoglutarate.
Toujours par spectrométrie de différence, sept cytochromes différents ont été identifiés dans les divers complexes de transporteurs d’électrons. Certains de ces cytochromes ont été isolés. Il s’agit de protéines transporteurs d’électrons contenant du fer inclus dans un groupe hème. L’atome métallique présente des changements réversibles de valence Fe2+ 曆 Fe3+ + e - au cours des cycles d’oxydoréduction. Le dernier cytochrome de la chaîne mitochondriale, réagissant directement avec l’oxygène, est le cytochrome a 3 (tabl. 5). La spectrométrie de résonance paramagnétique électronique à basse température a permis de mettre en évidence dans les membranes internes des mitochondries un certain nombre de protéines à fer non hèmique . Ces protéines contiennent du fer et du soufre en quantités équimoléculaires et fonctionnent comme transporteurs d’électrons en réalisant des transitions Fe2+/Fe3+ . Dans la chaîne mitochondriale de transport des électrons, il apparaît au moins sept centres fer-soufre différents.
Enfin, l’ubiquinone ou coenzyme Q participe aussi au transfert des électrons dans la membrane interne de la mitochondrie. La molécule possède une longue chaîne latérale isoprénique (cf. OXYDORÉDUCTIONS BIOLOGIQUES, fig. 3).
La chaîne mitochondriale de transport des électrons
Les contraintes thermodynamiques impliquent nécessairement que tous ces transporteurs se placent en série dans la membrane interne de la mitochondrie dans l’ordre des potentiels d’oxydoréduction croissants (mesurés à pH = 7, et au point de mi-réduction). Ainsi sont constituées les chaînes de transferts d’électrons des membranes internes des mitochondries animales (fig. 10 a) ou végétales (fig. 10 b). Des arguments supplémentaires en faveur de l’ordonnancement des divers transporteurs dans les chaînes mitochondriales sont fournis par les vitesses de réoxydation des divers transporteurs réduits lorsque l’on fournit de l’oxygène à des mitochondries initialement placées en anaérobiose (tabl. 6). Des travaux ont mis en évidence dans certaines mitochondries une voie de circulation des électrons jusqu’à l’oxygène insensible au cyanure.
Le couplage énergétique
À ce problème du couplage entre les transitions électroniques exergoniques et les synthèses endergoniques, l’hypothèse chimiosmotique formulée dès 1961 par le chercheur britannique P. Mitchell (prix Nobel, 1978) donne une réponse ingénieuse. Les éléments majeurs de la théorie sont les suivants:
– Les transports intramembranaires d’électrons se produisent dans un système clos (fig. 11) divisant l’espace mitochondrial en compartiment externe (intermembranaire) et en compartiment interne (matrice).
– Les chaînes de transport des électrons comprennent toutes des transporteurs d’hydrogène et des transporteurs d’électrons, disposés en série.
– Le transfert des seuls électrons vers l’accepteur terminal (oxygène) a pour conséquence le prélèvement de protons dans le compartiment interne et la libération de protons dans le compartiment externe.
– Comme la membrane est rigoureusement imperméable aux protons , il s’ensuivra une différence de pH de part et d’autre de la membrane. Cette différence de pH ( pH) se combine à la différence de potentiel ( 切) existant de part et d’autre de la membrane pour donner une force protomotrice ( p):
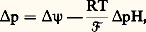
R = constante des gaz parfaits; T = température absolue; 杻 = équivalent énergétique du faraday.
– Cette force protomotrice met en action une ATPase membranaire fonctionnant réversiblement: l’énergie est récupérée pour effectuer la phosphorylation endergonique de l’ADP:

– L’ATPase membranaire a des propriétés vectorielles: les protons résultant de la synthèse de l’ATP sont déversés dans la matrice, tandis que les ions OH- sont rejetés dans le compartiment intermembranaire. Le résultat final de ces mouvements de H+ et de OH- est l’annihilation du gradient de protons créés par le transfert des électrons.
La bonne preuve expérimentale de la validité de cette théorie est apportée par les expériences de découplage artificiel des phosphorylations oxydatives. La plupart des agents découplants (dinitrophénol, valinomycine, gramicidine) sont des agents ionophores qui augmentent la perméabilité des membranes aux protons: dans ces conditions, le transfert des électrons persiste (ou même est accéléré) tandis que l’ATPase ne fonctionne plus puisque la force protomotrice a disparu.
Les développements récents de la théorie de Mitchell concernent le mécanisme même du fonctionnement de l’ATPase; ils provoquent encore d’ardentes discussions. Il faut bien dire cependant que le langage mitchellien est devenu celui de la bioénergétique contemporaine.
Transferts d’électrons dans la membrane du thylakoïde
Ces transferts s’effectuent au cours des premières réactions (photochimiques) de la photosynthèse (fig. 12).
Les chlorophylles a et b groupées dans les deux photosystèmes (PS I contenant le pigment photo-ionisable P700 et PS II contenant le pigment photo-ionisable P680) sont excitées par la lumière. Les électrons éjectés des deux pigments photo-ionisables sont portés à des potentiels d’oxydoréduction plus négatifs que ceux des photosystèmes initiaux (fig. 12). Des transferts d’électrons vers des accepteurs de potentiels plus positifs s’organisent, dès lors, dans la membrane du thylakoïde. Chacun de ces transferts peut donner lieu à une phosphorylation couplée d’ADP: on parle donc de photophosphorylation associée au transfert des électrons libérés par photo-ionisation.
Photophosphorylation non cyclique : les deux photosystèmes sont excités simultanément. Les électrons partis du PS II sont recueillis successivement par une substance Q (mal identifiée), le cytochrome b 559, une plastoquinone (PQ, fig. 12); le cytochrome f , la plastocyanine (métallo-protéine contenant du cuivre) et finalement par le pigment ionisé P+700 qui sert d’accepteur terminal. Le pigment ionisé P+680 (créé par l’excitation du PS II) est un agent oxydant extrêmement puissant: il provoque la photo-oxydation de l’eau avec libération d’oxygène moléculaire. Les électrons partis du PS I sont recueillis par un accepteur primaire X mal identifié, d’où ils passent sur la ferredoxine (protéine à fer non hèmique et à soufre), sur une flavoprotéine (ferredoxine-oxydase) et finalement sur le NADP+ qui est l’accepteur terminal. Au total, cette photophosphorylation non cyclique peut être résumée par l’équation:

Photophosphorylation cyclique : dans ce deuxième type de transfert d’électrons, seul le PS I de la membrane thylakoïdale est excité (par les rayonnements de longueurs d’onde supérieures à 680 nm). Partis du pigment photo-ionisé P+700, les électrons y retournent, après avoir effectué un circuit passant par la substance accepteur X, le cytochrome b 559, une plastoquinone, le cytochrome f et le plastocyanine. La chute de potentiel accompagnant le transfert PQcyt f permet la biosynthèse endergonique d’un ATP. Au total, on peut donc résumer la photophosphorylation cyclique par l’équation:

Les transporteurs d’électrons de la membrane thylakoïdale ont été identifiés par les mêmes techniques spectrophotométriques que celles utilisées pour les mitochondries. L’ordre de placement des transporteurs dans les circuits (fig. 13) a été établi de la même façon que pour les mitochondries.
Le couplage énergétique dans le chloroplaste
Les conceptions mitchelliennes s’appliquent parfaitement aux photophosphorylations (fig. 13). La membrane thylakoïdale est imperméable aux protons. Les transporteurs d’électrons sont disposés dans cette membrane de façon asymétrique: le P680 et la protéine Z (contenant du manganèse), responsable de la photo-oxydation de l’eau, sont situés sur la face interne de la membrane (regardant l’intérieur du thylakoïde). La ferredoxine est située sur la face externe (face au stroma). La plastoquinone est une petite molécule voyageant assez librement dans la phase lipidique. Il s’ensuit que l’excitation des photosystèmes déclenchant les transferts d’électrons entraîne la libération de protons à l’intérieur du thylakoïde et la capture de protons à l’extérieur, dans le stroma. Une différence de pH de part et d’autre de la membrane accompagne donc inéluctablement la circulation intramembranaire des électrons. Cette différence de pH crée une force protomotrice mettant en jeu une ATPase réversible à propriétés vectorielles. De l’ATP est synthétisé par cette enzyme, en même temps que des protons sont rejetés vers l’extérieur et des ions OH- vers l’intérieur du thylakoïde, ce qui détruit les gradients de pH précédemment formés.
L’application de la théorie chimiosmotique aux photophosphorylations reçut une de ses plus belles confirmations expérimentales en 1966. Cette année-là, Jagendorf et Uribe montrèrent qu’un gradient artificiel de pH appliqué à des chloroplastes à l’obscurité s’accompagnait d’une formation d’ATP en l’absence de tout transfert d’électrons. Ainsi était bien mise en évidence l’action de l’ATPase réversible sous l’effet d’une force protomotrice. Les cofacteurs, riches en énergie (ATP et NADPH), synthétisés au cours des réactions photochimiques de la photosynthèse, sont utilisés dans les réactions «sombres» (thermochimiques) du cycle de Calvin, pour la biosynthèse du glucose et de l’amidon.
Transductions d’énergie dans les membranes bactériennes
Bactéries halophiles
On trouve dans les eaux de salinité très élevée (marais salants, par exemple) des bactéries «halophiles» (Halobacterium halobium ) exigeant au minimum 15 p. 100 de chlorure de sodium dans leur milieu pour vivre; au-dessous de cette concentration, les cellules éclatent. Dans certaines conditions – à la lumière, lorsque la concentration d’oxygène devient limitante, par exemple lorsque la densité de la population est très élevée –, ces bactéries synthétisent et incorporent dans leur membrane un pigment pourpre, la bactériorhodopsine , complexe du pigment caroténoïde rétinal (fig. 14) et d’une protéine spécifique.
W. Stoekenius et ses collaborateurs, de l’université de Californie, ont montré que ce pigment pourpre constituait un système original de récupération de l’énergie lumineuse par les bactéries en difficulté. Le complexe rétinal-protéine absorbe la lumière (pic d’absorption à 560 nm). L’absorption des photons déclenche une isomération cis-trans dans la molécule de pigment, ce qui d’une part provoque la décoloration du pigment et d’autre part change la conformation de la protéine associée (la forme pourpre est spontanément régénérée à l’obscurité). Or, les changements provoqués par l’illumination s’accompagnent de mouvements de protons transmembranaires: il y a émission de protons dans le milieu lors de la décoloration, fixation de protons et retour au pH initial à l’obscurité. La membrane pourpre des bactéries halophiles est ainsi une véritable pompe à protons fonctionnant sous l’effet de la lumière. La force protomotrice résultant de l’éjection des protons à la lumière provoque la biosynthèse endergonique couplée d’ATP, par une ATPase membranaire, fonctionnant réversiblement. Racker et Stoekenius ont construit un système modèle de cette réaction en réalisant des vésicules constituées de phospholipides, de bactériorhodopsine et d’ATPase. Ces vésicules illuminées se sont révélées capables de synthétiser de l’ATP.
Bactéries chimioautotrophes
Un certain nombre d’espèces bactériennes peuvent se développer de manière autotrophe, en milieu entièrement minéral, sans posséder aucun système capteur d’énergie lumineuse. Comme les bactéries photosynthétiques, ces bactéries chimioautotrophes fixent le C2 du milieu (par un cycle analogue au cycle de Calvin) pour synthétiser leurs composés organiques. À la différence des bactéries photosynthétiques (ou phototrophes), cependant, les bactéries chimioautotrophes s’alimentent en énergie par le jeu d’oxydoréductions couplées à des biosynthèses d’ATP; ces phosphorylations oxydatives particulières mettent en jeu l’oxydation par les bactéries de substrats entièrement minéraux (sels ammoniacaux, SH2, sulfites, sels ferreux, hydrogène).
Prenons l’exemple des bactéries de la nitrification, bactéries du sol jouant un rôle capital dans le déroulement du cycle de l’azote. Les bactéries nitreuses (Nitrosomonas sp.) couplent l’oxydation des sels ammoniacaux à la biosynthèse endergonique de l’ATP:

Les bactéries nitriques (Nitrobacter sp.), qui agissent ensuite dans le sol, couplent l’oxydation des nitrites à la synthèse de l’ATP:

Ces phosphorylations oxydatives spéciales aux bactéries chimioautotrophes mettent en jeu des transferts d’électrons entre divers systèmes oxydoréducteurs membranaires. On doit cependant à la vérité de dire que ces systèmes sont pour le moment largement inconnus.
Transferts d’électrons et passage transmembranaire des ions
Les conceptions de Mitchell s’appliquent encore à un autre domaine de la bioénergétique cellulaire: celui du transport des ions à travers les membranes. Dans la mesure où les transferts d’électrons intramembranaires entraînent des échanges transmembranaires de protons, deux types de flux ioniques peuvent être associés à ces courants:
L’antiport des protons et des ions : si des protéines translocateurs d’anions se trouvent dans les membranes où ont lieu les transferts d’électrons, on peut facilement imaginer que des anions migrent en sens inverse du flux de protons créés par le transport des électrons. Dans la membrane interne de la mitochondrie, par exemple, Lehninger et ses collaborateurs ont ainsi étudié des flux d’ions phosphate ou carbonate opposés au flux de protons lié à la respiration cellulaire (fig. 15). Ces flux d’anions entraînaient secondairement une entrée de calcium dans la mitochondrie, parce qu’un translocateur de calcium est également présent dans la membrane interne. Ainsi, se réalisent des transports actifs , indépendants des gradients de concentration des ions, mais liés étroitement à la respiration cellulaire, donc à la bioénergétique. Il est évident que les transports ioniques finissent par annihiler la «force protomotrice» créée par la circulation des électrons dans la membrane interne des mitochondries et empêchent donc toute formation d’ATP à ce niveau. L’énergie libre délivrée par la circulation intramembranaire des électrons est utilisée pour le «transport actif» des ions (l’entrée du calcium dans les mitochondries a un effet découplant). Dans les exemples cités ci-dessus, l’ATPase réversible se trouve court-circuitée.
Le symport des protons et des ions : dans certaines membranes, des ATPases peuvent être présentes, mais les chaînes de transporteurs d’électrons peuvent manquer. Dans ces conditions, c’est l’hydrolyse de l’ATP qui provoque l’échange transmembranaire de protons (fig. 16). La force protomotrice créée par l’hydrolyse de l’ATP peut provoquer directement des mouvements de cations, si l’ATPase est elle-même le translocateur de cations (fig. 16). C’est le cas par exemple de l’ATPase stimulée par les ions Na+ et K+ présente dans les membranes cytoplasmiques animales: l’hydrolyse d’une molécule d’ATP provoque la sortie simultanée de 3 ions Na+ et l’entrée de 2 ions K+ (cette stœchiométrie ainsi que les sens des transports sont fixes). On connaît aussi dans les membranes du réticulum endoplasmique des fibres musculaires des ATPases stimulées par le calcium.
Transferts d’électrons dans les membranes du réticulum endoplasmique
Quelques systèmes particuliers de transfert des électrons ont été décrits dans les membranes du réticulum endoplasmique des cellules. Ces transferts microsomaux ne s’accompagnent pas de conversions énergétiques. Les électrons partis de cofacteurs pyridiniques réduits (NADH ou NADPH) arrivent par l’intermédiaire de flavoprotéines et de cytochromes du type b (un cytochrome b 5 est universellement répandu dans les membranes du réticulum endoplasmique) jusqu’à des protéines-oxydases à fonction mixte . Ces protéines terminales utilisent l’oxygène moléculaire, en partie comme accepteur terminal d’électrons, en partie comme substrat d’une réaction associée. Certaines chaînes conduisent ainsi à la désaturation des acides gras (fig. 17). La désaturase (oxydase terminale à fonction mixte) est une protéine à turn-over rapide (demi-vie de 3 heures) et très sensible au cyanure qui l’empoisonne rapidement. D’autres chaînes microsomales conduisent à l’hydroxylation des drogues (processus de détoxification) ou des stéroïdes (fig. 17): la protéine terminale est alors un cytochrome particulier, le cytochrome P 450, dont la forme réduite a la propriété de former un complexe avec l’oxyde de carbone; ce complexe présente un maximum d’absorption à 450 nm.
Encyclopédie Universelle. 2012.