OXYGÈNE
L’oxygène (symbole O, numéro atomique 8) peut être considéré comme un des éléments fondamentaux de la chimie et de la biochimie (avec l’azote, le carbone et l’hydrogène), tant en raison de son rôle capital dans la respiration et la nutrition du règne animal et du règne végétal qu’en raison de celui de ses composés (l’eau, les sucres, l’anhydride carbonique).
L’ensemble de la croûte terrestre, de l’hydrosphère et de l’atmosphère en contient environ 50 p. 100. La croûte terrestre en contient 46,4 p. 100, principalement sous forme d’oxydes et de silicates. La masse d’oxygène atmosphérique est estimée à 120 憐 1013 tonnes pour une masse totale de 500 憐 1013 tonnes. Au niveau de la mer, les analyses les plus précises (0,005 p. 100) de la composition de l’air fournissent comme concentrations moyennes en volume 20,94 p. 100 pour l’oxygène et 78,03 p. 100 pour l’azote et, en masse, respectivement 23,14 et 75,63 p. 100.
Ces concentrations sont à peu près constantes jusqu’à une altitude de 100 kilomètres en dépit de la différence de densité vis-à-vis de l’azote, du fait du brassage permanent dû à la convection et à la turbulence. Au-delà, la concentration en oxygène moléculaire décroît au profit de l’ozone et de l’oxygène atomique, et même de celle des ions + et +2. L’oxygène est également présent dans les végétaux sous forme de cellulose, d’amidon, d’inuline, et le corps humain en contient 62,84 p. 100.
La consommation d’oxygène atmosphérique est équilibrée par l’assimilation chlorophyllienne des végétaux qui, sous l’action de la lumière, rejettent le gaz et absorbent l’anhydride carbonique.
Bien que la présence d’un constituant privilégié dans l’air ait été entrevue dès le XVIIe siècle, la découverte de l’oxygène est communément attribuée à Joseph Priestley et Carl Wilhelm Scheele, qui l’obtinrent par décomposition thermique de l’oxyde de mercure et du nitrate de potassium (1771-1772). Lavoisier l’identifia comme un nouvel élément en démontrant qu’il se combinait à la majorité des corps et il vérifia son rôle dans la respiration et les combustions (1772-1775). Constatant sa présence en de nombreux acides, il proposa le terme oxygène ( 礼﨡羽﨟, acide; 塚﨎益益諸, engendrer).
1. Caractéristiques physiques de l’oxygène
Isotopes, problème de la référence des masses atomiques
L’oxygène a été choisi, dès 1860, comme base de référence (O = 16) des masses atomiques; on ignorait à l’époque l’existence des isotopes. Or l’oxygène atmosphérique est un mélange de trois isotopes, 16O, 17O et 18O, dont les concentrations moyennes sont respectivement égales à: 99,758 p. 100; 0,037 4 p. 100 et 0,203 9 p. 100.
Ces concentrations varient d’ailleurs suivant la provenance des échantillons (tabl. 1). L’isotope 18 peut être obtenu assez difficilement par distillation fractionnée ou par réactions d’échanges. Des mélanges contenant 97 p. 100 d’oxygène 18 et 60 p. 100 d’oxygène 17 peuvent être obtenus en conjuguant plusieurs méthodes.
En dépit du fait que les êtres vivants consomment plus particulièrement de l’oxygène 16, la teneur en oxygène 16 de l’atmosphère est maintenue à peu près constante grâce à la production préférentielle d’oxygène 16 par l’assimilation chlorophyllienne.
La découverte des isotopes naturels de l’oxygène par William Francis Giauque et Herrick L. Johnston, en 1929, a eu pour conséquence de déplacer l’échelle des masses atomiques, basée arbitrairement sur l’oxygène naturel. Jusqu’en 1961, les deux échelles (O = 16,000 0 et 16O = 16,000 0) ont été utilisées; à cette date, on a choisi comme base l’isotope 12 du carbone (12C = 12,000 00). Le tableau 2 donne, suivant les échelles, les masses atomiques de l’oxygène et de ses isotopes.
Outre ces isotopes, on a synthétisé trois isotopes radioactifs dont les caractéristiques sont données au tableau 3.
Structure de la molécule d’oxygène
Si la configuration 1s 2 2s 2 2p 4 est la plus stable qui soit pour les huit électrons de l’oxygène atomique, la structure électronique de l’oxygène moléculaire n’a été définie qu’en 1931 par Linus Pauling. En effet, la répartition des électrons doit tenir compte de l’énergie de dissociation (491,15 kJ/mole), de la distance interatomique (0,1207 nm), de la forte réactivité chimique et surtout du paramagnétisme ( 﨑m = 0,994 -1) dû à la présence de deux électrons non appariés à spins parallèles. À l’heure actuelle, la structure admise est:

dans laquelle un simple doublet associé à deux ponts de trois électrons assure la liaison. Les orbitales moléculaires dans l’état fondamental 3 g - se répartissent ainsi:
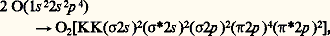
transformation illustrée par la figure 1.
Les orbitales d’antiliaison 神 2p y et 神 2p z sont dégénérées et d’énergie identique. Cette configuration est la plus stable (diminution de l’énergie de répulsion coulombienne) et respecte le paramagnétisme de l’oxygène. Il y a donc huit électrons de liaison ( 靖 2s )2, ( 靖 2p )2, ( 神 2p y )2, ( 神 2p z )2 et quatre électrons d’antiliaison ( 靖 2s )2, ( 神 2p y ), ( 神 2p z ). L’ordre de la liaison est donc égal à (8 漣 4)/2. L’orbitale 神 2p étant une orbitale d’antiliaison, l’élimination d’un électron augmente la force de la liaison; en effet, l’énergie de dissociation de +2 est égale à 6,48 eV alors qu’elle n’atteint que 5,114 eV pour la molécule 2. L’état fondamental 3 g - est suivi de deux états dits «singulets», 1 g + et 1 蓮g , métastables donc non radiatifs. La figure 2 indique l’occupation des orbitales.
Le paramagnétisme de l’état fondamental disparaît. La durée de vie, très courte pour l’état intermédiaire, peut atteindre 45 minutes pour l’état 1 g dont la distance interatomique est plus grande (0,122 3 nm au lieu de 0,120 7).
Bien que la section de capture électronique de l’oxygène soit plus faible que celle d’ionisation, l’énergie correspondante (face=F0019 黎 8 eV) est nettement plus basse que celle d’ionisation (12,075 eV); cela explique le caractère fortement électronégatif de l’oxygène dans les décharges électriques.
Propriétés thermodynamiques
Dans les conditions normales de température et de pression (TPN, T = 0 0C, P = 760 mmHg), l’oxygène est un gaz incolore et inodore. À l’état solide ou liquide, il présente une coloration légèrement bleutée. Les principales caractéristiques sont données au tableau 4.
À l’état normal, l’oxygène a une masse spécifique de 1,425 g/l, une chaleur spécifique de 29,37 J . mole-1 . K-1. C’est un gaz quasi parfait jusqu’à la pression de 15 atm environ.
Peu soluble dans l’eau (10,1 mg/l à 0 0C), il l’est beaucoup plus dans les alcools. Il est très soluble dans l’argent liquide: 22,4 litres d’oxygène par litre d’argent (phénomène du rochage dans la coupellation de l’argent), et faiblement dans le fer dont il modifie les propriétés.
Ce n’est guère qu’à partir de 3 000 K que commence la dissociation:

et pratiquement seule la décharge électrique permet d’atteindre une concentration notable d’oxygène atomique (tabl. 5).
2. Chimie de l’oxygène
L’oxygène est, sans aucun doute, l’un des éléments qui possèdent, tant dans le domaine de la chimie minérale que dans celui de la chimie organique, le plus grand nombre de composés dont plusieurs, en raison de leur spécificité ou de leur importance, sont décrits dans des rubriques particulières (eau, composés oxygénés de la chimie organique, etc.). L’action de l’oxygène a d’ailleurs donné naissance à des concepts fondamentaux en chimie tels que ceux d’oxydoréduction et de corrosion [cf. CORROSION]. On ne décrira ici que les propriétés générales des composés oxygénés en mentionnant certains d’entre eux qui font l’objet d’un intérêt scientifique ou industriel récent.
Réactions spécifiques de l’oxygène gazeux
Dans le tableau périodique, l’oxygène occupe la tête de la colonne VI des éléments dits chalcogènes (générateurs de métaux). À ce titre, il présente, dans la majorité de ses combinaisons, le degré d’oxydation 漣 2, notion qui caractérise un gain de deux électrons et qui a été étendu à de nombreuses réactions. Lorsque les réactions ont lieu avec un fort dégagement de chaleur, on les qualifie de combustions [cf. COMBUSTION], qui peuvent être vives (apparition d’une flamme) ou lentes. Rappelons quelques réactions parmi les plus spectaculaires:
– Les métaux alcalins et alcalino-terreux peuvent s’enflammer spontanément (surtout les alcalins) et fournissent des oxydes très stables et même réfractaires (MgO, CaO...).
– La plupart des métaux brûlent avec vivacité, et cela d’autant plus qu’ils sont finement divisés (Al, Cr, Mn, Fe, Co, Ni). Les métaux nobles ne sont, en revanche, pas attaqués directement, mais l’on parvient indirectement à leurs oxydes.
À l’exception des halogènes, les non-métaux brûlent dans l’oxygène; le bore donne B25, le soufre S2, le phosphore P25 (inflammation spontanée), le carbone CO qui s’oxyde en C2, le silicium Si2. Seul l’azote exige une température élevée (2 000 0C) pour se combiner à l’oxygène; la réaction est d’ailleurs endothermique:
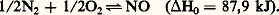
La réaction avec l’hydrogène:

a été très étudiée en raison de ses applications (chalumeau oxhydrique) et de son importance du point de vue de la sécurité; il en est de même des réactions avec les hydrocarbures (cf. chap. 3). À ce titre, il convient de rappeler que de nombreuses substances brûlent spontanément dans l’oxygène pur ou l’air enrichi; citons les graisses (qui sont à prohiber strictement dans les canalisations d’oxygène) et les tissus naturels (laine, coton) qui peuvent s’enflammer dès que la teneur dépasse 29 p. 100; de même, les fibres artificielles présentent les plus graves dangers (brûlures) lors de leur combustion.
À la température ambiante, l’oxydation est favorisée par la présence de certains catalyseurs ou de vapeur d’eau: c’est le cas du fer attaqué en profondeur par la rouille, contrairement à l’aluminium où la couche d’oxyde Al23 bloque la corrosion.
En résumé, tous les éléments de la classification, à l’exception des trois premiers gaz rares (He, Ne et Ar), se combinent à l’oxygène, et cela directement, excepté les halogènes, les métaux nobles, le krypton et le xénon.
Avec les composés, l’oxygène agit par addition (COC2, NO2, S2S3, FeOFe23) ou par substitution si la chaleur de formation du composé formé est supérieure à celle du produit décomposé.
En chimie organique, on procède à de nombreuses oxydations (cf. supra ) ménagées ou incomplètes en présence de catalyseurs. On substitue d’ailleurs à l’oxygène d’autres oxydants (ozone, eau oxygénée, permanganate, chlorate, etc.).
Certains composés, dits antioxygènes (Moureu et Dufraisse), agissent comme des inhibiteurs, tel l’hydroquinone. On les utilise pour bloquer le vieillissement du caoutchouc, des graisses et, dans les moteurs à explosion, pour éviter le cognement.
La présence d’oxygène se décèle dans un gaz par la formation d’un nuage blanc de P25 et par les colorations brunes prises par une solution de pyrogallol. Il existe de nombreuses méthodes de dosage: adsorption, volumétrie, pesée de l’eau formée après combinaison avec l’hydrogène, chromatographie, utilisation du paramagnétisme, etc.
Caractères des composés oxygénés
Les combinaisons binaires peuvent être classées suivant leur fonction: anhydrides d’acide, oxydes basiques, amphotères, salins, neutres, peroxydes et sous-oxydes. Une méthode plus générale consiste à différencier les composés oxygénés par la nature de la liaison. On peut distinguer les quatre classes suivantes:
– Liaison à caractère ionique ou hétéropolaire dans laquelle l’oxygène est sous la forme 2-. C’est le cas de nombreux oxydes métalliques du type M2O (alcalins), MO (alcalino-terreux et métaux de transition), des spinelles et ferrites MM2 4 et de certains oxydes comme Ti2, Al23, Mn23. Ils tendent généralement à cristalliser dans les systèmes les plus compacts possible et sont souvent très stables au point de vue chimique et thermique (Al23, BeO, CaO, MgO...).
– Liaison assurée par deux covalences simples (R 漣 O 漣 R) ou doubles (O = C = O), telles les combinaisons avec les non-métaux; c’est le mode de liaison le plus fréquent.
– Gain d’un électron associé à une simple liaison, tel l’ion hydroxyle OH-.
– Formation de deux ou trois liaisons covalentes (R2OH+).
Les composés du type R 漣 O 漣 R ne présentent pas des angles de 900 comme le laisserait supposer une liaison par orbitales p . En effet, les angles sont généralement supérieurs à 1090 (OCl2 黎 1130; (CH3)2O: 1110; 3: 1270), dénotant une hybridation sp 3 tétraédrique, plus ou moins modifiée par des interactions coulombiennes ou de Van der Waals.
Comme l’azote, l’oxygène a une tendance marquée à former des doubles liaisons du type p 神 漣p 神; c’est le cas des cétones, des acides carboxyliques et des gaz oxygénés courants: CO, CO2, 2O, NO, 2, 25, S2, S3...
Très fréquemment, certains composés présentent des structures de résonance entre l’oxygène à simple (face=F0019 漣O 漣) et à double liaison (=O); c’est le cas des composés oxygénés gazeux mentionnés ci-dessus.
Généralement, l’oxygène suit la règle de l’octet, et ses composés possèdent des liaisons ioniques ou covalentes; parfois on passe progressivement de l’un à l’autre mode.
Composés particuliers
Certains composés particuliers de l’oxygène ont été découverts il y a fort longtemps (l’eau oxygénée, par Thenard en 1818), et ont actuellement une grande importance industrielle; d’autres sont, en revanche, très récents.
Bien que le fluor soit encore plus électronégatif que l’oxygène (4 pour 3,5 dans l’échelle de Pauling), on est parvenu à synthétiser les fluorures d’oxygène de formule générale On 2(n = 1 à 6) à partir de mélanges d’oxygène et de fluor soumis à des décharges électriques à basse température (50 à 70 K) et sous pression réduite (10 à 20 mmHg). Ce sont naturellement des oxydants très actifs, en particulier 32, plus réactif que le mélange 2 + 2. Si la structure de 2 et de 22 est maintenant bien connue, il n’en est pas de même de celle des fluorures suivants. Ces composés ont été très étudiés en tant que comburant dans les propulseurs spéciaux.
Les peroxydes les plus courants sont les peroxydes alcalins (M2I2: Na22, K22) et alcalino-terreux (MII2: BaO2) obtenus par action directe de l’oxygène sur le métal. Ce sont naturellement des agents oxydants, libérant soit de l’oxygène soit de l’eau oxygénée. Les peroxydes, comme les superoxydes alcalins (MI2: KO2), possèdent la propriété remarquable de réagir avec l’eau et le C2 en libérant l’oxygène:

Ces propriétés sont utilisées dans des appareils de respiration autonomes.
Il existe également des peroxydes organiques comme CH3COOOH (acide peracétique), obtenu par action de l’eau oxygénée sur l’anhydride correspondant. Ils sont utilisés comme oxydants en chimie organique et comme sources de radicaux libres.
Le caractère oxydant étant le plus utilisé dans la pratique industrielle, il convient de mentionner le peroxyde d’hydrogène (eau oxygénée H22) parmi les composés remarquables de l’oxygène. Sa préparation s’effectue à l’aide du procédé dit à l’anthraquinone, qui revient en définitive à effectuer la synthèse H2 + 2H22. La molécule ne présente pas une structure plane, mais s’inscrit dans un dièdre d’arête 漣O 漣O 漣, dont chaque face contient un atome d’hydrogène. Les propriétés physiques et chimiques sont bien connues, H22 ayant été utilisée comme comburant propulsif (fusées V2 allemandes, 1945). Suivant le milieu acide ou basique, H22 présente un caractère oxydant ou réducteur plus ou moins marqué, le premier étant le plus utilisé (2 H222 H2O + 2). Le produit commercial est caractérisé par la teneur en H22 en solution aqueuse. Exprimées en masse, les concentrations usuelles du produit commercial varient de 30 à 70 p. 100. Ce peroxyde est utilisé en chimie organique comme décolorant pour les fibres textiles et papetières, et également dans la fabrication du perborate de sodium, constituant important des lessives ménagères.
3. Principales utilisations de l’oxygène
Même au laboratoire, on ne s’adresse plus guère, pour la préparation de l’oxygène, aux méthodes fondées sur la décomposition du chlorate ou du permanganate de potassium, de l’oxylithe (Na22, K24), etc. À partir de la distillation fractionnée de l’air, l’industrie fournit un gaz de qualité courante (99,5 p. 100) ou ultra pure (99,998 p. 100) contenant moins de 20 volumes d’impuretés par million. L’oxygène est livré en bouteilles d’acier, à ogive blanche pour la France, contenant 10 Nm3 (m3 normaux) de gaz comprimé à 200 bars. Pour des quantités plus importantes, on transporte l’oxygène sous forme liquide dans des récipients isolants, et on emploie des évaporateurs fixes de grande capacité installés sur les lieux d’utilisation. Pour des centres de consommation élevée, la distribution se fait par canalisations (oxyducs). La carte ci-jointe représente les gazoducs installés dans le nord de l’Europe occidentale.
Dans un grand nombre de cas, pour les réactions d’oxydation en phase gazeuse ou les combustions (foyers domestiques et industriels), on n’emploie pas l’oxygène pur mais directement l’air atmosphérique.
La combustion à haute température
La présence du ballast d’azote dans les combustions avec l’air diminue considérablement l’enthalpie massique des produits de la combustion, donc la température des flammes et les vitesses de déflagration [cf. COMBUSTION], ces deux paramètres influant directement sur la puissance de chauffe (tabl. 6). C’est la raison pour laquelle le chalumeau oxyacétylénique est un outil universellement utilisé pour le soudage, le brasage, la trempe superficielle, etc. Une des opérations les plus spectaculaires réside dans le coupage des métaux; on se sert d’une buse spéciale comportant une injection centrale d’oxygène pur entourée d’une couronne de flammes oxyacétyléniques destinées à l’amorçage de la réaction qui, dans le cas des aciers, fournit un mélange d’oxydes fusibles (principalement Fe23). Cette technique permet de couper des épaisseurs atteignant un mètre et parfois plus dans certains cas. Elle est très employée dans les ateliers de chaudronnerie, dans les chantiers navals, etc. D’autre part, seules les combustions à l’oxygène pur permettent de travailler le quartz, certains métaux nobles (Pt, Re) et les oxydes réfractaires (CaO, MgO, Al23). Des brûleurs oxycombustibles sont utilisés dans de nombreux fours industriels.
L’oxygène en sidérurgie
L’affinage à l’oxygène de la fonte a pratiquement bouleversé cette industrie. Deux méthodes sont utilisées: soufflage à l’aide d’une lance au-dessus du bain (procédés L.D. et Kaldo), ou barbotage par insufflation à la base du convertisseur (procédé O.B.M.). On tend même à utiliser l’oxygène en amont de l’élaboration de l’acier dans celle de la fonte; on rajoute de l’oxygène dans les vents des hauts fourneaux. De même l’oxygène est employé dans l’élaboration des aciers spéciaux à l’aide de fours électriques et dans celle des métaux non ferreux.
L’oxygène dans l’industrie chimique
L’abaissement du prix de revient provenant de la fabrication en masse a permis d’utiliser l’oxygène dans plusieurs procédés de synthèse qui sont d’ailleurs en perpétuelle évolution suivant les impératifs économiques. On peut citer en chimie minérale: la synthèse de l’acide nitrique pur et concentré par oxydation de l’ammoniac (2 NH3 + 5/2 22 NO + 3H2O; NO + 1/2 22); la préparation de l’oxyde de titane par oxydation du chlorure TiCl4; la régénération du chlore par le procédé Deacon (2 HCl + 1/2 2 Cl2 + H2O); la délignification et le blanchiment de la pâte à papier par des mélanges (NaOH + 2); la préparation de l’acide cyanhydrique à l’aide du mélange NH3 + CH4 + 2.
Dans le cadre de la chimie organique, on peut signaler: la préparation de l’acétylène à partir de l’oxydation ménagée des hydrocarbures; l’élaboration du gaz de synthèse H2 + CO en vue de la préparation de l’ammoniac, du méthanol et des alcools oxo, la synthèse des oxydes d’éthylène (C2H4)2O et de propylène (C3H6)2O; la synthèse de l’acétaldéhyde, de l’acétate de vinyle, des acides acétique et formique, ainsi que du méthanal.
Mélanges respirables
L’oxygène est indispensable à la quasi-totalité des êtres vivants, animaux et végétaux. Chez l’homme, une diminution de 21 à 17 p. 100 de la teneur en oxygène conduit à des malaises, à l’évanouissement dès 9 p. 100 et à l’asphyxie entre 7 et 3 p. 100. Le maintien indispensable de la pression partielle d’oxygène est assuré en altitude supérieure à 3 000 mètres par l’inhalation d’oxygène pur ou d’air enrichi. Des mélanges spéciaux d’oxygène avec de l’azote, de l’hélium ou de l’hydrogène sont élaborés pour la plongée sous-marine. En thérapeutique, l’oxygène pur ou l’air enrichi est employé pour la réanimation des accidentés et pour soigner de nombreuses affections pulmonaires. Des mélanges oxygène-protoxyde d’azote (N2O) sont utilisés en anesthésie, et des caissons hyperbares contenant de l’oxygène pur permettent des opérations qui seraient irréalisables dans l’air ambiant.
Utilisation de l’oxygène liquide
Des cartouches, contenant de la paraffine, du naphtalène et de l’oxygène liquide, sont employées comme explosifs civils dans des travaux de percement. Mais la plus grande partie de l’oxygène liquide, en tant que tel, est utilisée comme comburant avec l’hydrogène dans les propulseurs spatiaux (2e et 3e étages des fusées).
Perspectives de l’utilisation de l’oxygène dans la dépollution
En raison de l’importance grandissante de la pollution, on songe à utiliser directement l’oxygène afin de rétablir l’équilibre biologique dans les eaux des rivières et des lacs. La solubilité de l’oxygène dans l’eau, quoique limitée, suffit à assurer la présence des micro-organismes qui par oxydation biologique éliminent les effluents industriels généralement organiques.
Devant l’accroissement de ces effluents (les rivières françaises charrient plus de 6 millions de tonnes par an de matières polluantes!), la concentration des micro-organismes oxydants n’est plus suffisante et a même tendance à baisser. Une des solutions consisterait à épurer les eaux polluées à l’aide d’oxygène et même à injecter directement ce dernier. De même, les divers effluents gazeux émis par les centrales thermiques et les industries chimiques peuvent être oxydés afin de condenser les composants les plus corrosifs.
4. L’ozone
État naturel et préparation
La plus stable des variétés allotropiques de l’oxygène, l’ozone, fut appelée ainsi en 1839 par Christian Friedrich Schönbein, en raison de son odeur caractéristique ( 礼﨣﨎晴益, exhaler une odeur). Ce n’est qu’en 1865 que Jacques-Louis Soret démontra l’existence d’une molécule 3 de masse 47,998 g par la prédominance de l’isotope 16 (cf. chap. 1). Sa concentration dans l’atmosphère est extrêmement faible (2 憐 10-8), mais sa présence revêt une importance primordiale. En effet, une couche située à environ 25 kilomètres d’altitude absorbe la quasi-totalité de la partie ultraviolette du spectre solaire qui éliminerait toute trace de vie, tout au moins sous sa forme actuelle. Le mode de formation le plus probable semble être par décharge électrique dans le dioxygène sec:
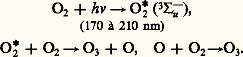
L’ozone se forme également dans de nombreuses réactions: décomposition de H22, dans l’arc électrique, par électrolyse, etc., mais la préparation industrielle ne repose plus que sur la décharge par effluve à haute tension (50 à 80 kV) dans l’air ou l’oxygène.
Structure et propriétés physiques
La structure spatiale de l’ozone est maintenant bien connue (fig. 3); c’est une molécule angulaire. En revanche, la nature des liaisons est encore discutée. En effet, la distance O 漣O est plus courte que celle d’une simple liaison (0,143 nm) mais supérieure à celle de la molécule 2 (0,121 nm). L’ozone présentera donc plusieurs structures de résonance dont les deux plus fréquentes sont indiquées à la figure 3.
Les principales caractéristiques physiques de l’ozone sont données par le tableau 7. Sous forte épaisseur, l’ozone présente une coloration bleue qui tend vers l’indigo à l’état liquide. Notons que le rapport Cp /Cv est égal à 1,29 au lieu de 1,33 pour les gaz triatomiques.
La solubilité de l’ozone dans l’eau est nettement supérieure à celle de l’oxygène: 0,52 l/l au lieu de 0,049 (à 0 0C); il est aussi très soluble dans les fréons 12 et 13.
Propriétés chimiques
La réaction de formation étant endothermique: 3 2 燎 2 3, H0 = 284,58 kJ, l’ozone ne serait stable qu’à haute température. Il convient donc de le maintenir dans un état métastable à la température ambiante, car il peut se décomposer parfois brutalement suivant le schéma: O32 + O, H0 = 102,53 kJ. Ce mécanisme peut être accéléré par la présence d’un tiers corps:

c’est le cas du chlore avec passage par CCl, du brome, de 25, du C2. Il peut l’être aussi par la présence d’un catalyseur hétérogène (charbon, métal):
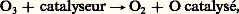
et celle d’un rayonnement approprié:

Le rendement quantique atteint 6,7 en ultraviolet.
De nombreuses réactions en phase gazeuse ont été étudiées, surtout du point de vue de la cinétique: celle du NO qui se transforme en NO2, lui-même oxydé en 25, de l’ammoniac qui donne NH43, et celles des halogènes. L’ozone attaque tous les métaux sauf l’or et le platine; l’argent, pratiquement inaltéré par l’oxygène, se recouvre d’une couche d’oxyde.
Dans de nombreux cas, c’est l’ozone lui-même qui joue le rôle d’un catalyseur d’oxydation vis-à-vis de l’oxygène qui l’accompagne. C’est le cas par exemple des réactions avec le sulfite de sodium et de certaines réactions organiques: oxydation des aldéhydes, des cétones, quinones, alcools et esters.
En solution aqueuse, les potentiels d’oxydoréduction de l’oxygène et de l’ozone sont, respectivement, en solution acide:

et, en solution basique:
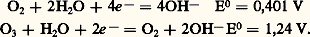
L’ozone est donc un agent oxydant des plus actifs, dépassé seulement par le fluor et l’oxygène atomique. Tous les sels métalliques sont oxydés à leur degré supérieur. L’eau oxygénée réagit comme agent réducteur (en milieu acide) et comme catalyseur:

La réaction sur l’iodure de potassium est encore utilisée pour le dosage de l’ozone:
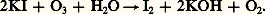
L’action de l’ozone sur les hydroxydes alcalins anhydres conduit à des composés dits ozonides contenant un ion 3-:
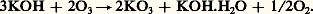
Les ozonides alcalins (Na, K, Rb, Cs) sont solubles dans l’ammoniac liquide et relativement stables (KO3 se décompose en onze jours). La décomposition fournit de l’oxygène et un superoxyde:
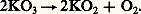
Ils réagissent vigoureusement avec l’eau:

À faible dose, l’ozone est utilisé comme désinfectant dans les atmosphères confinées. La concentration ne doit pas dépasser 0,2 mg/m3. Sur une grande échelle, il est essentiellement employé pour stériliser les eaux potables et tend à supplanter le chlore. On s’en sert également pour vieillir les alcools, pour fabriquer de la vanilline et pour blanchir certaines fibres.
En 1989, la production française d’oxygène était de 1,86 milliard de mètres cubes dont la majorité était utilisée pour la sidérurgie et la grosse mécanique. Aux États-Unis, le seul secteur chimie consommait plus de trois milliards de mètres cubes.
La mise en place de très grosses installations (2 000 tonnes par jour d’oxygène) a entraîné un abaissement des prix de revient et une expansion de la consommation.
oxygène [ ɔksiʒɛn ] n. m.
• 1783 oxigène; du gr. oxus « acide » et -gène
1 ♦ Élément métalloïde (O; no at. 8; m. at. 16), gaz invisible, inodore, qui constitue approximativement 1/5 de l'air atmosphérique. Combinaison avec l'oxygène. ⇒ oxyde; combustion, oxydation. L'ozone, modification allotropique de l'oxygène. L'oxygène est indispensable à la plupart des êtres vivants (⇒ D. B. O., D. C. O.) . Absorption de l'oxygène par l'organisme (⇒ respiration) . Dégagement d'oxygène des plantes à chlorophylle. Étouffer par manque d'oxygène (⇒ asphyxie; anoxémie, anoxie) . « Le médecin fit une piqûre de morphine et pour rendre la respiration moins pénible demanda des ballons d'oxygène » (Proust). Tente à oxygène. Masques à oxygène des avions. — Bouteille d'oxygène comprimé.
2 ♦ Par ext. Cour. Air pur, non pollué. Aller prendre un bol d'oxygène à la campagne. — Fig. Subvention ministérielle qui donne de l'oxygène aux P. M. E. Bouffée d'oxygène, ce qui aère, vivifie, ranime. Cette nouvelle fut pour lui une bouffée d'oxygène.
● oxygène nom masculin Corps gazeux diatomique (O2) constituant en volume le cinquième de l'atmosphère terrestre et nécessaire à la respiration. (Élément de symbole O.) Numéro atomique : 8 Masse atomique : 15,999 4 Température de fusion : − 218,4 °C Température d'ébullition : − 182,96 °C Densité : 1,105 Élément constitutif fondamental de la matière vivante, au même titre que le carbone, l'hydrogène et l'azote. Air pur, non pollué : Aller respirer l'oxygène à la campagne. Tout ce qui permet à quelque chose, à quelqu'un d'aller de l'avant, de progresser, de lui redonner du dynamisme, un souffle nouveau. (On dit aussi ballon d'oxygène.) ● oxygène (expressions) nom masculin Consommation d'oxygène, différence entre la quantité d'oxygène qu'un sujet inspire et celle qu'il expire. Explosif à oxygène liquide, explosif constitué par des matières combustibles solides imbibées d'oxygène liquide.
oxygène
n. m.
— Gaz (O 2: dioxygène) incolore, insipide et inodore.
d2./d Cour. Air pur. J'ai pris un bol d'oxygène à la montagne.
Encycl. L'oxygène est l'élément le plus abondant de la couche terrestre (89 % en masse des eaux naturelles et 47 % des roches). Il représente 21 % du volume de l'atmosphère et est indispensable à la vie. Les combinaisons de l'oxygène avec les autres éléments (sauf avec le fluor) s'appellent des oxydes. (V. ozone.)
⇒OXYGÈNE, subst. masc.
A. —Gaz incolore et inodore, existant à l'état libre dans l'atmosphère, dont il constitue approximativement un cinquième du volume, et qui est indispensable à la plupart des formes de la vie. L'oxygène est un comburant; transformer l'oxygène en ozone; ballon, bouteille d'oxygène; masque, tente à oxygène:
• 1. Les tissus vivants sont avides d'oxygène et l'arrachent au plasma sanguin. Ce qui signifie, en termes physico-chimiques, qu'ils ont un pouvoir réducteur élevé, qu'un système compliqué (...) leur permet d'employer l'oxygène atmosphérique à des réactions productrices d'énergie.
CARREL, L'Homme, 1935, p.93.
— CHIM. Élément métalloïde de symbole O, nombre atomique 8, qui, combiné avec différentes substances, forme les oxydes et les acides. L'azote et l'oxygène sont fréquemment désintégrés lorsqu'on bombarde ces gaz par un faisceau de neutrons du glucinium (LEPRINCE-RINGUET, Transmut. artif., 1933, p.34).
♦Empl. adj., vx. Gaz oxygène. J'ai commencé par m'assurer de la quantité de gaz oxygène qui avoit été employée, et par peser le ballon avant de l'ouvrir (LAVOISIER, Traité chim., t.1, 1789, p.63). La culture proprement dite a pour but: (...) De rendre le sol perméable à l'eau et à l'air, afin de le conserver frais, sans humidité surabondante, et de permettre au gaz oxygène de décomposer les engrais qu'il renferme (GRESSENT, Potager mod., 1863, p.234).
— P.métaph. [P.réf. à l'oxygène, élément nécessaire à la vie] La joie est l'oxygène moral de l'enfance (LA VARENDE, Don Bosco, 1951, p.16):
• 2. PIETRI: C'est pour patienter que vous avez perdu votre temps à me faire la conversation? GENEVIÈVE: Je n'ai pas perdu mon temps. Vous ne pouvez savoir quelle force cela m'a redonné d'entendre parler à nouveau de retraite hors classe, de manille, de plat d'ail. C'est une bouffée d'oxygène pour un organisme français.
GIRAUDOUX, Siegfried, 1928, IV, 1, p.158.
♦Oxygène de (+ subst. abstr.). Il lui faut, pour respirer, l'oxygène de la vérité, de l'authenticité (ARNOUX, Crimes innoc., 1952, p.138).
♦Ballon d'oxygène. C'est, ça a été un ballon d'oxygène! V. ballon ex. 29.
— Loc. fig. Donner, insuffler de l'oxygène à. Revigorer. [Lesseps] ressemble au Napoléon de la campagne de France présent sur tous les points à la fois: sitôt qu'un de ses partisans faiblit il se précipite, lui insuffle de l'oxygène (MORAND, Route Indes, 1936, p.81).
B. —P.méton. [P.réf. à l'oxygène, élément respirable de l'air atmosphérique, p.oppos. à ce qu'est une atmosphère confinée, polluée] Air pur. Aller faire une cure d'oxygène à la campagne, à la montagne. Ragaillardi à la saine odeur de ces halles où, chaque matin (...) circulent à flots l'air salin des bords de la mer et l'oxygène des campagnes, le front rafraîchi, l'âme en joie, je ne songeais plus à rentrer (ARÈNE, Veine argile, 1896, p.126).
— P.métaph. «Vous, aimer? Vous n'aimez même pas la gloire.» Mot, réflexe qui nous introduisent mieux encore qu'un poème, dans l'élément respirable de Mme de Noailles, dans son oxygène brûlant et pur qu'agitaient des ailes démesurées (COLETTE, Belles sais., Discours de réception, 1936, p.226).
— Au fig. Une certaine atmosphère, ambiance propice au bien-être. Dans ce milieu on manque d'oxygène (Lar. Lang. fr.).
REM. Oxygénothérapie, subst. fém., méd. Emploi thérapeutique de l'oxygène soit en inhalation, soit en injection intradermique ou sous-cutanée. Appareil (...) pour insufflation tubaire et oxygénothérapie (Catal. instrum. chir. [Collin], 1936, p.8). L'oxygénothérapie est indispensable dans l'intoxication par l'oxyde de carbone (CO), nécessaire dans le traitement des asphyxiés, des états de choc, dans certaines affections pulmonaires (pneumonies, broncho-pneumonies), en cas de paralysie respiratoire et au cours des anesthésies et de toutes les ventilations artificielles (Pt Lar. Méd. 1976).
Prononc. et Orth.:[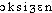 ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1783 principe oxygine (Mém. s. la décomposition de l'eau, Class. de la sc., VIII, p.94 ds BRUNOT t.6, p.662, note 3); 1786 principe oxygène (FOURCROY, El. Chim., II, p.320, ibid.: M. Lavoisier désigne l'air vital sous le nom de principe «oxygène» ou propre à engendrer les acides); 1787 oxygène (G. DE MORVEAU, Nomencl. Chim., p.32 ds DG); 1913 ballon d'oxygène (ALAIN-FOURNIER, Meaulnes, p.320). Comp. des élém. formants oxy- «acide» gr.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1783 principe oxygine (Mém. s. la décomposition de l'eau, Class. de la sc., VIII, p.94 ds BRUNOT t.6, p.662, note 3); 1786 principe oxygène (FOURCROY, El. Chim., II, p.320, ibid.: M. Lavoisier désigne l'air vital sous le nom de principe «oxygène» ou propre à engendrer les acides); 1787 oxygène (G. DE MORVEAU, Nomencl. Chim., p.32 ds DG); 1913 ballon d'oxygène (ALAIN-FOURNIER, Meaulnes, p.320). Comp. des élém. formants oxy- «acide» gr.  -, de
-, de  «aigre, acide», et -gène. Fréq. abs. littér.:342. Fréq. rel. littér.:XIXe s.: a) 219, b) 817; XXe s.: a) 155, b) 735. Bbg. DUB. Dér. 1962, p.69.
«aigre, acide», et -gène. Fréq. abs. littér.:342. Fréq. rel. littér.:XIXe s.: a) 219, b) 817; XXe s.: a) 155, b) 735. Bbg. DUB. Dér. 1962, p.69.
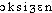 ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1783 principe oxygine (Mém. s. la décomposition de l'eau, Class. de la sc., VIII, p.94 ds BRUNOT t.6, p.662, note 3); 1786 principe oxygène (FOURCROY, El. Chim., II, p.320, ibid.: M. Lavoisier désigne l'air vital sous le nom de principe «oxygène» ou propre à engendrer les acides); 1787 oxygène (G. DE MORVEAU, Nomencl. Chim., p.32 ds DG); 1913 ballon d'oxygène (ALAIN-FOURNIER, Meaulnes, p.320). Comp. des élém. formants oxy- «acide» gr.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1783 principe oxygine (Mém. s. la décomposition de l'eau, Class. de la sc., VIII, p.94 ds BRUNOT t.6, p.662, note 3); 1786 principe oxygène (FOURCROY, El. Chim., II, p.320, ibid.: M. Lavoisier désigne l'air vital sous le nom de principe «oxygène» ou propre à engendrer les acides); 1787 oxygène (G. DE MORVEAU, Nomencl. Chim., p.32 ds DG); 1913 ballon d'oxygène (ALAIN-FOURNIER, Meaulnes, p.320). Comp. des élém. formants oxy- «acide» gr.  -, de
-, de  «aigre, acide», et -gène. Fréq. abs. littér.:342. Fréq. rel. littér.:XIXe s.: a) 219, b) 817; XXe s.: a) 155, b) 735. Bbg. DUB. Dér. 1962, p.69.
«aigre, acide», et -gène. Fréq. abs. littér.:342. Fréq. rel. littér.:XIXe s.: a) 219, b) 817; XXe s.: a) 155, b) 735. Bbg. DUB. Dér. 1962, p.69.
oxygène [ɔksiʒɛn] n. m.
ÉTYM. 1783, gaz oxygène; 1777, principe oxygine, selon Oxford Dict.; de 1. oxy-,et -gène, proprement « qui produit les acides », mot créé par Lavoisier, → ci-dessous, cit. 1.
❖
1 Chim. et cour. Élément métalloïde (symb. O, poids at. 16, no at. 8), gaz invisible, inodore qui constitue approximativement 1/5 de l'air atmosphérique. || L'oxygène naturel est un mélange de trois isotopes. || L'oxygène est un comburant. || Combinaison avec l'oxygène. ⇒ Oxyde; combustion, oxydation, oxygénation. || Modification allotropique de l'oxygène. ⇒ Ozone. || L'oxygène de l'atmosphère. || Atmosphère à oxygène raréfié, sans oxygène (→ Asphyxie, cit. 2). || L'oxygène de l'eau. || L'oxygène est indispensable à la plupart des êtres vivants. || Rôle de l'oxygène dans le métabolisme des micro-organismes. ⇒ Aérobiose; anaérobiose. || Ferment (cit. 1) qui vit sans oxygène. || Absorption de l'oxygène par l'organisme. ⇒ Respiration. || Dégagement d'oxygène des plantes à chlorophylle. ⇒ Chlorophyllien. || Les globules rouges du sang se chargent d'oxygène (⇒ Oxyhémoglobine) à leur passage dans les poumons (→ Circulatoire, cit.). || Fixation de l'oxygène (→ Anémie, cit.). || Étouffer par manque d'oxygène. ⇒ Asphyxie. || Bouteille d'oxygène comprimé des aviateurs, des plongeurs sous-marins. — Ballon d'oxygène, utilisé en médecine, en chirurgie. || Masque, tente à oxygène (→ Oxygénothérapie).
1 Cet air que nous avons découvert presque en même temps, M. Priestley, M. Schéele et moi, a été nommé par le premier air déphlogistiqué; par le second air empirial. Je lui avais d'abord donné le nom d'air éminemment respirable (…)
Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant des deux mots grecs οζυς, acide et γειυομαι, j'engendre, parce qu'en effet une des propriétés les plus générales de cette base est de former des acides, en se combinant à la plupart des substances. Nous appellerons donc oxigène la réunion de cette base avec le calorique (…)
Lavoisier, Traité élémentaire de chimie, I, IV, p. 54.
2 (…) l'oxygène est reconnaissable à la propriété qu'il possède (…) de rallumer une allumette présentant quelques points en ignition (…)
Lautréamont, les Chants de Maldoror, IV.
3 Le médecin fit une piqûre de morphine et pour rendre la respiration moins pénible demanda des ballons d'oxygène (…) Dégagé par la double action de l'oxygène et de la morphine, le souffle de ma grand-mère ne peinait plus, ne geignait plus, mais vif, léger, glissait (…)
Proust, À la recherche du temps perdu, t. VII, p. 200.
4 Les tissus contiennent des réserves d'eau, de sels, de graisse, de protéines, de sucre. Seul, l'oxygène ne s'emmagasine nulle part. Il doit être fourni de façon continue au sang par les poumons.
Alexis Carrel, l'Homme cet inconnu, VI, II.
5 (…) la panne d'oxygène n'est pas sensible à l'organisme. Elle se traduit par une euphorie vague qui aboutit, en quelques secondes, à l'évanouissement, et en quelques minutes à la mort. Le contrôle permanent du débit de cet oxygène est donc indispensable, ainsi que le contrôle, par le pilote, de l'état de ses passagers.
Saint-Exupéry, Pilote de guerre, V.
2 Cour. Air pur. ⇒ Air. || Aller prendre l'oxygène, un bol d'oxygène.
❖
DÉR. Oxygéner, oxygénite.
COMP. Oxacide, oxygénase, oxygénothérapie.
Encyclopédie Universelle. 2012.