PHOSPHORE
Le phosphore doit son nom à la lumière qu’il émet par oxydation lente et spontanée, à la température ordinaire. Le moins abondant des éléments de la seconde rangée de la table périodique, il représente environ 1,3 p. 100 de la quantité de silicium que possède l’Univers. Il existe dans la nature à l’état combiné dans un grand nombre de phosphates minéraux: phosphates et fluorophosphates d’aluminium, de fer et manganèse, de terres rares, uranifères, de plomb et, plus généralement, de phosphates calcaires. On citera plus particulièrement les apatites, et notamment les fluorapatites de formule Ca5(PO4)3F.
Le phosphore intervient dans la métallurgie du fer; contenu dans certains minerais à l’état de phosphate, il est mis en liberté lors du traitement réducteur des oxydes dans les hauts fourneaux et se retrouve dans les produits sidérurgiques dont il altère les propriétés.
On le rencontre aussi dans les eaux de drainage et les sols, soit à l’état de sels minéraux, soit sous forme de combinaisons complexes avec la matière azotée du sol. Il joue un rôle dans le développement des végétaux qui en contiennent toujours des proportions élevées, d’où l’importance des phosphates dans les engrais.
Le phosphore existe aussi dans les tissus animaux. Il constitue la majeure partie des os et des dents. On le trouve dans l’urine, dans le sang, soit à l’état de phosphate, soit combiné avec des matières organiques (lipidiques, nucléoprotéiques...). L’action du phosphore est décisive dans le métabolisme des êtres vivants puisque, en particulier, l’acide adénosine-triphosphorique est le véhicule de l’énergie.
C’est en 1669 que l’alchimiste allemand Henning Brand découvrit le phosphore en cherchant à extraire la pierre philosophale de l’urine humaine. L’extraction à partir de l’urine fut à nouveau utilisée par Johann Kunckel en Allemagne et Robert Boyle en Angleterre.
Au XVIIIe siècle, Carl Wilhelm Scheele instituait le procédé de préparation à partir des os d’animaux, procédé qui porte son nom; mais ce n’est qu’en 1838 que le phosphore commença à être préparé industriellement.
1. Le phosphore élémentaire
L’atome de phosphore
L’atome de phosphore a pour symbole P. Ses numéro et masse atomiques sont respectivement 15 et 30,977 8 (31). On lui connaît six isotopes, l’isotope 3115P qui est stable et cinq isotopes radioactifs dont les durées de demi-vie sont présentées dans le tableau 1.
L’isotope 32P est utilisé comme traceur en physico-chimie et en biologie à la fois pour sa durée de vie relativement longue et pour ses radiations 廓 qui sont suffisamment énergétiques pour être mesurées par les compteurs usuels (tubes Geiger-Müller à parois de verre).
Le spin nucléaire de l’isotope stable est égal à 1/2(h /2 神) et son moment quadripolaire est nul. Cela est particulièrement intéressant pour l’étude de la structure électronique des molécules ou des ions contenant l’atome 31P par les données de la résonance magnétique nucléaire.
Avec un noyau portant une charge positive capable de neutraliser quinze électrons, l’atome neutre de phosphore présente la configuration électronique: 1 s 2; 2 s 2, 2 p 6; 3 s 2, 3 p 3. Dans l’état fondamental, les trois orbitales 3 p sont occupées chacune par un seul électron, la distribution électronique est alors de symétrie sphérique et correspond à un état 4S.
Le potentiel d’ionisation, travail nécessaire pour extraire un électron à partir de l’atome, est élevé et augmente avec le degré d’ionisation de l’atome. Pour la première ionisation (3 s 2, 3 p 33 s 2, 3 p 2), il vaut 10,9 eV. L’analyse du phosphore par spectroscopie d’émission utilise quatre lignes caractéristiques dans le proche ultraviolet à 253,565 nm; 255,328 nm; 253,401 nm; 255,493 nm. Leur détection dans les mêmes conditions de mesure exige comparativement aux métaux usuels des concentrations de phosphore de 10 à 1 000 fois plus élevées.
Dans le spectre de rayons X de cet élément, le coin d’absorption critique pour la ligne K de l’atome survient à 0,577 nm lorsqu’il est lié à trois autres atomes et à 0,575-0,576 nm s’il est lié à quatre autres atomes.
Formes allotropiques et réactivité
Le phosphore à l’état solide présente plusieurs modifications allotropiques dont trois sont bien connues, le phosphore blanc, le phosphore rouge et le phosphore noir. Chacune de ces formes présente également plus d’une variété.
Le phosphore blanc est obtenu lorsque la vapeur est condensée à l’état liquide et que le liquide est ensuite solidifié; c’est la forme solide la plus commune et la plus réactive du phosphore élémentaire; il est alors très toxique, fond vers 44,1 0C et a une masse volumique de 1,83 g/cm3. Deux variétés cristallines existent: la variété «haute température», appelée phosphore 見, qui est cubique avec une cellule unité de grande dimension contenant 56 molécules P4; la variété «basse température», appelée phosphore 廓, de symétrie hexagonale obtenue par refroidissement de la forme 見 à 漣 76,9 0C à une pression de 1 atmosphère.
Le phosphore rouge amorphe est obtenu par chauffage du phosphore blanc à température modérée dans un système fermé. Il est beaucoup moins réactif du point de vue chimique (tabl. 2). On lui connaît plusieurs variétés suivant les méthodes de préparation; on peut avoir des propriétés différentes: ainsi, les mesures de masse volumique varient entre 2,0 et 2,4 g/cm3 et les températures de fusion s’échelonnent de 585 à 600 0C.
Le phosphore noir existe sous deux formes: la variété cristalline de masse volumique élevée ( 福 = 2,69 g/cm3) et une variété amorphe intermédiaire ( 福 = 2,25 g/cm3). La transformation du phosphore blanc en variété cristalline de phosphore noir est pratiquement instantanée à haute température et haute pression. Le phosphore noir cristallisé est composé de couches d’atomes de phosphore reliées entre elles, chaque atome de phosphore étant relié à trois atomes voisins. Du point de vue thermodynamique, le phosphore noir cristallisé est la forme la plus stable de cet élément.
La structure du phosphore à l’état liquide a été étudiée par diffraction des rayons X et par spectroscopie Raman, ce qui a démontré qu’il est constitué de molécules tétraédriques P4. Cette structure moléculaire se retrouve dans l’état gazeux à température moyenne. Les études par diffraction électronique montrent que cette molécule est un tétraèdre régulier, avec des distances P 漣P de 2,21 梁 0,02 nm. Au-dessus de 900 0C, la dissociation de P4 en P2 se manifeste, et devient très faible au-dessous de 800 0C.
Le phosphore élémentaire peut être préparé par réduction de n’importe quel composé le contenant. Il est actuellement obtenu par réduction de phosphates à l’aide de charbon dans un four électrique. La température de réaction est fixée autour de 1 450 0C:
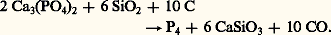
2. Composés du phosphore
Élément du groupe VB appartenant à la seconde longue rangée du tableau périodique (3e période), le phosphore a une configuration électronique semblable à celle de l’azote. Des analogies dans la chimie de ces deux éléments sont dès lors prévisibles. La couche de valence possédant cinq électrons, on peut s’attendre à l’existence de composés dont les états d’oxydation pour l’élément considéré varieront de 漣 III à + V.
La figure 1 présente le diagramme d’oxydoréduction du phosphore pour quelques composés hydrogénés ou oxygénés en solution à pH = 0. Les potentiels normaux d’oxydoréduction sont donnés par les pentes des segments correspondant aux couples envisagés. Sur ce diagramme, la molécule de phosphore paraît être instable vis-à-vis des états + I et 漣 III.
On peut s’attendre à une dismutation facile suivant la réaction:
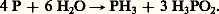
L’acide hypophosphoreux H3P2 est lui-même instable. Ce diagramme indique également que même des oxydants faibles conduisent à l’oxydation des composés du phosphore jusqu’à l’état d’oxydation + V, c’est-à-dire l’acide phosphorique.
Dans tous ces composés, étant donné l’énergie d’ionisation élevée et la grande valeur de l’électronégativité, les liaisons seront à caractère presque exclusivement covalent.
Cependant, il existe des différences notables entre les deux éléments azote et phosphore. Ainsi, ce dernier ne semble pas former avec l’oxygène, l’azote ou le carbone de composés non saturés et stables, ayant des liaisons de type p 神-p 神 analogues aux dérivés nitrés, nitrosés...
Cette différence se manifeste déjà dans l’état moléculaire: molécule linéaire d’azote N 令 N triplement liée, molécule tétraédrique de phosphore P4, constituée d’un atome de P lié à trois autres par trois liaisons simples.
Le phosphore se distingue encore de l’azote par la possibilité d’utiliser ses orbitales 3 d , ce qui conduit à la mise en jeu de liaisons de type p 神-d 神 et, d’autre part, à un plus grand nombre d’hybridations des orbitales, cela expliquant les composés à cinq et six liaisons autour d’un atome de phosphore, composés inconnus pour l’azote (fig. 2 et tabl. 3).
Cependant, les électrons d ont une énergie élevée; il faut environ 836 kJ/mole pour promouvoir un électron 3 p du phosphore dans une orbitale 3 d . Aussi, bien que l’hybridation des orbitales conduise à un abaissement de l’énergie du composé chimique correspondant, les arrangements mettant en jeu les orbitales d seront moins stables que ceux correspondant aux orbitales p et s . Cela signifie qu’il y aura seulement un nombre restreint de combinaisons dans lesquelles les orbitales d jouent un rôle majeur.
Combinaisons binaires
Les combinaisons binaires du phosphore sont très nombreuses puisqu’en dehors des gaz rares, de la plupart des terres rares et des derniers éléments de la classification périodique (beaucoup de ceux-ci n’ayant pas encore fait l’objet d’une étude approfondie) on connaît une ou plusieurs combinaisons binaires pour chacun des autres éléments.
Phosphures métalliques
La méthode la plus simple et la plus générale pour préparer les phosphures métalliques consiste à chauffer le métal avec du phosphore rouge ou de la vapeur de phosphore en atmosphère non oxydante.
Les phosphures alcalins ou alcalino-terreux (Na3P, Ca3P2, Sr3P2) ont un caractère ionique non négligeable; comme ceux d’autres métaux très électropositifs, ils sont généralement rapidement hydrolysés par l’eau avec formation de phosphine PH3.
Les phosphures des éléments de transition, par exemple Fe2P, sont des substances métalliques de couleur grise, insolubles dans l’eau et conductrices de l’électricité. Ils peuvent aussi être ferromagnétiques. Leurs compositions et leurs structures sont souvent très complexes.
Nitrures
Il existe au moins trois combinaisons contenant uniquement de l’azote et du phosphore. Elles ne peuvent pas être obtenues par l’union directe de ces éléments et correspondent aux formules: (P35)x , (P23)y , (PN)z . Leur structure et leur constitution sont mal connues. (P35)x est un solide blanc, inodore, insoluble. On peut l’obtenir par chauffage au rouge, sous courant d’ammoniac, du composé P2S5, 6 NH3, ou par chauffage sous vide du phospham (PN2H)x :
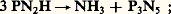
chauffé dans le vide ou en présence d’azote, il donne (PN)z , qui est lui aussi un solide, ainsi que (P23)y , qui est obtenu par chauffage du phosphotri-imide P2(NH)3.
Hydrures
On connaît deux hydrures, la phosphine PH3 et la diphosphine P2H4. On retrouve là une analogie avec les hydrures de l’azote, l’ammoniac NH3 et l’hydrazine 2H4. Cependant, les hydrures de phosphore sont beaucoup moins stables.
La phosphine PH3 peut être préparée par de nombreuses voies, les plus importantes étant des réactions d’hydrolyse ou de décomposition thermique de composés du phosphore; ainsi:

PH3 est un gaz dont la température d’ébullition est de 漣 87 0C et celle de fusion égale à 漣 133,8 0C.
La molécule est pyramidale (fig. 3). L’atome de phosphore a établi trois liens de covalence avec les trois hydrogènes et conserve un doublet d’électrons disponibles (base de Lewis). PH3 est un hydrure très instable à l’air:

À 150 0C, il conduit à l’acide phosphorique: PH3 + 2 2H3P4. En présence de la diphosphine P2H4, il s’enflamme à la température ambiante. Il possède des hydrogènes substituables et avec les halogènes la réaction est violente. Dans le cas du chlore, avec un excès de celui-ci, il y a formation de pentachlorure:

Avec les métaux, l’hydrure réagit à chaud en donnant de l’hydrogène et un phosphure métallique. Dans le cas d’une action avec les métaux alcalins dans l’ammoniac liquide, on obtient les phosphidures PH2Na, PH2K; avec les radicaux carbonés, on forme les alkyles et arylphosphines: triméthylphosphine P(CH3)3 et triéthylphosphine P(C2H5)3.
PH3 est soluble dans l’eau. Il se forme un hydrate légèrement ionisé conduisant à une solution faiblement basique:

Le cation PH4+ (ou cation phosphonium) possède la structure tétraédrique de NH4+. Des combinaisons existent avec les hydracides halogénés (PH4I, PH4Br, PH4Cl); toutes sont décomposées par l’eau avec formation d’hydracides et phosphine.
La disphosphine P2H4 est un liquide incolore volatil (température d’ébullition + 51,7 0C, de fusion 漣 99 0C). Elle est extraite des gaz dégagés dans la réaction de l’eau sur les phosphures métalliques, alcalino-terreux en particulier:

La vapeur est instable et spontanément inflammable à l’air. Le liquide se décompose par exposition à la lumière en donnant de la phosphine et du phosphore rouge:
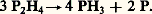
Halogénures
Les principaux halogénures de phosphore sont présentés dans le tableau 4 avec leur point d’ébullition ou de fusion. Ils sont dans l’ensemble incolores (exception faite de PI3 rouge sombre, PBr5 jaune, P2I4 orange).
Les trihalogénures sont préparés par union directe des éléments. Leur structure est pyramidale (fig. 3). Les molécules de trihalogénure possédant un doublet libre sur l’atome de phosphore donnent lieu à de nouvelles liaisons, par don de ce doublet à l’oxygène, donnant ainsi OPX3 (oxyhalogénure de phosphore) ou au soufre avec formation de SPX3 (thiohalogénure de phosphore). Les trihalogénures de phosphore peuvent aussi mettre en jeu des orbitales 3 d du phosphore, ce qui conduit aux pentahalogénures. Des halogénures mixtes peuvent être préparés, qui se décomposent par chauffage:

Les trihalogénures et les pentahalogénures de phosphore se comportent comme des chlorures d’acides. La stabilité thermique des pentahalogénures décroît quand la masse moléculaire s’élève. Par léger chauffage, PCl5 se dissocie suivant la réaction: PCl5 燎 PCl3 + Cl2. L’instabilité de PCl5 en fait un agent de chloration puissant et commode fort employé en chimie organique. Il sert à préparer des chlorures d’acides et des dérivés halogénés du carbone à partir des alcools.
C’est un générateur de macromolécules phosphorées. En particulier, il est le point de départ pour la préparation des chlorures de phosphonitrile (PNCl2)n .
Les principales réactions typiques des trichlorures et des pentachlorures de phosphore sont rassemblées dans la figure 4.
Du point de vue structural, les molécules de pentahalogénures (état vapeur ou liquide) se présentent sous forme de bipyramide à base triangulaire (fig. 5). Cette configuration géométrique correspondant à une hybridation sp 3d est une preuve de l’existence de cinq liaisons de covalence qui donnent au phosphore dix électrons sur sa couche externe. La molécule correspondante est diamagnétique.
À l’état solide, les études par diffraction des rayonx X ont montré que le pentachlorure est un composé ionique formé des ions (PCl6) size=1漣 octaédriques et (PCl4)+ tétraédriques.
Oxydes
Le phosphore a une très grande affinité pour l’oxygène et parmi les nombreuses combinaisons qu’on a pu proposer comme résultant de la réaction entre ces deux éléments, trois seulement paraissent bien établies (P23, P2 et P25) et deux ont été étudiées en détail (P25 et P23).
Le pentoxyde P25 est également connu sous le nom d’anhydride phosphorique ou d’oxyde phosphorique. Obtenu par oxydation du phosphore, il peut être purifié par sublimation. Les études par diffraction électronique montrent qu’à l’état gazeux il est constitué de molécules P410 dont l’arrangement structural correspond à celui de la figure 6. Les grandes distances entre un atome de phosphore et un atome d’oxygène correspondent à des liaisons 靖 simples et les distances plus courtes entre un atome de phosphore et un atome d’oxygène non partagé correspondent, en plus de la liaison 靖 simple, à un ordre de liaison 神 de 1,5 à 2.
Trois formes cristallines sont connues à l’état solide. Une forme hexagonale est obtenue par condensation des vapeurs de pentoxyde de phosphore. Elle comporte des molécules P410 identiques à celles qui sont caractéristiques de l’état gazeux. Deux formes orthorhombiques, l’une stable (quadratique pour certains auteurs), l’autre métastable, sont obtenues par chauffage de cette forme hexagonale en système fermé pendant plusieurs heures à des températures de l’ordre de 400 à 450 0C.
On connaît également deux formes amorphes et une forme vitreuse. Dans toutes les structures du pentoxyde de phosphore, un atome de phosphore est toujours entouré tétraédriquement par quatre atomes d’oxygène, trois atomes d’oxygène étant toujours partagés avec trois tétraèdres adjacents différents.
Le pentoxyde P410 est le plus stable des composés oxygénés du phosphore:
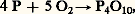
avec H = 漣 3 009 kJ/mole. Cela explique le caractère fortement réducteur du phosphore et l’extrême difficulté à réduire P410; la réaction correspondante n’est possible qu’avec le carbone ou le bore, à très haute température:

Anhydride de l’acide phosphorique, le pentoxyde réagit très vivement avec l’eau pour conduire à l’acide orthophosphorique. L’hydrolyse se fait en plusieurs étapes schématisées ci-dessous:
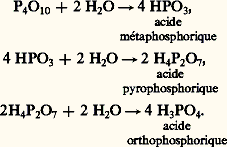
Le pentoxyde est un déshydratant énergique utilisé pour enlever l’eau de certains oxoacides et obtenir leurs oxydes.
Le trioxyde P23 est aussi appelé oxyde ou anhydride phosphoreux. La manière la plus sûre de le préparer consiste en la combustion du phosphore dans l’oxygène à une température et pour des proportions d’oxygène appropriées. La purification peut être obtenue par distillation.
Les mesures par diffraction électronique ainsi que les mesures de densité de vapeur montrent que sa structure est également tétraédrique. Seuls les quatre oxygènes non partagés sont absents. Les distances interatomiques P-O sont de 0,165 nm et correspondent à des liaisons 靖 simples.
Les études structurales sur le trioxyde de phosphore à l’état liquide et à l’état solide permettent de penser que la forme moléculaire P46 persiste dans ces états. P46 fond à une température de 23,8 0C et a un point d’ébullition de 175,4 0C. Il est quelque peu soluble dans le disulfure de carbone et peut être recristallisé à partir de la solution.
Le trioxyde de phosphore est décomposé par la chaleur:
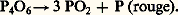
Il donne de l’acide phosphoreux par action de l’eau à froid:
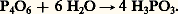
Si la réaction est conduite à chaud, il y a formation d’acide phosphorique avec dégagement de phosphine:

Le tétroxyde de phosphore P24, ou mieux (PO2)n , peut être obtenu par chauffage du trioxyde. C’est un solide blanc, volatil à 200 0C. Sa constitution est mal connue; il s’agit certainement d’un polymère (PO2)n . En présence d’eau, il donne un mélange des acides phosphoreux et phosphorique.
Sulfures
Mélangés à une température inférieure à 100 0C, le phosphore blanc et le soufre forment des solutions solides; au-dessus de cette température, ils réagissent d’une manière énergique et très exothermique.
Plusieurs phases cristallines: P4S3, P4S5, P4S7, P4S10, et peut-être (P2S3)n , sont formées à partir de cette réaction; les déterminations de poids moléculaires indiquent qu’il y a quatre atomes de phosphore par molécule en solution et dans la vapeur. Du point de vue de l’arrangement structural, P4S10 est comparable à P410.
Les sulfures de phosphore sont hydrolysés par l’eau pour produire de l’acide phosphorique, de l’acide phosphoreux, de l’acide hypophosphoreux et de l’hydrogène sulfuré.
P4S10 est utilisé pour remplacer un atome d’oxygène dans un composé organique par un atome de soufre. Les thioalcools et les thiocétones peuvent être préparés ainsi.
Autres composés
Polyhalogénures
Un assez grand nombre d’halogénures de phosphore cristallisés, dans lesquels on rencontre plusieurs types d’atomes d’halogènes par atome de phosphore, sont connus. C’est le cas de toute une série de cristaux où l’on dénombre sept atomes d’halogènes par atome de phosphore: PCl6I, PCl5BrI, PCl3Br4, PClBr5I, PBr7, PBr6I, et aussi de cristaux dans lesquels il y a plus de sept atomes d’halogènes par atome de phosphore: PCl2Br7, PCl3Br8, PCl5Br10, PBr17 et PCl3Br18.
Oxyhalogénures
Les oxyhalogénures simples et mixtes de formule générale OPX3 sont connus pour le fluor, le chlore et le brome; les oxyhalogénures simples peuvent être préparés par oxydation de PCl3 ou de PBr3, également par action du pentoxyde de phosphore sur un pentahalogénure:
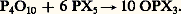
L’oxychlorure de phosphore POCl3 est un liquide incolore à la température ordinaire (ébullition à 105 0C). C’est le chlorure d’acide de l’acide phosphorique, auquel on parvient par hydrolyse:
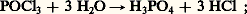
c’est un agent chlorurant.
Les oxyhalogénures mixtes connus (POF2Cl, POFCl2, P2Br, POFBr2, POCl2Br, POClBr2) peuvent être préparés en chauffant les chlorures ou les bromures avec le trifluorure d’antimoine.
Thiohalogénures
Les combinaisons les mieux connues contenant du phosphore, du soufre et des halogènes sont les thiohalogénures de phosphore de formule PSX3. Elles sont obtenues par réaction entre le pentasulfure de phosphore et le pentachlorure:

Des thiohalogénures mixtes de phosphore sont aussi connus (PSFBr2, PS2Br) ainsi que des composés plus complexes où les rapports phosphore/soufre/halogène sont différents de 1:1:3.
Halogénures de phosphonitrile
Les combinaisons du phosphore et de l’azote fondées sur des liaisons à caractère 神 se sont révélées particulièrement intéressantes parce qu’elles forment des polymères dont les propriétés peuvent être utiles à température élevée.
En tant que matériaux, elles vont des fluides, utiles en transfert de chaleur et en lubrification, aux solides dont les propriétés mécaniques se rapprochent de celles des polymères organiques.
Les chlorures de phosphonitrile de formule générale (PNCl2)n sont bien connus, en particulier deux composés bien caractérisés comme solides, les chlorures de phosphonitrile trimère et tétramère. Un mélange des deux combinaisons est obtenu soit par chauffage à 120 0C du pentachlorure de phosphore et du chlorure d’ammonium dans un tube scellé ou en solution dans le tétrachloroéthane (ébullition à 146 0C):

soit par chauffage de (P35)x dans le chlore à 700 0C. Le trimère et le tétramère peuvent être ensuite isolés par cristallisation du mélange, mais il se forme une assez grande fraction d’autres polymères.
La structure du chlorure de phosphonitrile trimère a été déterminée par diffraction électronique. L’arrangement des atomes est celui d’un cycle plan de six atomes où alternent atome P et atome N, distants de 0,165 nm. Les cristaux du trimère appartiennent au système orthorhombique et contiennent quatre molécules par cellule unité.
La structure du chlorure de phosphonitrile tétramère correspond à un cycle du même type comportant huit atomes et ayant une forme plissée semblable à la forme bateau du cyclohexane. Les cristaux appartiennent au système quadratique avec deux molécules par cellule unité.
Le trimère cristallisé ainsi que le tétramère peuvent être ultérieurement condensés par chauffage à 300 0C en un matériau de type caoutchoutique de poids moléculaire 礪 20 000 et de formule (PNCl2)n . Cependant, les propriétés élastiques sont vite perdues par l’action de l’humidité de l’air.
Bien que les combinaisons de chlorures de phosphonitrile soient moins réactives que les combinaisons chlore-phosphore, elles réagissent en général lentement avec les alcools et les alcoolates, l’ammoniac, les amines, etc. Les bromures de phosphonitrile (PNBr2)3 et (PNBr2)4 sont formés en remplaçant NH4Cl par NH4Br dans la réaction de formation. Les composés fluorés analogues sont préparés par action du fluorosulfite de potassium sur (PNCl2)3 à 120 0C:

3. Oxoacides, oxoanions et oxosels
La chimie des oxoacides du phosphore est extrêmement complexe et, de ce fait, il y eut pendant longtemps beaucoup de confusion parmi l’ensemble des composés que l’on arrivait à préparer. Actuellement, les déterminations structurales sont mieux connues. On peut diviser les oxoacides du phosphore en deux grandes classes: les oxoacides inférieurs et les oxoacides correspondant à l’acide orthophosphorique et aux acides phosphoriques condensés.
Dans tous ces acides, la présentation du nombre d’oxydation attribué au phosphore est primordiale pour un classement convenable et les notations de Blaser et Worms sont très précieuses. Ces notations sont fondées sur les liaisons entre le phosphore et les atomes qui composent les squelettes d’une combinaison donnée. Dans tous les oxoacides, l’atome de phosphore est lié à un ou plusieurs groupes OH dans lesquels l’atome d’hydrogène est ionisable. De plus, pratiquement dans tous les cas, on rencontrera pour l’atome de phosphore la configuration la plus stable correspondant à l’hybridation sp 3. On aura donc quatre atomes directement liés au phosphore suivant un arrangement de type tétraédrique plus ou moins déformé.
Il y a alors six combinaisons possibles qui conduisent à six structures types dont les atomes de phosphore centraux ont par convention les nombres d’oxydation donnés dans le tableau 5. On peut ainsi s’attendre à un assez grand nombre d’oxoacides inférieurs mettant en jeu des phosphores 1P à 5P ainsi qu’à plusieurs types d’acides phosphoriques où l’on ne rencontrera que le phosphore 5P.
Oxoacides inférieurs
Assez nombreux, de structure linéaire ou cyclique, les oxoacides inférieurs ne sont pas toujours isolés en tant qu’acides, mais au moins connus en tant que sels. On ne donnera ici des indications que sur quelques-uns d’entre eux.
L’acide hypophosphoreux H3P2 (acide 1P) peut être préparé à partir d’une solution d’hydroxyde de baryum traitée à l’ébullition avec du phosphore blanc. Il se forme également le sel de baryum de l’acide 3P qui est insoluble. La préparation peut être réalisée en faisant passer de l’hydrogène phosphoré dans une suspension aqueuse d’iode:
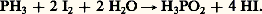
L’acide hypophosphoreux pur cristallise sous forme de feuillets incolores (température de fusion 28,8 0C). C’est un monoacide. Il se décompose sous l’action de la chaleur en acide orthophosphorique et phosphine. L’acide hypophosphoreux et ses sels sont de forts agents réducteurs.
Les études structurales de l’anion hypophosphite dans les sels d’ammonium et de calcium ont démontré qu’il s’agissait d’un arrangement tétraédrique: P 漣O, 0,151 nm; O 漣P 漣O, 1200; H 漣P 漣H, 920.
L’acide orthophosphoreux H3P3 (acide 3P) peut être préparé en traitant son anhydride P46 par de l’eau. La préparation la plus utilisée parce que la plus commode consiste à hydrolyser le trichlorure de phosphore:

L’acide 3P peut être purifié par cristallisation. Il fond à 70,1 0C, donnant un liquide clair légèrement visqueux. Il est facilement soluble dans l’eau et se comporte comme un diacide. Les deux types de sels (neutres et acides) sont connus.
L’acide 3P et ses sels sont décomposés par la chaleur pour donner, en l’absence d’eau, de l’acide orthophosphorique et de la phosphine:

Le sel monosodique de l’acide 3P chauffé à 110 0C se convertit en sel disodique de l’acide 3P 漣O 漣3P, acide diphosphoreux ou pyrophosphoreux H4P25.
L’acide orthophosphoreux et ses sels sont des réducteurs moins énergiques cependant que l’acide hypophosphoreux. L’acide orthophosphoreux a une structure tétraédrique distordue P 漣H, 0,139 nm; P 漣OH, 0,154 nm; P=O, 0,147 nm. Les mono-, diet triesters de l’acide phosphoreux peuvent être obtenus par réaction des alcools avec PCl3. Les triesters phosphites P(OR)3 sont capables d’agir comme donneurs d’électrons pour former des complexes avec les métaux de transition et d’autres accepteurs. Ils subissent la réaction de Michaelis-Arbusov avec des halogénures d’alkyle pour former des dialkyles phosphonates:

Le triméthylester subit une isomérisation spontanée pour donner le diméthylester de l’acide méthylphosphonique:

Oxoacides supérieurs
Les oxoacides supérieurs sont tous caractérisés par le phosphore à l’état d’oxydation + V dans l’état d’hybridation sp 3. Les trois oxoacides les mieux connus sont l’acide orthophosphorique H3P4, l’acide pyrophosphorique ou diphosphorique H4P27 et l’acide métaphosphorique HP3 ou (HPO3)n ; ils se forment successivement par hydratation de l’anhydride P410, l’étape ultime étant H3P4.
En fait, si on prend une solution aqueuse de P410 dont la composition correspond à H3P4, il se trouve que les espèces chimiques présentes en solution ne sont pas seulement H3P4, mais que cette dernière ne représente que 90 p. 100. À mesure que la concentration en P410 augmente, la proportion de H3P4 diminue comme le montre la figure 7.
L’acide orthophosphorique H3P4 peut être préparé par action de l’eau sur l’anhydride phosphorique:

ou par oxydation du phosphore par l’acide nitrique dilué. L’action de l’acide sulfurique sur les phosphates de calcium naturels est toujours employée comme mode d’obtention:

et la solution est ensuite concentrée sous basse pression à température ordinaire.
À l’état pur, l’acide orthophosphorique est un solide incolore. Il cristallise sous forme de prismes orthorhombiques, miscibles à l’eau en toute proportion et dont le point de fusion est à 42,3 0C. Les déterminations structurales montrent que la molécule d’acide orthophosphorique a une forme tétraédrique. Tous les atomes d’oxygène participent à des liaisons hydrogène, ce qui conduit à une structure en feuillets dans l’état solide et à une tendance à la polymérisation dans l’état fondu, ou en solutions aqueuses concentrées (liquide sirupeux). C’est un triacide; les trois constantes d’acidité sont à 25 0C: K1 = 1 憐 10 size=1漣2, K2 = 1 憐 10 size=1漣7 et K3 = 5 憐 10 size=1漣13. On connaît de nombreux sels, dont les orthophosphates neutres ou acides, en particulier les trois orthophosphates de sodium (monosodique: NaH2P4, disodique: Na2HP4, trisodique: Na3P4), cristallisant avec des degrés d’hydratation variables. Parmi ces orthophosphates, certains sont d’une importance particulièrement grande sur le plan pratique ou commercial. C’est ainsi que les phosphates alcalins sont utilisés comme tampons tandis que les phosphates d’ammonium interviennent dans les engrais.
Les minerais naturels de phosphate sont tous des orthophosphates, notamment les fluorapatites ou les hydroxyapatites partiellement carbonatées.
L’acide orthophosphorique et les phosphates forment des complexes avec un grand nombre d’ions des métaux de transition. La précipitation de phosphates insolubles à partir d’une solution acide est caractéristique des cations M4+ tels que ceux de Ce, Th, Zr, U, Pu. Un grand nombre d’esters de l’acide orthophosphorique sont connus. Ils peuvent être préparés par une série de réactions avec l’oxychlorure de phosphore:
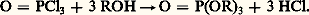
Certains sont très utilisés du point de vue technique, en particulier pour l’extraction par solvant d’ions métalliques à partir de solutions aqueuses. Une série particulièrement importante de ces esters concerne les phosphates de sucre (glucose-phosphate), les glycérophosphates. Ces phosphates organiques jouent un rôle de premier plan dans les processus biologiques (cf. métabolisme PHOSPHOCALCIQUE).
L’acide orthophosphorique, comme son anhydride P410, est particulièrement stable. Sa réduction est seulement possible à température élevée en présence de réducteurs énergiques tels que le carbone:

La seule transformation que l’on puisse lui faire subir est la déshydratation par chauffage qui conduit aux acides phosphoriques condensés:

On retrouve ces réactions de condensation avec les orthophosphates acides. La calcination des phosphates monoacides alcalins donne des pyrophosphates:

Celle des phosphates diacides alcalins donne naissance aux métaphosphates:

L’élément structural caractéristique de tous les orthophosphates est l’union tétraédrique P43 size=1漣. Des substitutions peuvent être réalisées dans ce groupe par des méthodes indirectes, conduisant à de nouvelles familles de composés. On citera les fluorophosphates où, dans l’anion phosphate, un ou plusieurs oxygènes sont remplacés par un atome de fluor: PO43 size=1漣, P32 size=1漣, P22 size=1漣. On connaît bien l’acide monofluorophosphorique H2P3F qui peut être comparé à l’acide sulfurique H2S4 dont il est isostère, et également l’acide difluorophosphorique HP22, monoacide fort, isostère de l’acide perchlorique.
Le phosphore et le soufre forment, par réunion directe, des sulfures parmi lesquels P4S10 de constitution analogue à P410. Si l’hydrolyse de P4S10 n’a pas donné d’acides correspondants, on connaît des sels, les thiophosphates , tels que le thiophosphate de sodium Na3PS4.
Enfin, le remplacement d’un atome d’oxygène de l’anion P43 size=1漣 par un groupe peroxyde 漣O 漣O 漣 introduit la famille des peroxophosphates . Deux termes de cette famille sont connus: l’acide peroxomonophosphorique, et l’acide peroxodiphosphorique:

Les acides phosphoriques condensés
Les acides phosphoriques condensés proviennent de condensations de l’acide orthophosphorique ou des orthophosphates acides. Ils correspondent tous à du phosphore au degré d’oxydation + V et donnent lieu à des arrangements structuraux en chaînes ou sous forme de cycles mettant en jeu des liaisons P 漣O 漣P, pour lesquels un certain nombre de règles générales peuvent être énoncées:
– chaque atome de phosphore est lié à un atome d’oxygène par une liaison d 神-p 神 en plus d’une liaison 靖;
– pour chaque atome de phosphore, un groupement OH a les propriétés d’un acide fort (K = 10 size=1漣1 ou 10 size=1漣2); tout groupement OH additionnel sur le même atome aura les propriétés d’un acide faible;
– deux anions tétraédriques P43 size=1漣 adjacents ne sont jamais liés par plus d’un sommet, ce qui signifie que les tétraèdres P4 peuvent avoir des sommets en commun, mais jamais d’arêtes ou de faces.
L’acide pyrophosphorique ou diphosphorique H4P27 peut être obtenu à partir du sel de sodium Na4P27 provenant de la calcination de l’orthophosphate disodique, ou en traitant à 100 0C l’acide phosphorique par l’oxychlorure de phosphore POCl3, ou encore par déshydratation à 215 0C de l’acide phosphorique.
L’acide pyrophosphorique cristallisé est un solide incolore qui fond à 61 0C. À l’état fondu, les molécules H4P27 ont une forte tendance à s’associer par liaisons hydrogène (viscosité du liquide).
L’acide pyrophosphorique est un tétra-acide, les deux premières fonctions étant celles d’acides forts. Sa structure s’explique par la mise en jeu de deux tétraèdres P4 mettant en commun l’un de leurs oxygènes, et elle est bien vérifiée par les études structurales des pyrophosphates.
L’acide pyrophosphorique est le premier terme d’une série possible d’acides polyphosphoriques dont les structures s’expliquent par allongement de la chaîne, et dont les premiers venant immédiatement après lui seraient les acides tripolyphosphorique H5P3P10 et tétrapolyphosphorique H6P413. Ils n’ont pas été isolés, mais les sels de sodium de certains d’entre eux sont connus, en particulier le tripolyphosphate de sodium Na5P310 et son hydrate Na5P310, 6 H2O. Les études structurales ont démontré leur arrangement en chaîne. Les sels de Madrell et de Kurrol sont constitués de chaînes infinies de tétraèdres conduisant à une structure fibreuse.
La formule générale des anions polyphosphates est Pn 3n +1( size=1漣n size=1漣2).
Les acides métaphosphoriques fondés sur un arrangement en cycle des tétraèdres P4 ont été isolés sous forme de solides vitreux en ce qui concerne les acides trimétaphosphorique (HPO3)3 et tétramétaphosphorique (HPO3)4. Leur structure cyclique a été bien établie. L’acide trimétaphosphorique correspond à un enchaînement cyclique de trois tétraèdres P4 mettant en commun un oxygène de leurs sommets.
Les études par diffraction des rayons X de Na3P39, 6 H2O et de Na3P39 anhydre, les études par résonance magnétique nucléaire du phosphore qui montrent l’existence d’un seul type de phosphore, les résultats des mesures potentiométriques indiquant trois fonctions acides forts et les mesures de conductance de solutions diluées mettant en jeu l’existence d’ions triplement chargés, les déterminations de poids moléculaires, les étapes de l’hydrolyse confirment cette structure cyclique.
L’acide tétramétaphosphorique correspond à un cycle à quatre atomes de phosphore. Les acides métaphosphoriques subissent une lente réhydratation en solution aqueuse avec, au début, simple ouverture du cycle et formation d’acide tripolyphosphorique:

Une hydrolyse coupera la chaîne avec formation d’acide orthophosphorique:

De nombreux sels de ces acides sont connus (Na3P39, K3P39, K4P412...). Les polyphosphates exercent une forte action dispersive sur les suspensions de colloïdes. C’est pour cette raison que le tripolyphosphate de sodium est utilisé comme additif aux détergents. La présence en solution aqueuse du sel de Graham ou de sel de sodium d’un polyphosphate à des concentrations très faibles empêche la précipitation des ions calcium sous forme de calcite, par ébullition, action de l’ammoniac ou passage d’un courant d’air.
La séparation des différents polyphosphates a été pendant longtemps impossible, étant donné la similitude de leurs propriétés. Cette séparation et le dosage des différents termes se fait maintenant par chromatographie en employant le phosphore 3215P comme traceur: l’entraînement par le solvant varie en sens inverse de la masse de la macromolécule.
On inclut dans la classe des ultraphosphates toutes les variétés mettant en jeu des liaisons transversales entre chaînes ou avec des cycles, dans lesquelles des tétraèdres P4 sont triplement liés et où le rapport métal/phosphore est plus petit que 1. Théoriquement, le nombre de possibilités structurales est infini et on en connaît peu qui ont été isolées en tant qu’individualités cristallines. Il est probable que des ultraphosphates interviennent comme mélanges dans des phosphates à l’état vitreux.
Tous les acides phosphoriques (poly ou méta) peuvent être regardés comme des homopolyacides du phosphore puisqu’ils répondent à la formule générale: x P25, y H2O. Ils sont obtenus par des réactions de condensation, c’est-à-dire par une liaison par atome d’oxygène des anions P4 avec élimination de molécules d’eau. Cette possibilité qu’ont les anions P4 de se lier par l’intermédiaire des atomes d’oxygène peut encore se manifester dans la formation d’hétéropolyacides . Le groupe P4 s’unit ici à des groupements d’acides faibles correspondant à d’autres éléments que le phosphore. C’est, en particulier, le cas des acides phosphomolybdiques et phosphotungstiques.
Ainsi, quand un seul groupe Mo3 se fixe sur chaque atome d’oxygène du groupe P4, il se forme l’ion phosphomolybdate dont le sel d’ammonium:

est utilisé en analyse pondérale du phosphore.
La structure de l’anion phosphomolybdate ou phosphotungstate montre que l’atome de phosphore occupe un site tétraédrique dans une cage formée par douze octaèdres Mo6 ou W6 liés entre eux. La formule typique de l’anion est alors (PMo1240)3 size=1漣. D’autres types sont connus pour le phosphore + V.
4. Composés organophosphorés
On range dans la catégorie des composés organophosphorés tous les composés qui mettent en jeu des liaisons C 漣P. On les considère comme des dérivés des hydrures, des oxoacides et des oxydes du phosphore. Les composés de base sont ceux qui figurent au tableau 6.
Les composés ayant des liaisons carbone-phosphore apparaîtront comme des produits de substitution résultant du remplacement de l’atome d’hydrogène d’une liaison hydrogène-phosphore par un groupe alcoyle. Les esters de ces oxoacides seront obtenus en remplaçant l’hydrogène d’une liaison O 漣H par un groupe alcoyle ou aryle; les composés à liaisons phosphore-halogène ou phosphore-azote sont considérés comme des halogénures d’acides ou des amides formés par le remplacement du groupe acide OH dans l’oxoacide de phosphore soit par un halogène, soit par un groupe NH2, NHR ou NR2. Ainsi, le terme de chlorure de l’acide méthylphosphonique et celui de diamide de l’acide méthylphosphonique désignent respectivement les structures:
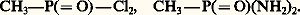
Les composés organiques les plus connus du phosphore trivalent sont les phosphines R3P, R2PH, RPH2 et les dérivés des acides phosphoreux RP(OH)2 et phosphineux R2P(OH).
Leurs propriétés chimiques les plus marquantes sont la facilité de passage de composés trivalents à l’état pentavalent (en particulier, les hydrures inférieurs du phosphore s’enflamment à l’air) et l’instabilité d’un groupe hydroxyle pour un phosphore trivalent. C’est ainsi que les diesters de l’acide phosphoreux n’existent que sous la forme de dérivés de l’acide phosphonique.
Les composés organophosphorés trivalents seront des réactifs nucléophiles. Ils peuvent utiliser la paire électronique libre de l’atome de phosphore pour former des liaisons avec d’autres atomes:

On connaît des sels de phosphonium quaternaires que l’on peut dédoubler en inverses optiques.
Les composés organophosphorés peuvent agir comme réactifs électrophiles lorsque l’atome de phosphore porte des substituants électronégatifs. Ils peuvent également donner lieu à des réactions radicalaires.
phosphore [ fɔsfɔr ] n. m.
• 1677; gr. phôsphoros « lumineux », de phôs « lumière »
1 ♦ Vx Toute substance capable de devenir lumineuse dans l'obscurité.
2 ♦ (dès 1677) Mod. Élément atomique (P; no at. 15; m. at. 30,97), dont on connaît six isotopes radioactifs et qui existe sous plusieurs formes allotropiques. Phosphore blanc : solide fusible à 44 °C, très facilement inflammable, luminescent dans l'obscurité (⇒ phosphorescence) et très toxique (⇒ phosphorisme) . Phosphore rouge, ne s'enflammant qu'au-dessus de 250 °C et non toxique. — Anciennes allumettes au phosphore. — Le phosphore sert à la préparation de l'acide phosphorique, de dérivés halogénés (pour la fabrication d'insecticides, d'anticryptogamiques). Bombes au phosphore.
3 ♦ Littér. (en parlant de choses qui brillent, de lueurs) Des yeux de phosphore. « De grands éclairs [...] semblaient courir au ras du sol, en larges sillons de phosphore » (Zola).
● phosphore nom masculin (grec phôsphoros, qui apporte la lumière) Non-métal, deuxième élément de la colonne V B du tableau des éléments. (Élément de symbole P.) Numéro atomique : 15 Masse atomique : 30,97 Masse volumique : 1,82 g°cm3 Élément chimique présent dans l'organisme sous forme de phosphate. Synonyme de luminophore. ● phosphore (synonymes) nom masculin (grec phôsphoros, qui apporte la lumière)
Synonymes :
phosphore
n. m. élément non métallique de numéro atomique Z = 15 (symbole P). L'élément phosphore est indispensable à l'organisme.
— Corps simple (P), solide à température ordinaire et dont il existe deux variétés allotropiques: le phosphore blanc, très toxique et le phosphore rouge, non toxique. Le phosphore est l'un des principaux éléments fertilisants utilisés en agriculture.
— Luminescence du phosphore blanc: V. phosphorescence.
⇒PHOSPHORE, subst. masc.
CHIMIE
A. —Vx. Phosphore de + nom propre. Produit artificiel phosphorescent. Phosphore de Baudoin. ,,Azotate de chaux calciné`` (LITTRÉ). La découverte du phosphore de Baudoin, qui eut lieu à peu près vers le même temps que celle du vrai phosphore (Lar. 19e). Phosphore de Bologne. ,,Galette de poudre de sulfate de baryte`` (LITTRÉ). On emmagasinera la lumière, car il y a des corps qui ont cette propriété, comme le sucre, la chair de certains mollusques et le phosphore de Bologne (FLAUB., Bouvard, t.2, 1880, p.191). Phosphore de Homberg. 'Chlorure de calcium fondu au feu' (LITTRÉ). Phosphore de Kunkel. 'S'est dit longtemps du phosphore [infra B] parce qu'un chimiste nommé Kunkel parvint à extraire cette substance de l'urine en 1674' (LITTRÉ). 61 grains (...) de phosphore de Kunkel (LAVOISIER, Chim., t.1, 1789, p.58).
B. —Métalloïde solide, de numéro atomique 15, de poids atomique 30,97, brûlant avec une flamme éblouissante et un grand dégagement de chaleur et existant sous différentes formes allotropiques (symb. P). Phosphore (blanc). Phosphore de densité 1,82, de couleur ambrée, translucide, d'odeur alliacée, facilement inflammable, luminescent et très toxique. Phosphore (rouge). Phosphore de densité 2,18, d'une couleur variant du rose au violet, inodore, ne brûlant qu'au-dessus de 260°, non luminescent et non toxique. Sel de phosphore; teneur en phosphore; combustion, oxydation du phosphore; allumettes, bombe au phosphore; briller, luire comme le phosphore. Le phosphore pur (...) est solide, mais mou (...); à la température ordinaire, il (...) se résout peu à peu en une liqueur qui est l'acide phosphoreux (KAPELER, CAVENTOU, Manuel pharm. et drog., t.2, 1821, p.544). Nos actes s'attachent à nous comme sa lueur au phosphore. Ils nous consument, il est vrai, mais ils nous font notre splendeur (GIDE, Nourr. terr., 1897, p.157). V. aluminium ex. 4:
• ♦ ... l'allumette chimique (...) ne prit (...) sa plus grande diffusion qu'à partir de 1844, quand le chimiste suédois G. E. Pasch eut réussi à remplacer, dans la composition inflammable, le phosphore blanc vénéneux par l'inoffensif phosphore rouge. Ainsi naquirent, grandirent et se répandirent, nos familières allumettes suédoises.
P. ROUSSEAU, Hist. techn. et invent., 1967, p.226.
♦Phosphore(-)32. Isotope radioactif du phosphore. Hevesy et O. Chiewitz amorcèrent l'emploi des radio-isotopes artificiels en biologie en étudiant l'assimilation du phosphore-32 par les plantes (Hist. gén. sc., t.3, vol. 2, 1964, p.400). Le phosphore 32 (...) est émetteur de rayons  et
et  (...). Sa fixation par l'organisme (...) permet, en particulier, la localisation de certaines tumeurs malignes (LAITIER 1969).
(...). Sa fixation par l'organisme (...) permet, en particulier, la localisation de certaines tumeurs malignes (LAITIER 1969).
 et
et  (...). Sa fixation par l'organisme (...) permet, en particulier, la localisation de certaines tumeurs malignes (LAITIER 1969).
(...). Sa fixation par l'organisme (...) permet, en particulier, la localisation de certaines tumeurs malignes (LAITIER 1969). — Loc. adj., littér. De phosphore. Qui brille comme le phosphore. Ruissellement, traînée, yeux de phosphore. De grands éclairs bleuâtres, incessants, semblaient courir au ras du sol, en larges sillons de phosphore (ZOLA, Terre, 1887, p.113). Ô nuit ô splendide nuit où rampent Les célestes bêtes de phosphore (APOLL., Coul. temps, 1918, III, 3, p.955). Des hommes en bleu (...) épinglaient Aux becs de gaz des boutonnières de phosphore (ARAGON, Rom. inach., 1956, p.36).
C. —P. anal., gén. vieilli, littér.
1. P. anal. (avec la lumière du phosphore enflammé). Lumière intense et brève. Soudainement il fut éclairé par un phosphore accompagné d'une détonation semblable à celle d'une arme à feu (BOREL, Champavert, 1833, p.94). Un phosphore si rapide traverse, allume nos regards; de telles irradiations s'en échappent par étincelles (SAINTE-BEUVE, Volupté, t.1, 1834, p.62).
2. P. anal. (avec la luminescence du phosphore blanc). Lumière diffuse. Au milieu des ténèbres, les flots brillaient d'une infinité de phosphores (SAND, Melchior, 1853, p.267). Ô lune, (...) Ton rêve lumineux répand sur les gazons (...) Le phosphore argenté de tes chastes poisons (MUSELLI, Travaux et jeux, 1914, p.49).
D. —Au fig., littér. Ce qui éclaire, excite l'esprit. Rachilde ne fait pas de pornographie. Ses livres manquent de phosphore. Elle ne fait pas titiller (RENARD, Journal, 1890, p.59). Il n'a qu'un phosphore, la vérité (GIRAUDOUX, Électre, 1937, II, 8, p.199). Les mots nouveaux, les mots magiques, recéleurs du phosphore des désirs (ÉLUARD, Donner, 1939, p.75).
Prononc. et Orth:[ ]. Att. ds Ac. dep.1740. Étymol. et Hist. 1677 (Journal des savants, 2 août, p.107). Adaptation du gr.
]. Att. ds Ac. dep.1740. Étymol. et Hist. 1677 (Journal des savants, 2 août, p.107). Adaptation du gr.  «qui apporte ou donne la lumière», att. chez Platon en parlant des yeux, formé de
«qui apporte ou donne la lumière», att. chez Platon en parlant des yeux, formé de  -, de
-, de  «lumière» et de -
«lumière» et de - , de
, de  «porter»; cf. le lat. sc. mod. phosphorus 1675 (BAUDUIN, Aurum ... Hermeticum Phosphorus Hermeticus). Fréq. abs. littér.:147.
«porter»; cf. le lat. sc. mod. phosphorus 1675 (BAUDUIN, Aurum ... Hermeticum Phosphorus Hermeticus). Fréq. abs. littér.:147.
 ]. Att. ds Ac. dep.1740. Étymol. et Hist. 1677 (Journal des savants, 2 août, p.107). Adaptation du gr.
]. Att. ds Ac. dep.1740. Étymol. et Hist. 1677 (Journal des savants, 2 août, p.107). Adaptation du gr.  «qui apporte ou donne la lumière», att. chez Platon en parlant des yeux, formé de
«qui apporte ou donne la lumière», att. chez Platon en parlant des yeux, formé de 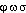 -, de
-, de 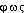 «lumière» et de -
«lumière» et de - , de
, de 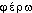 «porter»; cf. le lat. sc. mod. phosphorus 1675 (BAUDUIN, Aurum ... Hermeticum Phosphorus Hermeticus). Fréq. abs. littér.:147.
«porter»; cf. le lat. sc. mod. phosphorus 1675 (BAUDUIN, Aurum ... Hermeticum Phosphorus Hermeticus). Fréq. abs. littér.:147.DÉR. 1. Phosphorisme, subst. masc. Intoxication par le phosphore blanc. Le chapitre du phosphorisme professionnel est appelé à disparaître du cadre de la nosographie (MACAIGNE, Précis hyg., 1911, p.321). [Le foie] est cependant dans l'obésité pure moins gros et moins envahi par la graisse que dans (...) le phosphorisme (LE GENDRE ds Nouv. Traité Méd. fasc. 7 1924, p.302). Le phosphorisme aigu, dû à l'ingestion de phosphore, se manifeste par des troubles digestifs (...) puis une insuffisance hépatique aboutissant à la mort plus ou moins rapide selon la quantité absorbée (GARNIER-DEL. 1958). [Le] phosphorisme (...) chronique se caractérise par des accidents aux gencives et au niveau des dents (VERCH.-BUD. 1981). — [ ]. — 1re attest. 1858 (LITTRÉ-ROBIN); de phosphore, suff. -isme; cf. au XVIIIes. phosphorisme «phosphorescence» 1783 (BERTHOLON, De l'Electricité des végétaux, p.342 ds QUEM. DDL t.12) encore att. ds Lar. 20e. 2. Phosphorite, subst. fém., géol. Apatite compacte, à structure radiée, souvent très fossilifère, utilisée comme engrais. Gisements de phosphorite (...) du Quercy (LAPPARENT, Abr. géol., 1886, p.352). Phénomène diluvien (...) dissolvant la gangue calcaire et laissant les phosphorites au milieu d'un limon (HATON DE LA GOUPILLIÈRE, Exploitation mines, 1905, p.442). — [
]. — 1re attest. 1858 (LITTRÉ-ROBIN); de phosphore, suff. -isme; cf. au XVIIIes. phosphorisme «phosphorescence» 1783 (BERTHOLON, De l'Electricité des végétaux, p.342 ds QUEM. DDL t.12) encore att. ds Lar. 20e. 2. Phosphorite, subst. fém., géol. Apatite compacte, à structure radiée, souvent très fossilifère, utilisée comme engrais. Gisements de phosphorite (...) du Quercy (LAPPARENT, Abr. géol., 1886, p.352). Phénomène diluvien (...) dissolvant la gangue calcaire et laissant les phosphorites au milieu d'un limon (HATON DE LA GOUPILLIÈRE, Exploitation mines, 1905, p.442). — [ ]. — 1re attest. 1817 (Sc. nat. t.8, s.v. chaux); de phosphore, suff. -ite; cf. l'angl. phosphorite «id.» 1796 ds NED.
]. — 1re attest. 1817 (Sc. nat. t.8, s.v. chaux); de phosphore, suff. -ite; cf. l'angl. phosphorite «id.» 1796 ds NED.
 ]. — 1re attest. 1858 (LITTRÉ-ROBIN); de phosphore, suff. -isme; cf. au XVIIIes. phosphorisme «phosphorescence» 1783 (BERTHOLON, De l'Electricité des végétaux, p.342 ds QUEM. DDL t.12) encore att. ds Lar. 20e. 2. Phosphorite, subst. fém., géol. Apatite compacte, à structure radiée, souvent très fossilifère, utilisée comme engrais. Gisements de phosphorite (...) du Quercy (LAPPARENT, Abr. géol., 1886, p.352). Phénomène diluvien (...) dissolvant la gangue calcaire et laissant les phosphorites au milieu d'un limon (HATON DE LA GOUPILLIÈRE, Exploitation mines, 1905, p.442). — [
]. — 1re attest. 1858 (LITTRÉ-ROBIN); de phosphore, suff. -isme; cf. au XVIIIes. phosphorisme «phosphorescence» 1783 (BERTHOLON, De l'Electricité des végétaux, p.342 ds QUEM. DDL t.12) encore att. ds Lar. 20e. 2. Phosphorite, subst. fém., géol. Apatite compacte, à structure radiée, souvent très fossilifère, utilisée comme engrais. Gisements de phosphorite (...) du Quercy (LAPPARENT, Abr. géol., 1886, p.352). Phénomène diluvien (...) dissolvant la gangue calcaire et laissant les phosphorites au milieu d'un limon (HATON DE LA GOUPILLIÈRE, Exploitation mines, 1905, p.442). — [ ]. — 1re attest. 1817 (Sc. nat. t.8, s.v. chaux); de phosphore, suff. -ite; cf. l'angl. phosphorite «id.» 1796 ds NED.
]. — 1re attest. 1817 (Sc. nat. t.8, s.v. chaux); de phosphore, suff. -ite; cf. l'angl. phosphorite «id.» 1796 ds NED.BBG. —GOHIN 1903, p.359.
phosphore [fɔsfɔʀ] n. m.
ÉTYM. 1677; du grec phôsphoros « lumineux », de phôs « lumière ». → aussi -phore.
❖
1 Vx. Substance capable de devenir lumineuse dans l'obscurité. || Phosphore de Bologne (ou litheosphorus, pierre de Bologne) : pierre de sulfate de baryum, découverte près de Bologne et qui, après avoir été calcinée et refroidie, émettait une lueur rougeâtre dans l'obscurité. || Phosphore de Baudoin (nitrate de calcium calciné), de Homberg (chlorure de calcium fondu au feu), de Kunkel (phosphore au sens moderne).
2 (1677). Mod. Élément de no at. 15 (symb. P, p. at. 30,974), dont on connaît six isotopes radioactifs et qui existe sous plusieurs formes allotropiques. || Le phosphore 32 (isotope 32) est très employé par la recherche biologique. || Phosphore blanc : solide fusible à 44 °C, très facilement inflammable, luminescent dans l'obscurité (⇒ Phosphorescence), très toxique (⇒ Phosphorisme). || Phosphore rouge : autre variété allotropique du phosphore ne s'enflammant qu'au-dessus de 250 °C et non toxique. || Combinaisons du phosphore avec un métal (phosphures métalliques). || Le phosphore a été découvert en 1669 par l'alchimiste Brand, qui cherchait à obtenir la pierre philosophale en partant de l'urine humaine. || De nos jours, le phosphore s'extrait des os des animaux, mais surtout des phosphates naturels (réduction au four électrique par du charbon en présence de silice). — Le phosphore est très disséminé dans la nature : on le trouve sous forme de phosphates minéraux, dans certains minerais de fer (→ Minette, cit.), sous forme d'acide phosphorique dans la terre arable; dans les tissus animaux… (les os notamment). — Utilisation du phosphore : autrefois, fabrication des allumettes phosphorées; de nos jours, préparation de l'acide phosphorique, de dérivés halogénés (pour la fabrication d'insecticides, d'anticryptogamiques…), chargement de projectiles incendiaires (bombes au phosphore).
➪ tableau Noms de remèdes.
3 (1812). Par métaphore (en parlant de choses qui brillent, de lueurs). || Des yeux de phosphore (→ Luire, cit. 8; nocturne, cit. 5).
1 Une zone de phosphore, rouge de la rougeur boréale, flottait comme un haillon de flamme spectrale derrière les épaisseurs de nuages.
Hugo, les Travailleurs de la mer, II, III, VI.
2 Il n'y avait pas de coups de tonnerre; mais de grands éclairs bleuâtres, incessants, semblaient courir au ras du sol, en larges sillons de phosphore (…)
Zola, la Terre, II, II.
3 Enfin le soir les volets de fer claquaient fort
Et des hommes en bleu vers l'Étoile épinglaient
Aux becs de gaz des boutonnières de phosphore
Aragon, le Roman inachevé, p. 36.
4 Et puis, sur le grand miroir phosphorescent de la mer, il y avait des milliers de flammes folles; c'étaient comme des petites lampes qui s'allumaient d'elles-mêmes partout, mystérieuses, brûlaient quelques secondes et puis mouraient. Ces nuits étaient pâmées de chaleur, pleines de phosphore, et toute cette immensité éteinte couvait de la lumière (…)
Loti, Mon frère Yves, XI.
❖
COMP. et DÉR. Phosphate. Phosphines, phosphite, phosphoré, phosphorer, phosphorescence, phosphoreux, phosphorique, phosphorisme, phosphorite, phosphorolyse, phosphoryle, phosphure. Cf. les éléments phospho-, phosphoro- (et composés).
Encyclopédie Universelle. 2012.