AZOTE
L’azote est un gaz incolore, inodore et sans saveur qui constitue un peu plus des trois quarts du volume de l’atmosphère. Il existe également dans les fumerolles volcaniques.
Certaines météorites en renferment et, par des méthodes spectroscopiques, on a mis sa présence en évidence dans le Soleil et de nombreuses étoiles.
Bien que ses composés soient présents dans un grand nombre de substances naturelles, son importance quantitative dans la lithosphère et l’hydrosphère du globe terrestre est négligeable. C’est pourquoi on l’extrait industriellement par distillation de l’air préalablement liquéfié. Cette méthode de production de l’azote a pour inconvénient de laisser dans le gaz obtenu des impuretés, comme l’oxygène. L’azote spectroscopiquement pur est préparé par décomposition thermique des azotures, sous vide.
L’abondance de l’azote dans l’atmosphère n’est pas étrangère à son rôle essentiel dans la biosphère: chez les êtres vivants, les composés de l’azote, protéines, acides nucléiques, etc., sont des constituants fondamentaux de la matière organique. Du fait de la labilité des structures et des processus vitaux, perpétuellement renouvelés, des modifications incessantes caractérisent les rapports de l’azote atmosphérique et de l’azote intégré dans la biosphère. Des échanges réversibles se produisent continuellement entre l’état organique, macro ou micromoléculaire et l’état minéral représenté par les ions ammonium, nitrite et enfin par l’azote gazeux.
Au total, des transformations continuelles de l’état chimique de l’azote, réalisant un cycle biogéochimique de cet élément, découlent de la présence de la vie sur terre et la conditionnent. L’homme bénéficie directement et indirectement de ces processus. Il intervient dans leur déroulement par son activité agronomique et industrielle: synthèse d’ammoniac et autres composés azotés servant d’engrais, fabrication de produits pharmaceutiques, de colorants... et d’explosifs!
1. Propriétés
Les numéro et masse atomiques de l’azote sont respectivement 7 et 14,008. Ce gaz a pour températures d’ébullition et de fusion 漣 195,7 0C et 漣 210 0C. La dimension de son rayon atomique est d’environ 0,07 nm et son premier potentiel d’ionisation s’élève à 14,5 V. L’azote naturel comprend 99,65 p. 100 d’isotope 14N et 0,35 p. 100 d’isotope 15N. Après enrichissement, celui-ci est souvent utilisé comme traceur.
Structure électronique de l’azote et de ses composés
L’atome d’azote, qui se place en tête de la colonne V du tableau périodique de Mendeleïev, correspond à une configuration 1s 22s 22p 3. Le diagramme de corrélation électronique de la molécule 2 est donc caractérisé par l’occupation des niveaux 靖 (s ), 靖 列(s ), 靖(p z ), 神(p x ) et 神(p y ), à l’exclusion de tout niveau 神 列; cette propriété explique que l’enthalpie de dissociation soit élevée (face=F0019 漣 170 kcal/mole 2), supérieure en particulier à celles du monoxyde d’azote NO ou de l’oxygène, dont les niveaux 神 列 sont occupés.
Dans ces composés covalents l’azote répond aux types d’hybridation suivants (fig. 1):
sp , avec formation de deux liaisons 神; ex.: l’ion 3- (dN-N = 0,115 nm);
sp 2, avec une liaison 神; ex.: l’ion 2-. Dans 3H les deux types d’hybridation apparaissent simultanément (d = 0,114 nm et 0,125 nm);
sp 3, avec un nombre de «doublets non engagés» qui peut être égal à 0, 1, 2 ou 3 (ex.: la série isoélectronique NH4, NH3, NH2-, NH2-). Ceux-ci confèrent un caractère donneur aux molécules azotées qui les possèdent. Ce caractère donneur est nettement plus marqué que celui des éléments V et VB qui suivent l’azote dans le tableau périodique, pour lesquels le doublet s prend progressivement le caractère de «doublet inerte». Il décroît lorsque les atomes liés à l’azote deviennent plus électronégatifs: les composés d’addition de 3 sont moins stables que ceux de NH3. L’angle de liaison diminue avec le nombre de doublets non engagés et avec le caractère électronégatif du coordinat (il est de 102,10 pour 3 au lieu de 107,30 pour NH3).
Un groupement dans lequel l’azote est lié à trois entités – atomes ou radicaux – possède une configuration plane lorsque l’hybridation est de type sp 2 (ex.: NO3-), pyramidale quand elle est de type sp 3 (ex.: NH3). Un cas intermédiaire est celui des composés silylés (ex.: N(SiH3)3) par suite d’une liaison 神(pd ) entre N et Si.
Propriétés chimiques
Lavoisier, qui lui donna son nom en 1786, et les premiers chimistes qui l’étudièrent pensaient que l’azote ne possédait qu’une faible réactivité chimique, d’où cette dénomination d’origine grecque impliquant une inertie biologique. En fait, la faible réactivité de l’azote, qui est liée à l’enthalpie de formation élevée de la molécule 2, disparaît souvent par élévation de température ou sous l’effet de catalyseurs appropriés. Cette propriété explique que, dans les réactions de nitruration, on tend souvent à remplacer les molécules d’azote par l’ammoniac NH3, qui se dissocie beaucoup plus aisément, voire par l’azote préalablement activé par dissociation thermique ou électrique.
Action de l’azote sur les métaux: les nitrures
À la pression atmosphérique, l’azote ne semble réagir qu’avec le lithium à température ordinaire; il réagit à température plus élevée avec les métaux alcalino-terreux, l’aluminium, les éléments de transition de la première famille, les éléments les plus électropositifs de la seconde et de la troisième, les lanthanides et les actinides. Les molécules d’azote ne réagissent avec le sodium ou le potassium qu’à pression élevée. Les composés obtenus portent le nom de nitrures . Les réactions de nitruration sont souvent entravées par la formation initiale d’une couche superficielle de nitrure qui joue un rôle protecteur; cette propriété a été utilisée industriellement pour la cémentation du fer.
Trois types de nitrures ont été mis en évidence:
1. Les nitrures des éléments les plus électropositifs , tels ceux de lithium Li3N ou de calcium Ca32, souvent appelés nitrures salins, sont caractérisés, schématiquement tout au moins, par l’existence d’ions 3-. On les obtient aisément par décomposition thermique des amidures , composés préparés par action de l’ammoniac sur le métal correspondant; cette décomposition est marquée par la formation intermédiaire d’ imidures :
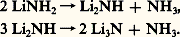
L’eau les hydrolyse dès la température ordinaire avec libération d’ammoniac:

Du fait de sa structure Li3N est un excellent conducteur de l’ion lithium.
2. Les nitrures d’éléments légers sont de caractère covalent , tels le nitrure de bore BN ou le nitrure d’aluminium AlN.
Isostère du carbone, le nitrure de bore existe sous deux formes allotropiques, isostructurales l’une du graphite, l’autre du diamant, dont il possède la dureté avec une moindre aptitude à l’oxydation. Les nitrures d’aluminium et de gallium possèdent la structure de la wurtzite. Leur hydrolyse, qui mène également à la formation d’ammoniac, s’effectue plus difficilement que celle des nitrures salins.
3. Les nitrures des éléments de transition peuvent être considérés comme des composés d’insertion de l’azote dans une maille métallique, le plus souvent cubique à faces centrées. Leur formule varie avec la nature des sites occupés et le degré de saturation de ces sites, ils sont souvent non stœchiométriques. Du fait d’une structure plus compacte, leur dureté est très supérieure à celle du métal (dureté Mohs voisine de 9), il en est de même pour leur point de fusion (le nitrure de hafnium HfN, par exemple, fond vers 3 200 0C au lieu de 2 200 0C pour le hafnium lui-même). Leur conductivité électrique est importante, à peine plus faible que celle des métaux correspondants. Leur inertie aux agents chimiques, aux oxydants en particulier, dépasse largement celle du métal. Ils donnent des solutions solides avec des composés homologues du même élément ou d’éléments voisins (TiN avec TiO, TiS, TiC ou VN, par exemple).
Les oxynitrures ont fait l’objet de recherches du fait de la facilité de la substitution oxygène-azote. On les obtient soit par synthèse directe, soit par action de l’ammoniac sur l’oxyde. Les oxynitrures sont plus covalents que les oxydes correspondants.
Action de l’azote sur les éléments non métalliques
La réaction la plus importante avec les corps simples est la formation d’ammoniac par action de l’hydrogène sous pression en présence d’un catalyseur, généralement à base de fer, qui s’effectue dès 250 0C:
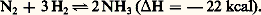
Bien que le rendement soit relativement faible, sauf pour des pressions atteignant quelques milliers d’atmosphères, c’est la méthode qui est utilisée industriellement pour la préparation de l’ammoniac en raison de sa commodité et de son bas prix de revient.
L’action de l’oxygène , qui mène au monoxyde d’azote NO, n’est possible qu’à température élevée, sous l’action d’un arc électrique par exemple. Même lorsque les produits de réaction sont soumis à une trempe brutale le rendement est encore très faible, NO étant endothermique à température ordinaire.
Les halogènes, même le fluor, sont sans action.
Parmi les réactions de l’azote avec les composés minéraux , il convient de signaler la formation à 700 0C de la cyanamide calcique à partir du carbure de calcium:

La cyanamide est utilisée comme engrais, elle est également une matière première importante de l’industrie chimique, tant pour la fabrication des cyanures que pour celle de composés organiques comme l’urée ou la thiourée.
Diagramme d’oxydoréduction de l’azote et de ses composés
Le diagramme de la figure 2 caractérise le pouvoir oxydant ou réducteur des principaux groupements hydrogénés ou oxygénés de l’azote à pH = 0 et pH = 14: le pouvoir oxydant est exprimé par le produit n E0 de la charge formelle n de l’azote dans chacun des cas envisagés et du potentiel normal d’oxydoréduction E0 déterminé à 25 0C par rapport à l’azote moléculaire. Le potentiel normal d’un système est donc représenté par la pente du segment joignant les points figuratifs des espèces en équilibre: le système est d’autant plus oxydant que la valeur algébrique de la pente est plus élevée. Les systèmes de référence choisis sont le couple H+/H2 à l’état standard à pH = 0, le système OH/H2O avec a OH- = 1 à pH = 14. Le diagramme permet d’apprécier le comportement des divers groupements azotés vis-à-vis des solutions aqueuses oxydantes ou réductrices et leur stabilité relative.
2. Composés
Les composés de l’azote les plus importants (ammoniac et ses dérivés, acide nitrique) sont étudiés par ailleurs (cf. AMMONIAC, acide NITRIQUE). On ne traitera ici que des composés suivants: hydrazine, hydroxylamine, acide azothydrique et azotures, oxydes azoteux et azotique, anhydride et acide nitreux, peroxyde d’azote.
L’hydrazine N2H4
La méthode de préparation habituellement utilisée est l’action de l’ammoniac sur une solution d’hypochlorite. La réaction se fait par l’intermédiaire de la chloramine NH2Cl et mène, mais avec un rendement toujours inférieur à 100 p. 100, au chlorure d’hydrazinium:
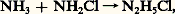
On passe à l’hydrazine hydratée par hydrolyse basique. La déshydratation peut s’effectuer par distillation en présence d’oxyde alcalino-terreux.
L’hydrazine anhydre, dont la formule structurale peut s’écrire NH2 漣NH2 avec deux groupements NH2 perpendiculaires et bloqués l’un par rapport à l’autre, est un liquide corrosif et incolore, dont le point de fusion est voisin de 2 0C. Fortement hygroscopique, elle fume à l’air. Un hydrate de composition 2H4, H2O a été isolé.
Endothermique, l’hydrazine se décompose soit sous l’effet de catalyseurs appropriés (ions Fe3+ ou Cu2+), soit par élévation de température: la dégradation mène à un mélange d’ammoniac, d’azote et d’hydrogène (la position, dans la figure 2, de N2H4 par rapport au mélange de composition correspondante 2NH3, 2 est à cet égard significative: l’énergie du second système est inférieure à celle du premier). Cette propriété de 2H4, associée à son caractère réducteur, explique son utilisation comme carburant de propergol, couplée avec l’eau oxygénée (H22) ou l’acide nitrique (HNO3). L’instabilité de l’hydrazine permet de comprendre également que certaines réactions d’oxydation soient explosives.
Par suite de son caractère donneur, 2H4 possède des propriétés basiques en solution aqueuse:

Même la première fonction basique est faible, la structure de 2H4 explique que la basicité soit inférieure à celle de l’ammoniac (la première constante de basicité est de l’ordre de 10-6 au lieu de 10-5).
Ce caractère basique est suffisamment marqué, cependant, pour permettre l’isolement de sels d’hydrazinium, 2H5Cl ou 2H5HS4 par exemple, beaucoup plus stables que l’hydrazine elle-même.
L’hydrazine donne également des réactions de substitution avec les métaux alcalins, par exemple:

Cette propriété résulte sans doute de l’existence d’une faible dissociation ionique:

La diméthylhydrazine asymétrique NH2 漣N(CH3)2 est utilisée comme carburant de fusée, associée à l’acide nitrique fumant. Ce couple constitue un propergol de très haute fidélité.
L’hydroxylamine NH2OH
On l’obtient par action d’un réducteur doux sur les acides oxygénés de l’azote ou encore sur les sels correspondants. Elle se présente sous forme de cristaux blancs de symétrie rhomboédrique, qui fondent vers 32 0C, fortement hygroscopiques et très solubles dans l’eau. Le solide aussi bien que les solutions aqueuses se décomposent progressivement selon des réactions qui diffèrent avec les conditions expérimentales, mais qui mènent toujours à la formation d’ammoniac et d’un composé dans lequel l’azote possède une charge formelle plus élevée, azote ou hémioxyde d’azote 2O par exemple (cf. diagramme, fig. 2).
Par suite du caractère fortement électronégatif du groupement OH, l’hydroxylamine est un donneur moins marqué que l’ammoniac ou que l’hydrazine. Ses solutions sont donc moins basiques (la constante de basicité est de l’ordre de 10-9) et les sels d’hydroxylammonium correspondants, NH3(OH)Cl ou [NH3(OH)]2S4 par exemple, sont beaucoup moins stables à la chaleur que les sels d’ammonium.
Les réactions de réduction (avec le zinc par exemple) ou d’oxydation, par l’oxygène atmosphérique, peuvent être très vives, tant à cause des valeurs des potentiels d’oxydoréduction correspondants que de l’instabilité thermique de NH2OH.
L’acide azothydrique N3H et les azotures
L’acide azothydrique s’obtient généralement par action d’un composé contenant deux atomes d’azote adjacents sur un composé monoatomique de l’azote:

Ces modes de préparation sont toujours accompagnés de réactions parasites.
3H se présente sous forme de liquide incolore (ébullition E760mm = 37 0C), d’odeur désagréable, toxique. Sa structure se déduit de celle de l’ion 3- par hybridation sp 2 de l’atome d’azote lié à l’hydrogène (fig. 1). Le transfert de charge sur l’atome d’hydrogène entraîne un allongement de la distance N 漣 N (0,125 nm au lieu de 0,114 nm pour la liaison N 漣 N adjacente).
Endothermique comme l’hydrazine ou l’hydroxylamine, l’acide azothydrique se décompose non seulement par voie catalytique ou thermique, mais également au choc en donnant des explosions. Les solutions aqueuses sont stables lorsqu’elles sont suffisamment diluées, mais trop concentrées elles donnent naissance à l’ammoniac et l’azote (fig. 2):

Les solutions aqueuses sont moyennement acides (Ka = 10-5), l’existence de liaisons 神 dans l’ion 3- limitant son caractère donneur.
Instabilité en solution concentrée et propriétés acides expliquent qu’en solution aqueuse la réduction de l’acide azothydrique mène à l’azote et aux sels d’ammonium.
Les sels qui correspondent à l’acide azothydrique sont les azotures . Alors que les azotures alcalins sont relativement stables, les azotures lourds peuvent se comporter comme des fulminants avec libération d’azote. Leurs solubilités sont souvent proches de celles des chlorures correspondants, malgré l’absence de toute isotypie cristalline.
L’oxyde azoteux N2O ou hémioxyde d’azote
L’hémioxyde est généralement préparé par décomposition thermique du nitrate d’ammonium NH43:

La figure 2 montre effectivement qu’en solution à 25 0C le couple H32O est plus oxydant que le couple 2O/NH4+. Le point représentant le nitrate d’ammonium est d’ailleurs situé sur la même verticale que 2O, mais il lui correspond une énergie plus élevée.
On peut obtenir également l’hémioxyde par réduction ménagée des mono- et dioxydes d’azote (NO et NO2). C’est un gaz incolore (E760mm = 漣 88 0C), relativement soluble dans l’eau, bien que l’équilibre ionique des solutions aqueuses ne soit guère modifié lors de sa dissolution. Il donne un hydrate du type «hydrate de gaz». Il possède une structure linéaire comparable à celle de l’ion isostère 3-, mais dissymétrique. Les distances N 漣 N (0,113 nm) et N 漣 O (0,119 nm) particulièrement courtes résultent de la délocalisation des électrons 神. L’isostérie avec le dioxyde de carbone C2, de structure analogue, explique une certaine similitude de propriétés physiques.
L’oxyde azoteux 2O, excitant nerveux en petites quantités, est utilisé comme anesthésique à dose plus élevée.
Bien qu’endothermique, il est relativement stable. La décomposition thermique libère ses éléments constitutifs. Son pouvoir oxydant, plus important que celui de l’air, ne se manifeste de même qu’après l’élévation de température.
Son comportement en solution aqueuse est celui d’un «oxyde indifférent», bien qu’il ait été longtemps considéré comme l’anhydride d’un acide hypoazoteux non isolé (NOH)2. Celui-ci est en fait très instable tant à la chaleur qu’au choc; la décomposition des solutions aqueuses de (NOH)2 peut mener à la formation de 2O, mais elle n’est pas réversible: dans le diagramme de la figure 2, (NOH)2 est représenté par un point de même abscisse que 2O, mais d’ordonnée plus élevée.
L’oxyde azotique NO
Fortement endothermique ( H2NO = 42 kcal), le monoxyde d’azote NO ne s’obtient par synthèse directe qu’à haute température avec des rendements d’ailleurs très faibles (le taux en NO formé n’est encore que de 2 p. 100 à 2 200 0C).
La méthode habituelle de préparation est la combustion de l’ammoniac sur toile de platine-rhodium (procédé Kuhlmann):
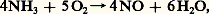
dont le rendement à 750 0C est de 99 p. 100.
C’est un gaz incolore, difficilement liquéfiable (E760mm = 漣 151 0C). Beaucoup moins soluble dans l’eau que l’hémioxyde, il a comme lui le comportement d’un «oxyde indifférent»; il donne également un hydrate de type clathrate. Son caractère paramagnétique est lié à la présence d’un électron célibataire dans un niveau 神 列. Celui-ci explique également la plupart de ses propriétés chimiques: il peut être soit mis en commun, soit cédé, soit même apparié avec un autre électron. À l’état solide, l’oxyde azotique est associé sous forme de molécules (NO)2. Faiblement dissocié à l’état liquide, (NO)2 l’est presque totalement au stade gazeux.
Composé endothermique, l’oxyde azotique se décompose lentement par élévation de température ou augmentation de pression. Plus riche en oxygène que l’air, NO est un oxydant plus énergique: sa réduction donne naissance à l’azote. Mais il est également réducteur. Dès la température ordinaire, il s’oxyde en présence d’air en donnant le peroxyde 2:

Une partie du peroxyde formé réagit en fait sur l’oxyde azotique résiduel pour donner l’anhydride nitreux ou sesquioxyde d’azote 23 selon une réaction équilibrée:

Le mélange gazeux obtenu, dont la constitution varie avec les conditions physiques, porte le nom de «vapeurs nitreuses».
Avec les halogènes, le monoxyde donne des composés à liaison covalente du type NOCl.
Un groupement nitrosyle +, correspondant au départ de l’électron 神, apparaît soit dans des composés à caractère salin comme NOCl4 (il présente alors une analogie structurale avec le potassium), soit dans des ions complexes comme l’ion nitroprussiate [Fe(CN)5(NO)]2-. La distance N 漣 O est plus courte au sein du radical + que dans NO (0,106 nm au lieu de 0,115 nm), ce raccourcissement correspond à l’absence d’électron antiliant. Celle-ci se traduit également par la disparition du paramagnétisme. La fréquence de vibration I.R. est d’autant plus élevée par rapport à celle de NO (1 878 cm-1) que le radical nitrosyle possède un caractère ionique plus marqué.
Des groupements -, dans lesquels l’électron célibataire a capté un électron disponible grâce à un processus d’oxydation, ont été mis en évidence au contraire par abaissement de fréquence, notamment dans les complexes du cobalt III, tels que [CO(NH3)5(NO)]Cl2, ou du ruthénium tétravalent, comme Ru(OH)3(NO).
L’oxyde azotique donne des composés d’addition avec de nombreux métaux de transition: métaux nitrosyles, tels que Fe(NO)4, ou nitrosyles-carbonyles comme Fe(CO)2(NO)2. Dans ce dernier cas, le fait que NO est susceptible de céder trois électrons, alors que CO ne dispose que d’un doublet, explique que NO se substitue volontiers à CO à raison de deux groupements coordinés pour trois.
L’anhydride nitreux N23 et l’acide nitreux HNO2
L’anhydride nitreux ou sesquioxyde d’azote n’est pur qu’à l’état solide. Liquide ou gazeux, il est dissocié en mono- et dioxydes dont la combinaison lui tient d’ailleurs lieu de mode de préparation.
La molécule de 23 est plane. Les deux atomes d’azote sont liés entre eux et comportent une hybridation sp 2. L’un d’entre eux est associé à deux atomes d’oxygène, l’autre à un seul oxygène, un doublet n’étant pas engagé. Une certaine polarité semble correspondre à la formule limite (NO+)(NO2-).
En présence d’eau, l’anhydride 23 se transforme progressivement en acide nitreux.
Ce dernier n’a jamais pu être isolé. Il se décompose lentement avec le temps, même en solution diluée. C’est un acide faible (la constante d’acidité est de l’ordre de 10-4). Il peut jouer à la fois le rôle d’oxydant, vis-à-vis de l’hydrogène sulfuré par exemple, et de réducteur, en présence de permanganate par exemple.
Les sels correspondants sont les nitrites caractérisés par l’ion 2- (fig. 1). En solution aqueuse une hydrolyse donne naissance au nitrate et à l’oxyde azotique:
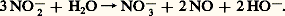
Seules sont relativement stables les solutions de nitrites alcalins ou alcalino-terreux.
La stabilité thermique des nitrites, dans lesquels le doublet non engagé de l’azote peut être considéré comme antiliant, est très limitée.
Le peroxyde (ou dioxyde) d’azote
Sa formule à l’état liquide est 24. Mais, dès le point d’ébullition (22 0C), ce dimère est partiellement dissocié en molécules 2; cette dissociation, qui est d’autant plus importante que la température est plus élevée, est totale à 220 0C sous la pression atmosphérique. Vers 500 0C, une nouvelle dissociation apparaît, avec formation d’oxyde azotique et d’oxygène, NO obtenu réagissant lui-même partiellement avec 2 pour donner 23 (fig. 3).
La faible valeur de l’enthalpie de dissociation de 24, déterminée à partir de la courbe d’équilibre pression-température (13,9 kcal), correspond à une distance N 漣 N particulièrement longue (0,164 nm).
La structure électronique du dioxyde 2 est semblable à celle de l’ion nitrite 2. La suppression d’un électron affecte essentiellement l’orbitale sp 2 non engagée de l’azote, qui est occupée par un doublet dans 2-: elle entraîne l’accroissement de l’angle de liaison qui passe de 1150 à 1340. Un affaiblissement du caractère 神 des liaisons N 漣 O se manifeste cependant, marqué par un allongement des distances correspondantes (0,124 nm au lieu de 0,119 nm).
La présence d’un électron célibataire explique quelques-unes des propriétés physiques de 2: paramagnétisme, coloration brune qui le caractérise au sein des «vapeurs nitreuses». La tendance de cet électron à se combiner avec un homologue de même énergie est à l’origine de la formation, à basse température, de molécules 24. Elle permet de comprendre la formation de composés tels que le chlorure de nitryle 2Cl. Par suite de la plus grande délocalisation de l’électron célibataire, 2 a moins tendance à donner naissance à un radical 2 que NO à former le groupement +.
À l’état liquide 24 est cependant faiblement ionisé:
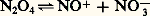
On connaît quelques sels de nitryle, tel le chlorate 2Cl4, dans lesquels le groupement 2+ est linéaire par suite de la disparition de l’effet répulsif qu’entraînait la présence d’un électron non engagé au sein de la molécule 2. 2+ est d’ailleurs isostère du dioxyde de carbone C2.
Le peroxyde d’azote se dismute en présence d’eau selon une réaction qui permet de le qualifier d’«anhydride mixte»:

La réaction, lente à pH = 7, est fortement accélérée en présence d’un excès d’ions OH- (fig. 2).
2 est un oxydant beaucoup plus énergique que NO ou 23: le mercure, par exemple, est oxydé dès la température ordinaire.
Le chlore l’oxyde cependant en solution aqueuse [E0(Cl2/Cl-) = 1,36 V]:
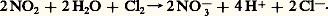
2, qui est aisément décelable, non seulement par sa couleur, mais également par son odeur douceâtre, semble responsable de la toxicité des vapeurs nitreuses, qui attaquent les tissus pulmonaires et les muscles cardiaques.
azote [ azɔt ] n. m. ♦ Corps simple, appelé autrefois nitrogène (symb. N; no at. 7; m. at. 14,008), gaz incolore, inodore, chimiquement peu actif, qui entre dans la composition de l'atmosphère (4/5) et des tissus vivants, animaux et végétaux (protéines). Cycle de l'azote : circulation des composés de l'azote dans la nature, par l'intermédiaire des organismes végétaux, animaux. Fixation de l'azote atmosphérique, effectuée par des bactéries symbiotes des nodosités des légumineuses et permettant d'obtenir des composés de l'azote (économie d'engrais). ⇒ nitrogénase. Peroxyde d'azote (NO2). Protoxyde d'azote (N2O) :gaz hilarant (⇒aussi azoteux, azotique; nitrate, nitrure) .
● azote nom masculin (du grec dzôê, vie) Corps gazeux (N2) à la température ordinaire, qui constitue environ les quatre cinquièmes en volume de l'air atmosphérique. (Élément chimique de symbole N.) Numéro atomique : 7 Masse atomique : 14,006 7 Point d'ébullition : −195,8 °C Point de fusion : −210 °C Densité par rapport à l'air : 0,97 Élément constitutif fondamental de la matière vivante, au même titre que le carbone, l'oxygène et l'hydrogène. ● azote (difficultés) nom masculin (du grec dzôê, vie) Genre Masculin : l'azote est présent dans l'air. ● azote (expressions) nom masculin (du grec dzôê, vie) Azote ammoniacal, azote combiné avec l'hydrogène pour former le radical chimique NH4. Cycle de l'azote, série de transformations par lesquelles l'azote circule entre les règnes minéral, végétal et animal.
azote
n. m. élément (symbole N) de numéro atomique Z = 7. L'azote est un des principaux éléments constitutifs de la matière vivante.
— Gaz (N 2: diazote), incolore et inodore, peu réactif et peu soluble dans l'eau. L'azote constitue 78 % environ du volume de l'atmosphère terrestre.
Encycl. Biochim. - Cycle de l'azote. Les végétaux supérieurs absorbent les nitrates du sol et incorporent l'azote dans des composés organiques (acides nucléiques, protéines). Les animaux consomment ces végétaux et incorporent ainsi l'azote. Quand ils meurent, les microorganismes responsables de la putréfaction de leurs cadavres libèrent les produits ammoniacaux qui vont être transformés en nitrates réutilisables par les végétaux supérieurs.
⇒AZOTE, subst. masc.
CHIM. Gaz inerte, incolore et inodore, qui entre pour environ 4/5 dans la composition de l'air atmosphérique et qui, à l'état combiné, est présent dans les minéraux, sous forme de sels ammoniacaux et de nitrates, et dans les protéines des matières organiques. Synon. vieillis air phlogistique, mofette atmosphérique, air méphitique, parfois alcaligène ou mitrogène (BESCH. 1845 et CHESN. 1857) :
• 1. Cette obligation est imposée par les lois mêmes du fonctionnement vital, et c'est pourquoi elle est si impérieuse. Un minimum de protides est nécessaire, par exemple, parce que ces substances [protides, lipides, glucides] sont les seules sources d'azote pour l'organisme; or, celui-ci perd chaque jour des quantités notables d'azote sous forme d'urée.
R. LALANNE, L'Alim. hum., 1942, p. 43.
— Cycle de l'azote. ,,Circulation des composés de l'azote dans la nature par l'intermédiaire des différents organismes auxquels l'azote est indispensable`` (UV.-CHAPMAN 1956) :
• 2. Il y a d'abord les interactions des vivants entre eux, interdépendance de la nutrition, de la respiration du règne végétal et du règne animal que mettent en évidence les grands cycles, classiques maintenant, du carbone et de l'azote.
Ch. COMBALUZIER, Introd. à la géol., 1961, p. 63.
♦ Emploi adj. Gaz azote.
— Spécialement
a) Azote aminé ou amidé. Azote combiné présent dans la fonction amine ou amide. Azote ammoniacal. Azote combiné présent dans les combinaisons contenant le radical ammonium. Azote nitrique. Azote combiné présent sous forme de nitrate. Azote protéique. Azote combiné présent sous forme de protéine.
b) Oxyde d'azote de formule NO. Gaz incolore qui s'oxyde spontanément au contact de l'air. Synon. plus fréq. monoxyde d'azote, oxyde azotique ou nitrique. Peroxyde d'azote de formule NO2. Liquide de couleur jaune pâle qui bout à 21° C. en donnant des vapeurs rutilantes. Synon. dioxyde d'azote. Protoxyde d'azote de formule N2O. Gaz incolore et inodore, à petite dose c'est un excitant, à plus forte dose c'est un anesthésique qui fut employé en chirurgie. Synon. gaz hilarant, oxyde azoteux ou nitreux :
• 3. L'homme, sous la pression d'un sentiment arrivé au point d'être une monomanie à cause de son intensité, se trouve souvent dans la situation où le plongent l'opium, le hashisch et le protoxyde d'azote.
BALZAC, Splendeurs et misères des courtisanes, 1847, p. 479.
PRONONC. — 1. Forme phon. :[ ]. Enq. :/azot/. 2. Homon. :azoth, terme d'alchimie.
]. Enq. :/azot/. 2. Homon. :azoth, terme d'alchimie.
 ]. Enq. :/azot/. 2. Homon. :azoth, terme d'alchimie.
]. Enq. :/azot/. 2. Homon. :azoth, terme d'alchimie. ÉTYMOL. ET HIST. — 1787 chim. (GUYTON DE MORVEAU, Méthode de nomenclature chimique, Paris, p. 36 : Dans ces circonstances nous n'avons pas cru pouvoir mieux faire que de nous arrêter à cette autre propriété de l'air phlogistiqué, qu'il manifeste si sensiblement, de ne pas entretenir la vie des animaux, d'être réellement non-vital, de l'être, en un mot, dans un sens plus vrai que les gaz acides et hépatiques qui ne font pas comme lui partie essentielle de la masse atmosphérique, et nous l'avons nommé azote); 1792 gaz azote (M. Fourcroy ds Encyclop. méthod., chimie, pharm. et métal., Paris, Panckoucke).
STAT. — Fréq. abs. littér. :99.
BBG. — BADER-TH. 1962. — BOUILLET 1859. — BRARD 1838. — CHARLES 1960. — CHESN. 1857. — COLAS-CAB. 1968. — DUVAL 1959. — Électron. 1963-64. — Forest. 1946. — FROMH.-KING 1968. — GALIANA Astronaut. 1963. — GALIANA Déc. sc. 1968. — GEORGE 1970. — GRAND. 1962. — Lar. comm. 1930. — Lar. méd. 1970. — LITTRÉ-ROBIN 1865. — Méd. Biol. t. 1 1970. — MONT. 1967. — Mots rares 1965. — Nucl. 1964. — NYSTEN 1824. — PAMART (P.). De l'alchimie à la chimie. Vie Lang. 1969, p. 142. — PLAIS.-CAILL. 1958. — PRIVAT-FOC. 1870. — Sc. 1962. — UV.-CHAPMAN 1956.
azote [azɔt] n. m.
❖
♦ Corps simple (symb. N, pour nitrogène, vx; p. at. 14,008; no at. 7, densité 0,967), gaz incolore, inodore, chimiquement peu actif, qui entre dans la composition de l'atmosphère (4/5) et des tissus vivants, animaux et végétaux (protéines). || L'azote est impropre à la respiration, d'où son nom. || Présence d'azote dans les tissus. ⇒ Aéroembolisme. || Azote trivalent. — Cycle de l'azote : circulation des composés de l'azote dans la nature, par l'intermédiaire des organismes végétaux, animaux. || Fixation de l'azote atmosphérique, pour obtenir les composés de l'azote (engrais, etc.). || Peroxyde d'azote (NO2). || Protoxyde d'azote (N2O) : gaz hilarant; et autres composés de l'azote (⇒ Azoteux, azotique, nitrate, nitrure).
1 Noms nouveaux ou adoptés : « Azote ou radical nitrique », noms anciens : « Base de l'air phlogistiqué ou de la mofète atmosphérique ».
Guyton de Morveau, Lavoisier, Berthollet et de Fourcroy, Méthode de nomenclature chimique (Tableau de la nomenclature, p. 100 (1787)).
2 Les propriétés chimiques de la partie non-respirable de l'air atmosphérique n'étant pas encore très-bien connues, nous nous sommes contentés de déduire le nom de sa base de la propriété qu'a ce gaz de priver de la vie les animaux qui le respirent; nous l'avons donc nommé azote, de l'α privatif des Grecs, et de ζωε, vie, ainsi la partie non respirable de l'air sera le gaz azotique (…)
Nous ne nous sommes pas dissimulé que ce nom présentait quelque chose d'extraordinaire; mais c'est le sort de tous les noms nouveaux, ce n'est que par l'usage qu'on se familiarise avec eux (…)
Lavoisier, Traité élémentaire de chimie, an IX (1803), t. I, p. 55.
❖
DÉR. et COMP. 2. Azoïque, azotate, azoté, azotémie, azoteux, azotique, azotite, azotobacter, azoture, azoturie. — V. Azo-, azoto-.
Encyclopédie Universelle. 2012.
 - « pourvu de vie » (cf. gr.
- « pourvu de vie » (cf. gr.  « vital »).
« vital »).