FÉCONDATION
Par ses modalités remarquablement uniformes dans le règne animal tout entier, par son caractère très général chez l’ensemble des êtres vivants, animaux et plantes, la fécondation se présente comme un phénomène biologique élémentaire.
C’est pourquoi il paraît aisé de le définir comme le mécanisme par lequel deux cellules reproductrices sexuelles (gamètes), l’une mâle, l’autre femelle, vont s’unir pour constituer la cellule-œuf (zygote), autrement dit la cellule originelle d’où un nouvel individu va prendre vie.
En réalité, cette définition ne rend pas assez compte de la complexité du phénomène et des problèmes biologiques qu’il pose, problèmes dont les données se regroupent sous trois thèmes majeurs: l’hérédité des caractères biologiques, les rythmes vitaux de l’organisme, les régimes métaboliques au niveau cellulaire.
On considère volontiers, et non sans logique, le rôle de la fécondation dans la transmission des caractères héréditaires comme primordial, car la fonction génétique de la fécondation est concrétisée par le fait, expérimentalement démontré, que la cellule-œuf (et l’individu qui en provient) a reçu des deux gamètes de sexe opposé qui l’ont constitué une hérédité biparentale .
Dans la mesure où les parents n’étaient pas identiques, ils ont produit, lors de la formation de leurs cellules sexuelles, des gamètes dissemblables, ce qui confère à la reproduction sexuée une fonction de réassortiment du patrimoine génétique. Cet effet se trouve accru – considérablement – par le mécanisme de réduction chromatique qui est associé à la formation des gamètes (méïose). À la suite de cette réduction, chaque gamète ne renferme qu’un lot de chromosomes (état haploïde, avec un exemplaire de chaque chromosome) tandis que les cellules souches des gamètes possédaient deux lots homologues (état diploïde, avec deux exemplaires, souvent non identiques, de chacun des chromosomes).
Il s’ensuit que la cellule-œuf a reçu, par l’intermédiaire des chromosomes, une garniture de gènes (génotype), qui se trouve littéralement tirée au sort selon une manière de “loterie de l’hérédité”. Cela implique la singularité de l’individu issu de l’œuf auquel est échu un assortiment de gènes nécessairement original. De la sorte, la vie se présente comme faculté d’innovation. L’abandon d’un “avantage génétique” aussi patent stabilise les nombreuses espèces hermaphrodites se reproduisant par autofécondation: cet acte n’aboutit ici qu’à la conservation intégrale du type parental, et la fécondation assure, à l’inverse de son rôle habituel, un isolement reproductif complet. La persistance du mécanisme, malgré l’inanité de sa fonction, met en cause non seulement la finalité mais aussi la nécessité du phénomène.
Que nous apprennent à cet égard les cycles vitaux ? La parthénogenèse, où l’individu nouveau prend naissance d’un gamète femelle non fécondé, apparaît comme une sorte d’aberration biologique, si l’on se réfère au rôle génétique de la fécondation. Cette impression est confortée par le fait que, dans le règne animal au moins, les espèces chez lesquelles existent un ou plusieurs stades parthénogénétiques, bouclent toujours leur cycle vital grâce à la reproduction sexuée avec fécondation authentique. Il ressort, tout aussi clairement, de l’étude des cycles vitaux dans le règne végétal que la fécondation y trouve obligatoirement place dans le cadre de l’alternance des phases haploïdes et diploïdes qui se succèdent en relation avec les mécanismes sexuels. Mais il convient, là encore, de remarquer que le déroulement du cyle vital et le changement de garniture chromosomique ne sont pas forcément associés. Cela pose le problème de l’indépendance relative du déterminisme morphogénétique. Le mécanisme et la fonction paraissent là encore dissociables.
Cependant, ce qui démontre que la fécondation n’est pas nécessaire à la perpétuation de l’espèce, c’est le fait que chez beaucoup de végétaux et nombre d’animaux inférieurs des cellules ordinaires sans différenciation notoire, quoique totipotentes, sont capables d’engendrer des individus nouveaux (il est vrai, strictement conformes à leur progéniteur) en l’absence de tout mécanisme de fécondation.
Cela impose une évidence souvent méconnue: la particularité la plus remarquable des gamètes femelles des animaux et végétaux supérieurs est leur différenciation souvent considérable: ces cellules ont, malgré une morphologie assez anodine, une grande complexité structurale et un régime métabolique très particulier. Une fois différenciées, ces cellules vont témoigner d’une extraordinaire inaptitude à poursuivre leur développement: elles entrent dans un état d’inertie physiologique tel qu’elles sont vouées à mourir si elles ne sont pas activées. C’est alors que se révèle la nécessité de la fécondation: le gamète mâle assumera la fonction activatrice naturelle. Cette “vertu” séminale a été reconnue depuis la plus haute antiquité. Les textes sumériens, entre autres, en témoignent sans ambiguïté. Et pourtant, la puissance vitalisante de la semence mâle – ou du pollen – reste encore mal expliquée, alors qu’elle joue un rôle-clé dans la reproduction sexuée. La fécondation extracorporelle (dite in vitro ) a permis d’en mieux mesurer toute l’importance. Cette technique, qui n’est révolutionnaire qu’en apparence, n’en est pas moins en passe de permettre, dans l’avenir, les plus angoissantes manipulations du germe humain à travers une exploration sans cesse affinée des conditions et des mécanismes de la fécondation.
1. Origines du phénomène
Trois critères biologiques sont utilisables pour identifier la fécondation: confluence cellulaire, transfert génétique, activation physiologique et ontogénétique. Pris isolément, ces phénomènes sont d’une telle banalité chez le vivant que toute tentative phylogénétique serait – en l’absence, d’ailleurs, de références paléontologiques valables – tout simplement téméraire.
Nous nous bornerons donc à repérer ici quelques-unes des pistes que fait apparaître la cytophysiologie comparée, afin de retracer une histoire naturelle de la fécondation aussi prudente qu’il se pourra.
La confluence cellulaire est considérée par de nombreux auteurs comme le mécanisme par lequel les systèmes vivants les plus élémentaires sont arrivés à se complexifier (cf. ORIGINES DE LA VIE). En ce phénomène s’exprime la faculté d’assemblage qui est une qualité fondamentale des constituants ultrastructuraux des cellules. L’édification d’une barrière membranaire autour de l’entité cellulaire a restreint la possibilité d’agrégation entre cellules contiguës, en faisant intervenir des sites de reconnaissance intercellulaire au niveau desquels jouent les phénomènes d’adhésion ou de répulsion.
Mais cette barrière une fois rompue, rien ne s’oppose vraiment à la mise en commun des contenus cellulaires, comme le démontrent les expériences dites d’hybridation ou mieux, de fusion cellulaire . Elles ont permis de faire confluer, au sein de cultures sur milieu nutritif stérile, des cellules animales (de même espèce ou d’espèces différentes) ou des cellules végétales et même des protoplastes bactériens. Ainsi se vérifie l’universalité d’un processus qui fut initialement observé lors de la reproduction des champignons, et baptisé dans ce cas somatogamie.
On l’a considéré d’abord comme une régression de la sexualité: des cellules végétatives mycéliennes “copulent”, c’est-à-dire mettent d’abord en commun leur cytoplasme (plasmogamie) pour constituer de ce fait des unités munies de deux noyaux (dicaryons), lesquels, finalement, s’unissent en un seul noyau (caryogamie).
L’union des noyaux est éphémère. Son rôle paraît exclusivement génétique car la caryogamie n’est autre que le début de la méïose au cours de laquelle la ségrégation des caractères héréditaires va coïncider avec la sporulation.
Remarquons à ce sujet que cette ségrégation ne peut, en l’occurrence, authentiquement innover en matière d’hérédité et que l’importance biologique de la sporulation réside davantage dans la dissémination des semences qu’elle assure.
La différence entre la biologie des champignons et la cytohybridation expérimentale se caractérise aussi par la différence du comportement des cellules à l’endroit de leur équipement chromosomique: une cellule hybride peut se diviser, transmettre ses chromosomes à sa descendance, mais la conservation de l’un des deux génomes qu’elle recèle va devenir aléatoire par élimination progressive des chromosomes. Cela est foncièrement différent du partage méïotique strict intervenant au sein d’un patrimoine de chromosomes apparemment compatibles qui se produit lors de la sporulation des champignons. Aussi bien la pseudofécondation que constitue la cytohybridation reste-t-elle, tant que le problème de compatibilité chromosomique n’est pas résolu, sans avenir biologique réel, même si son intérêt technique est immense. D’autres simulacres de fécondation ont, en revanche, une portée biologique considérable en raison de leur retentissement sur les systèmes génétiques des partenaires.
Étudions tout d’abord le cas de l’infection d’une bactérie par un virus bactériophage (= phage).
Les phages ont une morphologie qui leur confère deux des qualités d’un gamète mâle:
– présence, à leur surface, de molécules de reconnaissance, grâce auxquelles ils peuvent s’adapter à leur partenaire;
– présence d’un dispositif d’injection du génome viral.
Après pénétration de celui-ci, le métabolisme bactérien va être asservi à la production de virus: il s’agit d’une véritable subversion de l’identité de l’hôte, ce qui distingue bien ce type de parasitisme intracellulaire de la fécondation.
Néanmoins, si le phage s’intègre au génome bactérien, s’il s’y réplique et se transmet sans dommages ni perturbations à la descendance de la bactérie, la différence avec une fécondation devient plus subtile. Il faut en effet, ici, que des mécanismes “inducteurs” interviennent pour que la fonction nocive du phage se trouve révélée (lysogénie).
Par ailleurs, de tels avatars ne sont nullement nécessaires à la transmission de facteurs génétiques par mécanisme parasexuel: la conjugaison bactérienne, et l’implantation génétique qui la suit, ou encore l’incorporation de plasmides, rappellent des mécanismes de fécondation car leur effet est similaire. N’est-ce pas, en effet, soit un réassortiment génétique, soit une innovation génotypique qui se produisent ainsi?
On sait l’exploitation que le génie génétique a su faire de tels phénomènes et quelles immenses perspectives il a ouvert à cette pseudofécondation.
L’expérimentation a même pu être étendue aux animaux supérieurs, mais chez ceux-ci le transfert génétique a lieu non plus dans une cellule en activité mais chez une cellule inerte. Dans ce cas, il faudra une intervention activatrice pour permettre la réussite du phénomène de fécondation. Depuis longtemps, les expériences de parthénogénèse expérimentale ont tenté, avec des succès relativement minces, il faut bien le reconnaître, de déclencher la division du gamète femelle vierge et d’obtenir le développement embryonnaire. Mais elles ont permis de vérifier (comme on l’a déjà indiqué) que l’acquisition d’un nombre chromosomique correct n’était pas la condition sine qua non du démarrage du développement.
L’inertie fonctionnelle dans laquelle se trouve la cellule femelle vierge a des causes incomplètement connues. Toutefois, on ne peut qu’être frappé de la similitude de cette inertie avec l’état de dormance dans lequel se trouvent – en général – les graines (mais aussi les tubercules et les bulbes, autrement dit la majorité des semences des végétaux supérieurs).
Chez ces dernières, la levée du blocage physiologique se réalise souvent de façon non spécifique sous l’influence des facteurs physico-chimiques intervenant de l’extérieur. On a réussi, par des techniques semblables, à obtenir des activations parthénogénétiques expérimentales de l’ovule animal. Mais les échecs ont été nombreux.
Il semble que la difficulté principale réside dans le gamète lui-même. Puisqu’il dispose d’un équipement génétique complet, c’est à ce niveau que les mécanismes régulateurs de l’expression des gènes ont mis en veilleuse les facteurs ayant un rôle incitateur dans la division cellulaire. (cf. DIVISION CELLULAIRE). Ce sont eux que l’activation a pour effet de mettre en action, et il semble certain que cette mise en action est spécifique.
Il semble donc, au terme de cette investigation “autour de la fécondation”, qu’il s’agisse bien d’un phénomène qui intègre diverses tendances, apparemment non corrélées à l’origine. La part du hasard et/ou de la nécessité dans l’ajustement réciproque de tous les tâtonnements grâce auxquels la fécondation s’est trouvée mise au point ne peut être évaluée. Cependant, ce sont ces tâtonnements mêmes qui permettent d’éclairer la signification de la fécondation, à défaut d’en préciser l’histoire. C’est pourquoi le contrôle de la fécondation nécessite l’exploration de tous les jalons biologiques que l’évolution a laissé subsister.
2. La fécondation chez les Mammifères
Rencontre des gamètes
Chez les Mammifères (même marins), la fécondation est précédée de l’accouplement, qui permet l’insémination, c’est-à-dire la pénétration des spermatozoïdes dans le tractus génital femelle. Le spermatozoïde doit remonter les conduits génitaux jusqu’aux trompes de Fallope, où il pourra rencontrer l’ovule produit par l’ovaire, ce qui permettra la fusion des deux cellules reproductrices.
Les spermatozoïdes se déplacent plus ou moins rapidement selon les espèces: ils arrivent à destination en 15 minutes chez la rate, en 10 heures chez la brebis. Leur déplacement est dû non seulement à leurs mouvements propres, mais aussi à une onde de déplacement provoquée par les contractions de la paroi de l’utérus et à un effet de succion. Cependant, un nombre considérable de spermatozoïdes, introduits au moment de l’accouplement, meurent avant d’atteindre l’ovule; par exemple, le lapin, au cours d’une éjaculation, dépose 200 millions de spermatozoïdes, mais, 28 heures après l’accouplement, de 200 à 500 seulement ont remonté le tractus génital et sont arrivés au lieu de rencontre avec l’ovocyte. Les autres sont phagocytés dans la lumière de l’utérus.
Les spermatozoïdes ont acquis leur motilité sous l’influence des sécrétions du tractus génital mâle. Mais, au moment de la copulation, ils ne sont pas fécondants. Pour le devenir, ils doivent séjourner un certain temps dans le tractus génital femelle (de 4 à 6 heures chez la lapine); c’est la capacitation des spermatozoïdes qui résulterait de la disparition de leur couche protectrice. Ils perdent, semble-t-il, ce pouvoir fécondant lorsqu’ils sont remis au contact du liquide séminal.
La pénétration du spermatozoïde dans l’œuf n’est possible que si ce dernier est fécondable; il l’est, à la suite de la ponte, pendant une période plus ou moins longue suivant les espèces animales: de 6 à 9 heures pour la lapine, 12 heures pour la souris, de 5 à 6 jours pour la chienne. D’autre part, les spermatozoïdes ne survivent que peu de temps dans le tractus génital femelle (au maximum de 2 à 3 jours chez la femme). La fécondation ne réussit donc que si la copulation se produit dans une période proche de la ponte ovulaire. Le synchronisme de ces deux événements est assuré chez certaines espèces, comme la lapine, où l’ovulation est provoquée directement par l’accouplement.
Enfin, on a pu mettre en évidence, dans certains cas, l’émission par l’œuf de substances répulsives pour les spermatozoïdes. Mais ces substances sont continuellement éliminées et neutralisées par des sécrétions de la paroi du tractus génital.
Fusion des gamètes
Au moment de la fécondation, l’ovocyte est entouré d’une membrane pellucide épaisse et, chez certaines espèces (carnivores, lapin, souris), d’une enveloppe supplémentaire, la corona radiata . Pour pénétrer dans l’ovocyte, le spermatozoïde doit traverser ces deux membranes: il utilise vraisemblablement, d’une part, une sécrétion de l’acrosome, la hyaluronidase, enzyme permettant la désintégration de la corona radiata, et, d’autre part, des enzymes sécrétés par la membrane nucléaire épaissie ou perforateur du spermatozoïde, qui l’aident à franchir la membrane pellucide.
En général, un seul spermatozoïde pénètre dans l’œuf, déclenchant un mécanisme de blocage, qui se produit, chez les Mammifères, au niveau de la zone pellucide et de la surface du vitellus, à partir du point d’entrée du spermatozoïde. Cette réaction corticale se transmet rapidement à toute la surface de l’œuf et aboutit à l’élargissement de l’espace périvitellin. Toutefois, dans certains cas, plusieurs spermatozoïdes traversent la membrane pellucide et se retrouvent dans l’espace périvitellin.
Au contact de l’ovule, le spermatozoïde perd sa mobilité. Il pénètre passivement dans la cellule en entraînant son flagelle, et les mitochondries se répandent dans le cytoplasme ovulaire. La tête spermatique contenant le noyau subit une rotation de 1800 et forme le spermaster.
L’entrée du spermatozoïde provoque dans l’ovocyte de profonds changements, qui seront étudiés plus loin. L’ensemble de ces modifications est groupé sous le terme d’activation .
Au moment de la fécondation, l’ovocyte est bloqué en métaphase de la deuxième division de maturation. Après la pénétration du spermatozoïde, le deuxième globule polaire est émis, en l’espace de deux heures chez la lapine. Puis le noyau femelle, ou pronucleus femelle, devient visible avec sa membrane nucléaire et de nombreux petits nucléoles.
La tête spermatique se gonfle par hydratation. Le perforateur se détache et le noyau mâle, ou pronucleus mâle, s’entoure d’une nouvelle membrane qui se différencie à partir de l’ergastoplasme de l’ovule. Des nucléoles apparaissent, augmentent de taille et fusionnent. Les deux pronuclei continuent à augmenter de volume, puis s’acheminent l’un vers l’autre vers le centre de l’ovule. Quand les deux pronuclei sont en contact, les membranes nucléaires deviennent irrégulières et disparaissent. La fusion des noyaux, ou amphimixie, a lieu. Puis le fuseau de division apparaît à la suite du dédoublement du spermaster, qui institue dans l’œuf un état dicentrique à la faveur duquel les chromosomes s’individualisent; l’œuf fécondé se divise alors en deux cellules, ou blastomères. Le développement embryonnaire commence.
3. Notion de fécondité
La reproduction devient possible à partir du moment où l’organisme animal est arrivé à sa maturité sexuelle, c’est-à-dire à la puberté. Celle-ci est caractérisée par le plein développement de l’appareil génital, l’éveil de l’instinct sexuel et la maturation des produits génitaux mâles et femelles. Cette période est atteinte plus ou moins tôt après la naissance; 2 ans en moyenne chez les Poissons, de 2 à 4 ans chez la grenouille, 6 mois ou plus chez les Oiseaux. Chez les Mammifères, la précocité de la maturité sexuelle dépend de l’espèce envisagée: 5 semaines chez la souris, 15 ans chez l’éléphant, 9 ans chez le chimpanzé, de 12 à 15 ans dans l’espèce humaine.
Chez beaucoup d’animaux, il n’y a qu’une seule période de fécondité par an. C’est très souvent le cas des Mammifères sauvages (ruminants, carnivores, etc.), chez lesquels la fécondation a donc lieu à une période déterminée de l’année: la période du rut ou période des “chaleurs”. Pour les Mammifères à durée de gestation courte, la fécondation a lieu au printemps; pour les animaux à durée de gestation longue, elle a lieu de telle sorte que la naissance se produise en été. Chez certaines chauves-souris, l’insémination se fait en octobre, mais la fécondation se produit en avril, le sperme restant emmagasiné dans le vagin. On sait que les spermatozoïdes peuvent conserver leur vitalité très longtemps s’ils sont conservés à basse température, ce qui permet de pratiquer l’insémination artificielle [cf. ZOOTECHNIE].
D’autres Mammifères ont deux (hérisson) ou plusieurs périodes de fécondité, ou même restent féconds pendant toute l’année (lièvre, rat et singe).
La domestication a une nette influence sur les rythmes de fécondité des animaux: la lapine domestique peut être fécondée toute l’année, et les ruminants domestiques ont plusieurs périodes de fécondité soit limitées à une saison déterminée (renne), soit à n’importe quelle saison (vache, certaines races de brebis), alors que leurs homologues sauvages n’ont qu’une seule période de reproduction par an.
La captivité peut avoir une grande influence sur les rythmes de fécondité. Certaines espèces deviennent stériles par suite d’un effet de dépression dû au mode de vie ou à une nourriture mal adaptée; pour d’autres espèces, comme le cerf wapiti, la période de chaleur peut s’étendre sur toute l’année.
En général, on peut dire que la saison de reproduction est conditionnée à la fois par le rythme interne des gonades et par les facteurs d’environnement. Ainsi les rythmes de fécondité sont-ils influencés par les changements de température, la nourriture, la longueur du jour, et aussi des facteurs psychologiques. Chez le furet, par exemple, la femelle entre normalement en chaleur en mars-avril. Si on augmente la durée de l’éclairement à partir d’octobre, la période de rut est avancée de trois mois. Inversement, si on la réduit beaucoup, l’entrée en chaleur est retardée. La lumière agit par son intensité et par sa longueur d’onde. Le stimulus capté par l’œil est transmis au cerveau par le nerf optique au niveau de l’hypothalamus. Celui-ci sécrète une neurohormone qui provoque une sécrétion du lobe antérieur de l’hypophyse: les gonadostimulines ainsi libérées sont responsables des modifications observées. Ce même mécanisme a été mis en évidence chez de nombreux Mammifères ainsi que chez les Oiseaux.
4. Physiologie comparée
Attraction des gamètes
Les spermatozoïdes libérés dans l’eau ou les conduits génitaux progressent vers l’œuf grâce à leur flagelle. Dans certains cas, la rencontre des deux cellules est due seulement au hasard, avec une forte probabilité par suite du très grand nombre de spermatozoïdes émis. Dans d’autres cas où la fécondation s’effectue en milieu aqueux, on a montré que les spermatozoïdes sont attirés par des sécrétions du gamète femelle; ils se déplacent par chimiotaxie. Cette attraction a lieu, dans la majorité des groupes zoologiques, avant que la maturation ovulaire soit terminée, si bien que le spermatozoïde rencontre en fait un ovocyte , chez lequel l’émission des globules polaires va alors se produire (Ascaris, Nereis) ou se terminer (Mollusques, Vertébrés).
En étudiant la fécondation des œufs d’oursin et de vers annélides Nereis, Lillie avait constaté que l’“eau ovulaire” (c’est-à-dire l’eau de mer ayant contenu des ovules mûrs) attirait les spermatozoïdes de la même espèce et stimulait leur mouvement, puis les agglutinait par paquets. La substance diffusée qui se formerait dans la couche corticale de l’ovule a été appelée fertilisine . La couche superficielle des spermatozoïdes contiendrait l’antifertilisine , réagissant spécifiquement avec la fertilisine ovulaire. L’interaction des deux substances détermine l’attachement du spermatozoïde à l’œuf et la spécificité du phénomène réduit les chances d’une fécondation par des spermatozoïdes d’une autre espèce.
Chez les Mammifères, notamment la lapine, on a également mis en évidence des phénomènes analogues.
Fécondation et patrimoine génétique
Toute perturbation, naturelle ou expérimentale, dans le fonctionnement des différents mécanismes de la fécondation conduit à des anomalies.
En général, l’œuf possède un mécanisme de blocage situé au niveau de la zone corticale, qui empêche la polyspermie . Toutefois, pour les œufs riches en vitellus (Insectes, Mollusques, Reptiles, Oiseaux), la polyspermie physiologique est régulière; mais un seul noyau mâle s’unit au noyau femelle, les autres dégénèrent dans le cytoplasme ovulaire. Dans certains cas, les mécanismes de blocage ne sont pas toujours efficaces. Il en résulte alors une polyspermie pathologique, relativement rare dans la nature: 1,4 p. 100 chez la truie, 2,6 p. 100 chez la vache; sa fréquence augmente pour les œufs immatures et les œufs trop âgés (10 p. 100 chez la truie). Dans le cas le plus simple, deux noyaux mâles s’unissent au noyau femelle pour former un noyau de fécondation triploïde (3 N). En général, les embryons qui se développent ne sont pas viables; chez la rate, ils meurent entre le treizième et le quinzième jour de gestation.
Dans la digynie , l’œuf n’achève pas sa maturation. Le deuxième globule polaire n’est pas émis et se transforme en un deuxième pronucleus femelle. Le noyau de fécondation, dû à la fusion des deux pronuclei femelles et du pronucleus mâle, est encore triploïde. Les embryons meurent dans les premiers jours du développement, ce qui serait une des causes de l’avortement précoce dans la race humaine. La digynie peut résulter du vieillissement de l’œuf ou du spermatozoïde.
Parfois, enfin, la fécondation se déroule normalement, mais les pronuclei comportent des nombres chromosomiques aberrants résultant de disjonctions anormales à la méiose.
Activation ovulaire
L’activation est caractérisée par des changements dans le métabolisme et par des transformations morphologiques provoqués par la pénétration du spermatozoïde dans l’œuf vierge.
Elle déclenche, tout d’abord, une reprise de la méiose: elle achèvera la réduction chromatique du noyau de l’ovocyte qui se trouvait bloqué, suivant les espèces, à des stades variables de la maturation, et le transformera en gamète femelle ou ovule. Elle peut entraîner une variation du taux de consommation d’oxygène: ce taux augmente brusquement chez l’œuf d’oursin, reste inchangé chez celui des Poissons et diminue chez celui de la grenouille; en général, il tend vers un niveau comparable à celui de l’œuf vierge dans l’ovaire. Dans l’œuf d’oursin, cette augmentation correspond à la formation d’acides.
L’activation se manifeste encore par une augmentation de la perméabilité de la membrane, un échange accru de phosphates, de sels de sodium et de calcium entre l’œuf et le milieu, et une activité plus grande des enzymes protéolytiques, qui libèrent des acides aminés utilisés par la synthèse des protéines, qui reprend.
Les modifications morphologiques, très importantes pour le développement futur de l’œuf, concernent l’aspect extérieur (les œufs d’Invertébrés, souvent de forme elliptique, deviennent sphériques) et surtout la cytologie. Le cytoplasme de l’œuf fécondé se contracte (par exemple de 17 p. 100 pour l’œuf de rate); la couche périphérique, le cortex, se décolle de ses membranes, et un espace périvitellin, rempli de liquide et de substances de déchet, apparaît entre les deux. L’œuf libéré peut alors s’orienter sous l’influence de la pesanteur. Dans certains cas (oursin, Poissons, Batraciens), le décollement s’accompagne de modifications infrastructurales: chez l’oursin, par exemple, le cortex contient des granules de mucopolysaccharides qui, à la fécondation, explosent et s’intègrent à la membrane vitelline; celle-ci se soulève et se transforme en membrane de fécondation. Ces changements dans les couches corticales de l’œuf sont très importants, car, en leur absence, le développement embryonnaire est impossible.
Ces déplacements de constituants cytoplasmiques, comme les pigments corticaux ou le vitellus, accompagnent aussi la fécondation. Dans l’œuf de batracien, un pigment mélanique cortical recouvre tout l’œuf, à l’exception du pôle végétatif. La pénétration du spermatozoïde est immédiatement suivie d’une rétraction passagère du cytoplasme pigmenté vers le pôle animal, puis, un peu plus tard, d’une rotation du cortex par rapport au cytoplasme interne; ce qui entraîne un déplacement du pigment vers le pôle animal d’un certain gradient. Il en résulte la formation d’une zone corticale en forme de croissant, pauvre en pigment, le croissant gris; celui-ci concrétise le plan de symétrie et définit le côté dorsal du futur embryon. Ces mouvements matérialisent ainsi la mise en place des futures structures embryonnaires.
5. Procréation médicalement assistée
Robert G. Edwards, physiologiste de Cambridge, a réalisé en 1977 la première fécondation in vitro humaine avec transfert d’embryon, qui a conduit à la naissance de Louise Brown en juillet de l’année suivante. Depuis cette date, plusieurs centaines de milliers de bébés sont nés dans le monde grâce à cette technique.
Les techniques médicales destinées à faciliter la procréation et qui ont en commun une manipulation des gamètes au laboratoire sont désignées en France par les termes “assistance médicale à la procréation” (A.M.P.).
Les A.M.P. sont surtout représentées par l’insémination artificielle (I.A.) et par la fécondation in vitro avec transfert embryonnaire dans l’utérus (Fivete), mais d’autres techniques ont été utilisées. La possibilité de conserver les spermatozoïdes et les œufs fécondés, pendant une durée illimitée, dans l’azote liquide à la température de – 196 0C élargit considérablement le champ d’application des A.M.P.
Des progrès techniques (micro-injection et manipulation de l’œuf fécondé) ont permis aux A.M.P. d’étendre leur champ d’application aux stérilités masculines sévères et au diagnostic préimplantatoire (cf. ANTÉNATOLOGIE).
Compte tenu des problèmes de bioéthique (cf. MÉDECINE - Morale médicale et bioéthique) que soulève l’A.M.P. en France, la loi du 29 juillet 1994 régit l’assistance médicale à la procréation.
Aspects techniques
Recueil et traitement du sperme
Dans les A.M.P., le sperme est recueilli le plus habituellement par masturbation et, exceptionnellement, lors d’un rapport sexuel, à l’aide d’un préservatif dépourvu de toute substance spermicide.
Le traitement du sperme in vitro avant son utilisation pour une A.M.P. peut viser plusieurs objectifs différents:
– éliminer le liquide séminal et ses facteurs inhibiteurs du pouvoir fécondant des spermatozoïdes;
– sélectionner les spermatozoïdes les plus mobiles;
– améliorer la mobilité des spermatozoïdes;
– isoler les spermatozoïdes à partir des urines dans les cas d’éjaculation rétrograde.
L’élimination du liquide séminal est effectuée par centrifugation de l’éjaculat. La sélection des spermatozoïdes se fait en général par migration dans un milieu spécial et recueil des spermatozoïdes les plus mobiles. Pour améliorer cette mobilité, on peut ajouter au milieu de recueil de la caféine, des prostaglandines ou de la taurine, par exemple.
Détermination du moment de l’ovulation
Peu de temps avant l’ovulation, l’ovocyte est le siège de transformations essentielles à la fécondation. Si l’ovocyte est recueilli trop tôt, il ne pourra être immédiatement fécondé in vitro. Le délai optimal du recueil est de quelques heures (de 1 à 6) avant l’ovulation spontanée. Après, il est trop tard, l’ovocyte est expulsé et, puisque les trompes sont imperméables chez les patientes, il se perd dans l’abdomen. Il faut donc prévoir exactement le moment de l’ovulation pour entreprendre le recueil à l’heure nécessaire.
Les premières tentatives de Edwards et Steptoe (et une partie des cas qu’ils ont traités) concernent des “cycles spontanés”. Ainsi la physiologie normale est respectée, et le moment de l’ovulation est apprécié par la surveillance des hormones qui déclenchent ce processus ou par l’observation de signes indirects. Les repères sont les suivants:
– observation de la glaire cervicale (sécrétion du col utérin) qui devient abondante, fluide et filante à l’approche de l’ovulation;
– évaluation des taux d’estrogènes – hormones sécrétées par le follicule où se trouve l’ovocyte – dont le taux s’élève 48 heures avant l’ovulation;
– appréciation du diamètre du follicule à l’échographie (le diamètre du follicule préovulatoire est compris entre 18 et 21 mm);
– détermination du “pic” de l’hormone LH. Cette hormone est sécrétée par l’hypophyse sous l’influence de l’élévation du taux d’estradiol plasmatique. Au cours d’un cycle ovarien de 28 jours, une décharge “ovulante” de LH intervient de 37 à 40 heures avant l’ovulation et modifie profondément le follicule avant d’entraîner l’expulsion de l’ovocyte. Pour connaître le moment exact du pic, il est nécessaire de programmer quatre dosages dans le plasma, ou dans les urines, pendant une période de 24 heures. En fonction de la technique utilisée, on sait que l’ovulation se produira 36 heures après le début du pic de LH dans le plasma, ou 28 heures après celui-ci dans les urines.
Pour éviter une surveillance qui impose à la patiente plusieurs prélèvements sanguins quotidiens et à l’équipe chirurgicale une grande disponibilité, la plupart des équipes recourent à la “stimulation” médicamenteuse de l’ovulation. Un traitement hormonal en début de cycle, par clomifène ou par hormone gonadotrope HMG ou FSH, permet de stimuler la croissance de plusieurs follicules en même temps. On surveille leur croissance par échographie et dosage d’estradiol. Dès que les follicules sont mûrs, on déclenche la maturation de l’ovocyte et l’ovulation selon la même chronologie que celle de l’hormone naturelle LH, en injectant une hormone de même nature, HCG.
Le recueil des ovocytes devra alors être effectué entre 34 et 36 heures après l’injection d’HCG. L’avantage de cette méthode est de permettre le recueil de plusieurs ovocytes, ce qui augmente les chances de succès des étapes suivantes. L’inconvénient est une différence de maturation des ovocytes qui ne sont pas toujours aptes à être fécondés.
En débutant la stimulation par l’administration d’“analogues de la LHRH”, on bloque totalement la sécrétion des gonadotrophines de la femme, on atrophie tous les follicules existant précédemment et on commence une stimulation nouvelle à partir de “zéro”, pour obtenir de nouveaux et nombreux follicules au même stade de maturation.
Recueil de l’ovocyte
Le recueil des ovocytes se fait habituellement sous contrôle échographique, grâce à une sonde introduite dans le vagin qui permet de guider l’aiguille de ponction vers les ovaires. La ponction se fait le plus souvent sous une légère anesthésie générale. Les ovocytes contenus dans le liquide folliculaire sont recherchés sous microscope et isolés dans un tube (éprouvette) contenant du milieu de culture.
Fécondation in vitro et culture de l’embryon
Les ovocytes sont mis en présence de 100 000 spermatozoïdes mobiles en moyenne, après quelques heures de culture. Différents milieux de culture sont utilisés. Les stades de développement de l’embryon après fécondation varient un peu autour des délais suivants (avec de légères variations): 2 cellules à 35 heures; 4 cellules à 40-63 heures; 8 cellules à 68-80 heures; 16 cellules à 84-112 heures.
Cette vitesse de division est un signe de bon développement. Les cellules doivent être idéalement de dimensions égales et sans fragmentation. La décision de transfert est prise entre les stades à 2 et à 8 cellules.
Le transfert de l’embryon dans l’utérus
Le transfert de l’embryon dans l’utérus doit être effectué le plus doucement et le plus minutieusement possible. La patiente, qui a parfois reçu un léger traitement sédatif, peut être placée sur un plan inclinable, de telle façon que le fond de son utérus soit en déclivité. À l’aide d’une petite sonde souple d’un diamètre de moins de 1 millimètre, on dépose l’embryon au fond de l’utérus, avec un très faible volume de milieu de culture. Ce replacement est parfois rendu difficile par un spasme du col. La femme reste allongée avant de repartir.
Procédures
L’insémination artificielle avec sperme du conjoint (I.A.C.) ou insémination intraconjugale
L’insémination artificielle est le dépôt du sperme, à l’aide d’une seringue ou d’un dispositif adapté, dans les voies génitales féminines. En fonction de l’indication médicale, on détermine les modalités de l’utilisation du sperme frais ou cryoconversé (qui sera traité ou non au laboratoire), le choix du site de l’insémination et la méthode de synchronisation entre insémination et ovulation.
Les spermatozoïdes utilisés doivent être de préférence séparés du liquide séminal et leur concentration dans la fraction inséminée doit être au moins égale à 500 000 spermatozoïdes mobiles par millilitre. Une spermoculture préalable permet de s’assurer de l’absence de bactéries.
L’insémination intravaginale est réservée aux cas où le conjoint présente une impuissance érectile.
L’insémination intracervicale (dans le col de l’utérus) se fait dans les mêmes indications.
L’insémination intra-utérine se fait dans les cas où les spermatozoïdes ne parviennent pas à pénétrer la glaire du col utérin en nombre suffisant. Cette dernière technique (I.A.I.U.) est de plus en plus utilisée, car elle rapproche davantage les spermatozoïdes sélectionnés du lieu de la fécondation.
Le taux de réussite est de 10 à 15 p. 100 par cycle dans les six premiers cycles.
La fécondation in vitro intraconjugale et le transfert embryonnaire (Fivete)
La fécondation in vitro intraconjugale comprend:
– la stimulation de la croissance folliculaire et la détermination de la maturation des follicules pour provoquer la maturation ovocytaire par injection de LH (HCG);
– le recueil et la préparation des spermatozoïdes une heure avant la ponction ovarienne, ou immédiatement après;
– la ponction des follicules mûrs et le recueil des ovocytes (échographiquement guidés) sous anesthésie générale;
– la fécondation in vitro dans le milieu artificiel de Earle, de Ham ou de Ménezo, suivie de la culture de l’œuf fécondé pendant 48 heures et parfois 72 heures;
– le transfert de l’embryon dans l’utérus, au stade de 4 cellules et parfois plus.
Le taux moyen de grossesse débutante par Fivete est de 25 p. 100 aboutissant à 18 p. 100 d’accouchements. Le taux de fausses couches spontanées est de 20 à 25 p. 100 et celui de grossesses extra-utérines de 4 à 5 p. 100. Après quatre tentatives, si les conditions sont favorables, on aboutit à un taux de grossesses voisin de 50 p. 100. Les enfants nés de Fivete ont un taux de malformations identiques à celui de la population générale.
Le taux de grossesse par transfert augmente avec le nombre d’embryons transférés (30 p. 100 avec 5 embryons). À l’opposé, le risque d’obtenir une grossesse multiple augmente avec le nombre d’embryons transférés. Devant les risques de prématurés des grossesses multiples, on s’accorde aujourd’hui à ne pas replacer plus de deux ou trois embryons, en congelant les embryons non transférés.
Fécondation in vivo (F.I.V.) après recueil puis transfert des gamètes dans les voies génitales
Le GIFT (gametes intrafallopian transfer ) débute comme une F.I.V., mais immédiatement après leur recueil les gamètes sont placés dans l’une des trompes par le pavillon. Cette technique n’est réalisable que s’il existe au moins une trompe perméable. Ses résultats sont comparables à ceux de la Fivete, mais elle possède plusieurs inconvénients: obligation de pratiquer une cœlioscopie, impossibilité d’analyser les échecs de fécondation, obligation de détruire les ovocytes non transférés ou de les féconder in vitro et de congeler les embryons obtenus (en prévision de leur implantation ultérieure).
Le FREDI (Fallopian replacement of eggs with delayed insemination ) consiste dans le transfert des ovocytes seuls, dans la trompe, puis des spermatozoïdes dans l’utérus. Dans le POST (peritoneal oocyte and sperm transfer ), les ovocytes et les spermatozoïdes sont injectés dans la cavité abdominale. Dans le TOAST (transcervical oocyte and sperm transfer ), les ovocytes et les spermatozoïdes sont placés dans l’utérus. Ces trois techniques n’ont pas apporté les preuves de leur intérêt.
Techniques dérivées de la Fivete
Le PROST (pronucleated stage transfer ) consiste à opérer le transfert dans l’utérus 24 heures, au lieu de 48 heures, après la F.I.V. Dans le ZIFT (zygote intrafallopian transfer ), l’embryon est placé dans la trompe, par le pavillon, 24 heures après la F.I.V. Cette méthode est justifiée par l’hypothèse que le transfert dans la trompe au stade de deux noyaux est plus proche des conditions physiologiques. L’embryon de 48 heures est transféré dans la trompe par le pavillon dans le TET (tubal embryo transfer ) et par voie transcervicale dans le TV-TEST (transvaginal tubal embryo stage transfer ). Ces techniques sont progressivement abandonnées.
Micro-injection
Diverses tentatives de faire pénétrer les spermatozoïdes dans l’ovocyte ont été essayées dans les cas où les spermatozoïdes se révélaient incapables de traverser la zone pellucide (enveloppe de l’ovocyte).
La PZD (partial zona dissection ) consiste à faire une fente dans la zone pellucide pour faciliter l’entrée des spermatozoïdes.
La SUZI (subzonal insemination ) place un ou plusieurs spermatozoïdes entre la zone pellucide et le cytoplasme de l’ovocyte.
Ces techniques ont été abandonnées au profit de l’ICSI (intra cytoplasmic sperm injection ) qui permet de réaliser l’injection d’un seul spermatozoïde directement dans l’ovocyte. Le taux de succès peut atteindre 30 p. 100 et plus de 2 000 bébés sont nés de la sorte dans le monde depuis 1991.
Cette technique est utilisée lorsque la qualité du sperme est telle qu’il est prévisible ou constaté que les spermatozoïdes ne seront pas capables de pénétrer dans l’ovocyte par leur propres moyens. Elle consiste à introduire par micromanipulation un spermatozoïde dans le cytoplasme d’un ovule: c’est de la microchirurgie ovocytaire. La suite du processus est identique à celui de la Fivete.
La qualité des grossesses obtenues et des enfants nés par ces techniques de pointe est comparable à celle des grossesses spontanées, sauf sur deux points:
– certaines anomalies du sperme sont liées à des anomalies chromosomiques ou génétiques des parents et peuvent être transmises à l’enfant: un caryotype (étude des chromosomes) et parfois une étude génétique doivent être faits avant de recourir à l’ICSI dans ces cas; mais toutes les anomalies ne sont pas actuellement identifiables;
– il existe un risque (imprévisible actuellement) que l’enfant obtenu par ICSI ait la même hypofertilité que le père et doive lui aussi recourir à l’ICSI, certains estiment même que la défaillance génétique pourrait se répercuter sur d’autres pathologies que la spermiogenèse.
Technologies associées
Cryoconservation des spermatozoïdes et des embryons
La conservation des spermatozoïdes dans l’azote liquide, à la température de – 196 0C, a été mise au point en 1963, celle des embryons préimplantatoires en 1983.
Cryoconservation du sperme
Le sperme est recueilli dans un récipient stérile par masturbation après un délai d’abstinence de trois jours. Après liquéfaction spontanée à la température ambiante, le sperme est dilué dans un milieu cryoprotecteur contenant du jaune d’œuf, du glucose, du citrate de sodium, du glycocolle et des antibiotiques (milieu dit d’Ackerman); on y ajoute du glycérol afin d’obtenir une concentration de 7 à 10 p. 100 dans le mélange final. Le sperme est conditionné dans les tubes plastiques (“paillettes”) d’une contenance de 0,25 ml. Un éjaculat de 3,5 ml avec une concentration de 60 憐 106 spermatozoïdes par millilitre permet de confectionner vingt-huit paillettes contenant chacune 7,5 millions de spermatozoïdes.
La décongélation consiste à laisser les paillettes se réchauffer pendant quelques minutes à la température ambiante.
La congélation-décongélation entraîne une détérioration des spermatozoïdes. Pour un sperme initialement normal, la détérioration reste dans les limites compatibles avec une conservation du pouvoir fécondant: chute d’environ 50 p. 100 du pourcentage de spermatozoïdes mobiles.
Autoconservation du sperme
On désigne sous le terme d’autoconservation du sperme la congélation du sperme pour son utilisation ultérieure dans une A.M.P. intraconjugale.
L’autoconservation peut être envisagée dans trois types de situations:
– avant la mise en œuvre d’un traitement anticancéreux par radiothérapie ou chimiothérapie qui risque de détruire la lignée germinale (maladie de Hodgkin ou cancer du testicule, notamment);
– avant stérilisation volontaire par vasectomie;
– avant Fivete, dans les cas où le recueil du sperme une heure avant la ponction ovocytaire présente des difficultés d’ordre psychologique.
Cryoconservation des embryons
La cryoconservation des embryons se fait selon un protocole voisin de celui qui est utilisé pour le sperme. On y ajoute du sucrose pour déshydrater les embryons avant congélation. Après décongélation, le taux de survie des embryons varie selon les équipes entre 50 et 80 p. 100.
Cryoconservation des ovocytes
Cinq grossesses ont été établies après congélation d’ovocytes humains, mais la technique initiée en Australie n’est pas encore parfaitement au point en 1996.
Diagnostic préimplantatoire
Il est possible d’extraire un ou deux blastomères d’un embryon sans compromettre son développement ultérieur. Les techniques actuelles de la biologie moléculaire permettent, par amplification (PCR: polymerase chain reaction ), la production d’un grand nombre de copies d’une séquence spécifique d’ADN. Bien que la technique soit d’application délicate, on sait révéler la présence, dans un seul blastomère, des facteurs de la différenciation masculine portés par le chromosome Y. Cette méthode ouvre la voie au choix du sexe des embryons porteurs d’un défaut génétique sur le chromosome X, tel que l’hémophilie.
La même technique d’amplification moléculaire permet l’identification, dans les embryons préimplantatoires, de gènes responsables de graves maladies telles que la mucoviscidose et la myopathie de Duchenne.
Don de gamètes et d’embryons
L’insémination artificielle avec sperme de donneur (I.A.D.)
Les demandes de recours à l’I.A.D. peuvent être formulées dans trois circonstances:
– infertilité masculine en raison d’une azoospermie ou d’une oligoasthénotératospermie après échec des A.M.P. intraconjugales ou d’une anéjaculation persistante;
– risque important de transmission, dans le couple, d’une maladie ou d’une malformation résultant d’un défaut génétique paternel;
– couples dont le mari est séropositif VIH et l’épouse séronégative et qui souhaitent une grossesse sans risque de transmission du virus à l’enfant.
Les donneurs de sperme sont recrutés selon des modalités variables. En France, ils sont pères d’au moins un enfant et subissent une série d’examens, visant à établir la normalité du sperme, l’absence d’anomalies chromosomiques dans le caryotype, l’absence d’anticorps témoignant de l’existence d’une maladie transmissible par le sperme (sida, hépatite virale, syphilis et cytomégalovirus), l’absence de maladies héréditaires dans la famille. Le sperme n’est utilisé qu’après avoir été conservé pendant six mois, la séronégativité du donneur étant confirmée au terme de ce délai. En France, le don de sperme ne peut se faire qu’au travers d’un centre agréé, le Centre d’étude et de conservation du sperme (Cecos). Chaque année, 2 000 naissances sont obtenues en France par I.A.D.
La fécondation in vitro avec sperme de donneur (F.I.V.D.)
Lorsque l’I.A.D. échoue à plusieurs reprises (6 cycles), le recours à la F.I.V.D. peut être envisagé. De même lorsque le bilan gynécologique contre-indique les I.A.D.
La fécondation in vitro avec le don d’ovocytes
La fécondation in vitro avec le don d’ovocytes est indiquée, le plus souvent, lorsque l’infécondabilité du couple est due à la stérilité féminine par absence d’ovocytes (ménopause précoce, dysgénésie gonadique, chimiothérapie ou radiothérapie anticancéreuses, ovariectomie bilatérale) ou absence d’ovaires.
Un deuxième groupe d’indications correspond, d’une part, à des patientes chez lesquelles les tentatives de Fivete intraconjugales ont toutes échoué en raison de la non-réponse ovarienne aux stimulations de l’ovulation ou en raison de la constante anomalie des ovocytes et, d’autre part, à des patientes porteuses de graves anomalies génétiques transmissibles.
Le don d’ovocytes n’est pas symétrique du don de spermatozoïdes: les ovocytes doivent être recueillis par ponction après stimulation hormonale, et la fécondation ne peut être obtenue qu’in vitro. La femme donneuse d’ovocytes doit donc être stimulée puis anesthésiée et “opérée”, ce qui n’est pas sans inconvénients ni risque pour elle.
Le don d’embryons
Tous les embryons surnuméraires des programmes de Fivete ne sont pas utilisés par leurs géniteurs. Certains parents après Fivete, estimant qu’ils ne souhaitent pas avoir davantage d’enfant, sont disposés à offrir leurs embryons surnuméraires cryoconservés à des couples infertiles.
Les demandes émanent de couples dont les deux partenaires sont stériles ou de couples qui désespèrent d’obtenir un don d’ovocytes.
fécondation [ fekɔ̃dasjɔ̃ ] n. f.
• 1488, rare av. 1729; de féconder
♦ Action de féconder; résultat de cette action. ⇒ conception, génération, reproduction . Fécondation de l'ovule par le spermatozoïde, de la femelle par le mâle. La fécondation consiste en la fusion (⇒ amphimixie) d'un élément mâle (⇒ anthérozoïde , pollen; gamète [mâle], semence, spermatozoïde) et d'un élément femelle (⇒ oosphère; gamète [femelle], ovule) en une cellule unique, point de départ d'un nouvel être. Empêcher la fécondation par des moyens contraceptifs. « Cet acte naturel de la fécondation, que le mariage sanctifie et par lequel le grand mystère de la vie se perpétue » (A. Gide). (1864) Fécondation artificielle. ⇒ gift, insémination . « la fécondation se déroulant à l'intérieur de l'organisme féminin, l'ovule et le jeune embryon sont inaccessibles à l'analyse sauf par le biais de la FIV » (J. Testart). Fécondation in vitro (⇒ F. I. V.; cf. Bébé-éprouvette) et transfert d'embryon (⇒ fivète) .
● fécondation nom féminin Action de féconder. Union du gamète mâle (anthérozoïde végétal ou spermatozoïde animal) avec le gamète femelle (oosphère végétale ou ovule animal) pour donner un œuf, ou zygote. ● fécondation (expressions) nom féminin Fécondation croisée, union de deux gamètes formés dans deux fleurs différentes du même pied, ou dans deux pieds différents. Fécondation directe, union de deux gamètes formés par la même fleur. (C'est un cas exceptionnel.) ● fécondation (synonymes) nom féminin Action de féconder.
Synonymes :
fécondation
n. f. Action de féconder; son résultat.
|| BIOL Fusion de deux gamètes (cellules sexuelles) qui forment un oeuf (ou zygote), point de départ d'un ou de plusieurs individus nouveaux.
— Fécondation in vitro, obtenue en laboratoire, hors de l'organisme maternel.
⇒FÉCONDATION, subst. fém.
A.— [Correspond à féconder A; en parlant des êtres vivants organisés] Action de féconder, le résultat de cette action; stade de la reproduction sexuelle consistant en une fusion des gamètes mâle et femelle en une cellule unique.
1. Domaine humain. C'était sa fille, soit. Le hasard des fécondations, la loi brutale de la reproduction, un contact d'une seconde avaient fait sa fille de cet être qu'aucun lien légal n'attachait à lui (MAUPASS., Contes et nouv., t. 1, M. Jocaste, 1883, p. 876). La participation de deux organismes à un même processus physiologique, tel que la fécondation de l'œuf par le spermatozoïde (CARREL, L'Homme, 1935, p. 238). S'il n'y a pas eu de fécondation de l'oocyte, ni par suite de nidation de l'embryon, le corps jaune se résorbe au bout de peu de jours (CAULLERY, Embryol., 1942, p. 99) :
• 1. Il faut aussi l'intégrité des organes génitaux permettant la migration de l'ovule par les trompes de l'ovaire à l'utérus, la bonne réception des spermatozoïdes au cours des rapports sexuels et la nidation dans l'utérus de l'ovule après sa fécondation.
QUILLET, Méd. 1965, p. 484.
2. Domaine animal. La fécondation de la poule par le coq. Des essais de fécondation artificielle avaient été tentés depuis longtemps. On peut aujourd'hui effectuer l'insémination à volonté chez les mammifères, avec des progéniteurs situés à des distances éloignées (Hist. gén. sc., t. 3, vol. 2, 1964, p. 632) :
• 2. Ce n'est qu'après la fécondation du vol nuptial qu'elle [la reine] produit à son choix des ouvrières ou des faux-bourdons. À la suite du vol nuptial, elle est définitivement en possession, jusqu'à la mort, des spermatozoaires arrachés à son malheureux amant.
MAETERL., Vie abeilles, 1901, p. 160.
3. Domaine végétal. Les ruisseaux entraînaient les pollens pour des fécondations lointaines (GIDE, Nourr. terr., 1897, p. 232). Il faut (...) avoir l'agilité d'un singe pour aller d'un arbre à l'autre, au temps de la fécondation, secouer le pollen des arbres mâles sur les fleurs des palmiers femelles (THARAUD, Fête arabe, 1912, p. 243) :
• 3. La fécondation se réalise selon deux modalités :
a) l'autofécondation, ou fécondation d'une variété par son propre pollen (cas général chez le pêcher);
b) l'interfécondation, ou fécondation croisée (cas général chez le pommier et le poirier), les abeilles assurant quasi exclusivement la pollinisation.
BOULAY, Arboric. et prod. fruit., 1961, p. 67.
B.— [Correspond à féconder B] Action de rendre la terre fertile, productive. La fécondation de la terre par les pluies. Les amours de la terre, les fêtes de la fécondation, les caresses des plantes l'avaient enivrée de leurs parfums (BALZAC, Lys, 1836, p. 305).
C.— P. métaph. Regnier, en effet, aussi bien que Malherbe, et même à un plus haut degré que lui, a le mérite d'avoir régénéré en France l'imitation des anciens, et d'en avoir fait enfin, de servile et de stérile qu'elle était, une émulation de génie, une lutte d'honneur, je dirai presque une fécondation légitime (SAINTE-BEUVE, Tabl. poés. fr., 1828, p. 136). Des miracles comparables à la fécondation d'un grand sentiment religieux par une énergie nationale ou spécifique exceptionnelle (FAURE, Espr. formes, 1927, p. 242).
Prononc. et Orth. :[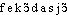 ]. Ds Ac. 1798-1932. Étymol. et Hist. 1488 « action de féconder » (La Mer des Histoires, I, 181d, édit. 1491 ds Rom. Forsch. t. 32, p. 65). Dér. du rad. de féconder; suff. -(a)tion. Fréq. abs. littér. :215. Fréq. rel. littér. :XIXe s. : a) 423, b) 436; XXe s. : a) 240, b) 174. Bbg. GOHIN 1903, p. 266.
]. Ds Ac. 1798-1932. Étymol. et Hist. 1488 « action de féconder » (La Mer des Histoires, I, 181d, édit. 1491 ds Rom. Forsch. t. 32, p. 65). Dér. du rad. de féconder; suff. -(a)tion. Fréq. abs. littér. :215. Fréq. rel. littér. :XIXe s. : a) 423, b) 436; XXe s. : a) 240, b) 174. Bbg. GOHIN 1903, p. 266.
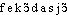 ]. Ds Ac. 1798-1932. Étymol. et Hist. 1488 « action de féconder » (La Mer des Histoires, I, 181d, édit. 1491 ds Rom. Forsch. t. 32, p. 65). Dér. du rad. de féconder; suff. -(a)tion. Fréq. abs. littér. :215. Fréq. rel. littér. :XIXe s. : a) 423, b) 436; XXe s. : a) 240, b) 174. Bbg. GOHIN 1903, p. 266.
]. Ds Ac. 1798-1932. Étymol. et Hist. 1488 « action de féconder » (La Mer des Histoires, I, 181d, édit. 1491 ds Rom. Forsch. t. 32, p. 65). Dér. du rad. de féconder; suff. -(a)tion. Fréq. abs. littér. :215. Fréq. rel. littér. :XIXe s. : a) 423, b) 436; XXe s. : a) 240, b) 174. Bbg. GOHIN 1903, p. 266.
fécondation [fekɔ̃dɑsjɔ̃] n. f.
ÉTYM. 1488, rare av. 1729; de féconder.
❖
1 Action de féconder (en parlant de l'élément mâle, chez les êtres organisés); résultat de cette action. ⇒ Conception, conjugaison, génération, reproduction. || La fécondation de l'ovule par le spermatozoïde, de la femelle par le mâle. || La fécondation consiste en la fusion (⇒ Amphimixie, cit.) d'un élément mâle (⇒ Anthérozoïde, pollen [bot.]; gamète [mâle], semence, spermatozoïde) et d'un élément femelle (⇒ Gamète [femelle], oosphère [bot.], ovule) en une cellule unique (⇒ Œuf), point de départ d'un nouvel être. || Fécondation multiple. ⇒ Jumeau. || Fécondation d'une femelle par un individu mâle d'une espèce différente. ⇒ Hybridation. || Reproduction sans fécondation. ⇒ Apomixie. || Fécondation des fleurs pourvues d'organes à la fois mâle et femelle. ⇒ Autofécondation.
1 Tous les vivants ne l'utilisent pas (la fécondation), mais seulement les plus évolués, car elle est le moyen le plus compliqué et, semble-t-il, le plus perfectionné de transmettre la vie. En dehors de la génération sexuée dont la fécondation est la maîtresse pièce, il existe beaucoup d'autres types de génération que nous pouvons rassembler sous deux titres, la scissiparité et la génération asexuée (…)
Avec la génération sexuée apparaît la fécondation qui suppose la rencontre de deux cellules sexuelles.
Jules Carles, la Fécondation, p. 5-8.
2 (…) les végétaux, comme les animaux, se reproduisent d'une façon beaucoup plus compliquée, par fécondation au moyen de la fusion de deux cellules, l'une mâle, l'autre femelle, d'où résulte une cellule unique ou œuf, qui forme l'embryon de la nouvelle plante.
P. Vallery-Radot, le Grand Mystère de la cellule à l'homme, p. 32.
3 La fécondation et la nidation de l'œuf sont le couronnement logique de la vie génitale de la femme… (La fécondation) résulte de la pénétration de l'ovule par le spermatozoïde. Elle se fait à la surface même de l'ovaire ou dans son voisinage immédiat, au niveau du tiers externe de la trompe.
André Binet, Vie sexuelle de la femme, p. 276.
4 (…) théoriquement, dans les conditions habituelles, la fécondation n'est possible que si l'insémination a eu lieu dans les deux ou trois jours qui précèdent ou qui suivent la ponte ovulaire.
R. Fabre et G. Rougier, Physiologie médicale, p. 278.
5 (…) cet acte naturel de la fécondation, que le mariage sanctifie et par lequel le grand mystère de la vie se perpétue.
Gide, Corydon, Premier dialogue.
♦ (1864, Revue des cours scientifiques, p. 80). || Fécondation artificielle. ⇒ Insémination. || Fécondation in vitro (⇒ F. I. V., in vitro; → Bébé éprouvette) et transfert d'embryon (abrév. : Fivete).
2 (XXe). Acte de rendre fertile. || La fécondation des terres par les eaux.
❖
COMP. Autofécondation, interfécondation, pseudofécondation, surfécondation.
Encyclopédie Universelle. 2012.