DOULEUR
Les mécanismes neurophysiologiques qui provoquent chez l’homme une sensation de douleur ne sont pas encore totalement connus. Deux conceptions s’affrontent depuis longtemps. Pour les uns, la douleur aurait, comme les autres sensations spécifiques prenant leur origine dans les tissus cutanés (tact, pression, chaud et froid), ses récepteurs propres et ses lignes privées jusqu’aux centres de perception; pour les autres, la sensation de douleur serait un phénomène plus complexe qui prendrait son caractère pénible dans l’organisation des projections centrales des messages qui atteignent les centres d’appréciation.
L’opposition entre ces deux théories a commencé au siècle dernier, lorsque A. Goldscheider proposa de considérer la douleur comme provoquée par la surstimulation de certains des récepteurs qui, normalement stimulés, donnent lieu à des sensations ayant une qualité sensorielle bien définie. Goldscheider s’opposait ainsi à M. von Frey qui ne voyait dans la douleur qu’une autre sensation spécifique.
M. von Frey fondait sa conviction sur l’étude de la douleur piqûre, sensation relativement bien localisée et qui se rapproche par cette qualité des sensations spécifiques. Mais la sensation de piqûre ne constitue qu’un cas particulier de la douleur, qui comprend bien d’autres modalités (démangeaison, écrasement, brûlure...). Il est certain, d’autre part, que, chez l’homme normal, les stimulations qui provoquent une sensation douloureuse sont toujours plus intenses que les stimuli spécifiques. Elles mettent donc en jeu, outre les récepteurs spécifiques classiques, des récepteurs qui n’avaient pas fonctionné avec des stimuli plus faibles. Actuellement, ces récepteurs sont appelés «nocicepteurs» par les tenants de la douleur sensation spécifique. Pour eux, la douleur n’apparaît que parce que sont mis en jeu ces récepteurs spécialisés.
Cependant, la mise en jeu des nocicepteurs s’accompagne souvent de l’activation de récepteurs à seuil plus bas. Des interactions peuvent donc en résulter entre les messages émis par l’un et par l’autre type de récepteur. C’est sur ces interactions qu’insistent les physiologistes qui voient dans la douleur un phénomène plus complexe qu’une simple sensation spécifique. Si l’on examine en effet, depuis la périphérie jusqu’au cortex cérébral, la structure et les propriétés actuellement connues des relais et des voies des messages douloureux, il apparaît difficile d’expliquer tous les phénomènes douloureux par la seule théorie spécifique, en particulier chez les patients atteints de douleurs provoquées par la lésion de conducteurs nerveux (douleurs de désafférentation).
1. Afférences nociceptives
Récepteurs
Les récepteurs des tissus cutanés sont constitués par des terminaisons nerveuses encapsulées et des terminaisons libres. Il est maintenant classique de ne pas considérer comme valables les relations simples qui ont été proposées par M. von Frey entre certains types morphologiques de récepteurs encapsulés et une sensation définie d’origine cutanée. Si un rôle est certainement joué dans le tact par les récepteurs de Meissner, les sensations tactiles qui apparaissent dans des régions privées de ce type de récepteur (les muqueuses buccales par exemple) doivent faire intervenir d’autres récepteurs, sans doute des terminaisons non encapsulées. De même, il n’a pas été possible de confirmer le rôle qui avait été attribué à des types morphologiques de récepteurs dans les sensations de froid et de chaud. Une relation entre un message nociceptif et un élément morphologique qui le ferait naître n’a pas non plus jusqu’ici pu être démontrée. Il semble bien qu’une partie de la spécificité des récepteurs cutanés doive être recherchée plus dans des caractères biochimiques que dans des dispositions morphologiques simples (cf. D. Sinclair, in Cutaneous Sensation , et K. Andres et M. Düring, in Somatosensory System ).
De nombreuses substances chimiques sont capables de provoquer la douleur lorsqu’elles sont appliquées sur les tissus périphériques. Ce fait a conduit à proposer que certaines d’entre elles seraient le médiateur de la douleur et activeraient ses récepteurs. Les différents candidats transmetteurs furent appliqués sur les tissus cutanés préalablement mis à nu en provoquant des ampoules (D. Armstrong et C. A. Keele). Le rôle joué par le potassium et le pH, puis celui de l’histamine, d’une substance appelée facteur P, puis de la sérotonine ont été étudiés tour à tour. Il a aussi été proposé que certains polypeptides pourraient être les médiateurs de la douleur en excitant les nocicepteurs, la bradykinine en particulier, qui produit une réaction douloureuse pour des concentrations faibles injectées intra-artériellement (R. Lim). Plus récemment enfin, le rôle des prostaglandines – en particulier les types E1 et E2 – a été retenu. Elles ont, en effet, des propriétés algogènes, elles sont sécrétées par les tissus lésés, et c’est sans doute en supprimant leur synthèse qu’agissent l’aspirine et l’indométacine.
Fibres nerveuses périphériques
Le nom de nocicepteur a été donné à des éléments hypothétiques qui ne fonctionnent que lorsque les stimuli deviennent intenses et qu’ils sont ressentis comme douloureux par l’homme. En réalité, leur existence a été proposée sur la base d’expériences faites sur l’animal, dans lesquelles des enregistrements étaient obtenus au niveau de fibres nerveuses isolées et non sur les récepteurs eux-mêmes. En règle générale, une fibre nerveuse afférente est sélectivement activée par un seul type de stimulation non douloureuse (tactile légère, tactile pression, mouvements articulaires, étirement musculaire, variations thermiques...). Pour les stimulations nocives d’origine cutanée (ou nociceptives), les données sont plus complexes. Certaines fibres sont bien spécifiquement activées par des messages nociceptifs d’un type donné (surtout mécaniques), d’autres sont activées par des messages divers (mécaniques et thermiques) qui n’ont en commun que le caractère nociceptif (nocicepteurs polymodaux). Certaines fibres, enfin, sont activées par un stimulus léger; mais le message devient plus dense lorsque la stimulation appliquée, plus intense, prend un caractère nociceptif.
Les fibres nerveuses afférentes, d’origine cutanée, sont myélinisées (groupe A) ou sans gaine de myéline (groupe C). À l’intérieur du groupe A, les fibres sont classées en fonction de leur diamètre décroissant (ou de leur vitesse de conduction qui est une fonction du diamètre) en sous-groupes 見, 廓, 塚, 嗀.
Les groupes de fibres qui conduisent les messages nociceptifs cutanés ont été recherchés chez les carnivores, les macaques et récemment chez l’homme en déterminant leurs vitesses de conduction. Dans le groupe A, les fibres nociceptives chez les primates ont toutes des vitesses inférieures à 40 mètres par seconde (sous-groupes 廓 à 嗀). De nombreux nocicepteurs sont aussi connectés à des fibres C.
Dans les muscles, on a montré chez les carnivores que des fibres des groupes A 嗀 (appelé aussi groupe III à ce niveau) et C (groupe IV) sont activées par les stimulations nociceptives mécaniques et chimiques. Une partie seulement des fibres des groupes III et IV conduiraient des messages nociceptifs.
Les systèmes mis en jeu par les douleurs viscérales sont encore mal connus. C’est certainement dans leur cas que la théorie selon laquelle la douleur serait due à une surstimulation des récepteurs s’applique le mieux. Ainsi, la douleur semble se produire quand un nombre important d’impulsions atteint la moelle, alors qu’un message modéré ne produit que le désir de vider vessie ou rectum. Les fibres provenant de la pulpe dentaire appartiennent aux groupes A 嗀 et C. Chez l’homme, depuis longtemps, la question avait été posée d’une relation possible entre la spécificité du message et certaines caractéristiques de la fibre qui le transmet, en particulier de son diamètre et de sa myélinisation. C’est ainsi qu’il est classique d’attribuer la conduction des messages douloureux à des fibres A de petit diamètre (sous-groupe 嗀, vitesses de conduction inférieures à 20 m/s) et à des fibres C.
Ces données proviennent d’expériences pratiquées chez l’homme en usant de blocs partiels de conduction nerveuse et de stimulations, avec intensités croissantes, de troncs nerveux périphériques. C’est aux résultats des blocs par la cocaïne et l’ischémie que l’on doit les idées classiques sur le rôle, dans la transmission des messages douloureux, des fibres C et des fibres A. C’est ce double système de conduction qui serait responsable d’une dualité de sensation appelée la double douleur . Chez la plupart des sujets, en effet, une latence de 0,5 à 1 seconde sépare une première bouffée sensitive, provoquée par la piqûre ou le pincement, d’une seconde sensation, souvent plus désagréable et ressemblant davantage à la brûlure ou à l’écrasement. L’existence de cette seconde douleur, connue depuis J. Gad et A. Goldscheider, a tout d’abord été niée par G. H. Bishop, puis retrouvée par W. M. Landau et par G. H. Bishop et niée à nouveau par C. M. Jones, sur la base d’études psychologiques. Des expériences plus récentes de G. S. Brindley, celles de J. D. Hardy et de ses collaborateurs, montrant que chacune des douleurs (rapide et lente) est produite par l’échauffement local avec deux seuils différents, semblent bien prouver l’existence de la double douleur. Les délais que prennent les messages qui provoqueraient la seconde douleur (de 0,5 à 1 s) conduisent de plus à attribuer à ceux-ci une conduction lente dans les nerfs périphériques, dans des fibres de petit diamètre, en majorité non myélinisées, les fibres C.
Le bloc nerveux ischémique (garrot, phlébite), qui supprime la conduction dans les fibres A avant de toucher à la conduction des fibres non myélinisées, laisse comme dernière sensation, dans la région qu’il déconnecte transitoirement, une douleur mal localisée, de type brûlure ou écrasement, qui est donc sans conteste due à la conduction dans des fibres non myélinisées. Les blocs cocaïniques, qui font disparaître en premier la conduction dans les fibres non myélinisées, suppriment les douleurs qui ont le caractère de brûlure et d’écrasement que nous venons de décrire.
L’ensemble de ces expériences a conduit à attribuer à des fibres A la conduction des messages provoquant la première douleur (rapide) et à des fibres lentes non myélinisées (C) la conduction des messages provoquant la seconde douleur (lente). H. E. Torebjork et R. G. Hallin ont montré qu’il en est bien ainsi en utilisant chez l’homme la stimulation et l’enregistrement d’un nerf associés à des blocs sélectifs. Les messages conduits par les seules fibres A provoquent une sensation de choc bref douloureux qui est suivi, lorsque les fibres C sont à leur tour activées, par une sensation de brûlure de longue durée.
C’est lorsqu’on cherche à donner, à l’intérieur du groupe A, un rôle particulier à un type de fibres pour le rendre responsable de la douleur rapide que difficultés et contradictions apparaissent. Comparant les blocs ischémiques produits par le garrot au bloc de compression nerveuse, les auteurs qui ont vu disparaître le tact et la température avant la douleur rapide ont pensé pouvoir attribuer cette dernière à des messages conduits par les fibres A 嗀. La compression des fibres A fait en effet disparaître la conduction dans les fibres myélinisées dans l’ordre 見 廓 塚 嗀, mais H. H. Gasser a montré que l’ischémie la faisait disparaître dans l’ordre inverse 嗀 塚 廓 見; il n’est donc pas possible, sur la base de ces expériences, d’attribuer un rôle particulier aux fibres myélinisées, de différents diamètres. Des expériences réalisées chez le chat et le singe vont dans le même sens et montrent que les messages tactiles, que l’on suppose conduits par les seules fibres A 見 (les plus rapides), sont en partie conduits par des fibres A 嗀 (10 m/s) alors qu’il existe, nous venons de le voir, des nocicepteurs reliés à des fibres de groupes de conduction plus rapides (chez le chat de 30 à 10 m/s, chez le singe 40 m/s et au-dessous).
Les stimulations électriques de fibres de nerfs périphériques pratiquées chez l’homme normal avec des chocs uniques d’intensités croissantes montrent pourtant, selon W. F. Collins, A. Nulsen et C. T. Randt, que la mise en jeu par une stimulation électrique peu intense des fibres rapides A 見 ne provoque que des sensations tactiles, et ce n’est que lorsqu’une stimulation plus intense fait intervenir les fibres myélinisées de plus faible diamètre que la stimulation devient douloureuse, puis intolérable lorsque les fibres C interviennent. Cependant, nous devons noter que, lorsque la conduction apparaît dans les fibres fines, non seulement des fibres 見 sont encore recrutées, mais que de nouvelles fibres tactiles doivent aussi intervenir (en admettant que l’homme ait des dispositions voisines de celles du macaque pour le tact). Une claire différenciation, dans le spectre des fibres A, entre des fibres tactiles de grand diamètre ( 見) et des fibres nociceptives de fin diamètre ( 嗀) est difficile à soutenir sur la base de ces expériences; celles-ci prouvent seulement que des stimulations électriques brèves et peu intenses, qui ne mettent en jeu qu’un petit nombre de fibres A 見, ne produisent pas de sensations douloureuses chez l’homme normal. La mise en jeu des seules fibres A 廓 (inférieures à 40 m/s) peut d’ailleurs provoquer une sensation douloureuse si le train qui parcourt ces fibres est répétitif (J. C. Willer et al.). Donnée qui remet en valeur le rôle important que jouent le facteur temporel et la somation pour l’évocation d’une sensation douloureuse. Dans le même sens vont les expériences de stimulation de la pulpe dentaire chez l’homme. Stimulée au seuil par un choc unique grâce à des électrodes implantées, celle-ci provoque une sensation difficile à décrire mais non douloureuse. Cette sensation devient franchement désagréable lorsque l’accroissement de la stimulation ou la répétition font intervenir la convergence spatiale ou temporelle.
Trajet et relais spinal
À la suite de lésions accidentelles, supprimant la conduction dans un faisceau antérolatéral de la moelle, les sensations douloureuses et thermiques disparaissent dans un territoire périphérique au niveau duquel par ailleurs le tact et le sens de la position sont respectés. Le territoire anesthésique se trouve du côté opposé de celui de la lésion médullaire. Cette observation a conduit à réaliser des lésions d’un faisceau spinal antérolatéral croisé pour soulager des douleurs pathologiques provoquées par des hyperstimulations des nerfs des membres ou du tronc. Ces opérations, pratiquées après ouverture du canal rachidien ou par voie transcutanée sous contrôle radiologique, soulagent les patients pendant des périodes relativement longues (de quelques mois à plusieurs années).
La perte de la faculté de ressentir la douleur se produit, alors que le tact et le sens de la position sont respectés, lorsqu’une maladie de la substance grise interrompt dans la moelle les voies croisées (syringomyélie).
C’est essentiellement en raison des deux faits que nous venons de rapporter qu’un rôle primordial dans la conduction des messages nociceptifs a été attribué à une voie se trouvant dans le quadrant médullaire antérolatéral, contralatéral à la zone périphérique où naît le message douloureux. Il est possible que certains messages nociceptifs intenses empruntent en outre une voie ipsilatérale non croisée du quadrant antérieur, ainsi que le montrent certaines données recueillies chez l’homme par J. C. White et W. H. Sweet et chez le singe par J.-L. Lalonde et L. Poirier. Le rôle prépondérant que joue la voie antérolatérale croisée élimine donc, comme vecteur des messages douloureux, les fibres non relayées des colonnes dorsales qui atteignent ipsilatéralement le bulbe puis, après croisement, le noyau ventral postérieur du thalamus. Cela signifie que les messages dolorigènes se trouvent déjà relayés au niveau spinal. La localisation et les propriétés des cellules spinales, d’où partiront vers les centres les voies de la douleur, ont été et sont encore l’objet de la majorité des recherches sur les mécanismes neurophysiologiques de la douleur. Il convient donc d’examiner ici les caractéristiques de ces cellules et d’étudier tout d’abord comment se distribuent les signaux nociceptifs au niveau des cellules médullaires.
Les fibres apportant les messages afférents entrent dans la moelle par les racines dorsales, qui se séparent à ce niveau en un groupe de racines secondaires ou sous-racines. Chacune de ces sous-racines contient deux divisions. L’une, la plus médiane, est constituée des fibres de plus grand diamètre (A 見, 廓), l’autre, la division latérale, des fibres myélinisées de fin diamètre (A 嗀) et des fibres non myélinisées. Cet arrangement a pu être longtemps mis en doute, mais, actuellement, il semble bien démontré, aussi bien chez l’homme que chez l’animal. Le fait que S. W. Ranson, en sectionnant sélectivement cette division latérale, avait supprimé chez l’animal certaines réactions nociceptives a conduit à pratiquer la lésion sélective des contingents latéraux des racines dorsales pour supprimer certaines douleurs d’origine périphérique.
Cette dichotomie au niveau de l’entrée des fibres a permis aussi de déterminer chez l’animal les zones de terminaison dans la moelle des fibres de différents diamètres. C’est en associant, à des lésions sélectives de l’une ou l’autre des divisions des sous-racines, les méthodes de dégénérescence ou de coloration des fibres des racines dorsales par la peroxydase du raifort, qu’ont été réunies les données anatomiques actuellement admises sur les types de cellules médullaires qui reçoivent les messages tactiles et nociceptifs – données qui seront détaillées plus loin.
Les cellules de la moelle sont généralement classées en dix couches, en fonction d’un schéma proposé par B. Rexed, à la suite d’une étude cytoarchitectonique de la moelle du chat. Même si la structure de la substance grise du singe et de l’homme ne répond pas rigoureusement à cette schématisation et est mieux décrite dans les termes employés par S. Ramon y Cajal (zone marginale, substance gélatineuse de Rolando, noyau propre), on y retrouve physiologiquement les types cellulaires décrits chez le chat et il est commode de désigner ceux-ci par le nom de la couche dans laquelle ils apparaissent le plus fréquemment.
La figure 1 présente, pour la moelle du chat, les équivalences entre les deux nomenclatures. Les fibres afférentes myélinisées de fin diamètre et les fibres C atteignent essentiellement les couches les plus dorsales soit directement, soit en longeant vers le haut ou le bas le tractus de Lissauer. Les fibres myélinisées de fin diamètre se terminent sur les cellules des couches I et IIa (II externe), les fibres C essentiellement sur les cellules de la couche IIb (II interne). L’ensemble de la couche II forme la substance gélatineuse de Rolando. Les fibres myélinisées de grand et de fin diamètre se dirigent vers les colonnes dorsales et envoient des collatérales vers les cellules des couches plus profondes (III et au-delà). Sur les cellules des couches V viennent converger, avec des afférences myélinisées de diamètres divers, des afférences non myélinisées. La détermination du type de stimulation capable d’entraîner l’activité des cellules des différentes couches a été associée avec l’injection intracellulaire de colorant. Cette méthode a permis de montrer qu’il existe plusieurs couches dont les cellules reçoivent des messages nociceptifs. Ceux-ci atteignent des cellules de la couche I et certaines cellules de la couche II. Les champs récepteurs périphériques de ces cellules nociceptives sont relativement restreints. Au niveau de la couche I arrivent aussi sur certaines cellules les messages thermiques. Les cellules des couches III et IV ne reçoivent que des messages tactiles. Au niveau de la couche V, les cellules sont activées à la fois par des afférences tactiles légères et par des afférences nociceptives. Ces cellules sont activées à partir d’un champ tactile restreint, mais le pincement ou la brûlure d’un champ plus large accroît leur décharge; des afférences viscérales arrivent aussi sur ces cellules. Les cellules de la couche VI reçoivent essentiellement des afférences musculaires. Des afférences nociceptives sont trouvées à nouveau sur les cellules de la couche VIII; à ce niveau, les champs sont souvent bilatéraux. Dans les couches VII et IX sont mélangés interneurones des réflexes de flexion et motoneurones.
En résumé, trois principaux types de cellules médullaires reçoivent donc des influx nociceptifs, les cellules des couches I, V et VIII. Celles des couches I et VIII sont nociceptives spécifiques; pour les physiologistes qui cherchent une voie spécifique de la nociception, c’est à leur niveau que se trouverait le relais spinal de la voie ascendante. Les cellules de la couche V au contraire traitent aussi bien messages tactiles que nociceptifs; le rôle de ces cellules est considéré comme primordial par les physiologistes qui pensent que la douleur est liée à l’organisation d’interactions entre messages au niveau central. On sait en effet que la convergence, qui est une des caractéristiques des afférences que reçoivent les cellules de la couche V, est un facteur important pour provoquer la douleur. Les cellules de la couche VI ont sans doute un rôle voisin de celles de la couche V. Mais, si ces dernières traitent les messages cutanés, les premières traitent les messages provenant des muscles et des tissus profonds.
Les médiateurs qui interviennent au niveau des jonctions entre fibres afférentes et cellules nociceptives ont surtout été recherchés pour les fibres afférentes de petits diamètres et dans les couches médullaires les plus superficielles. L’un de ces médiateurs, la substance P (un décapeptide), bien qu’il soit distribué dans toute la moelle, est plus concentré dans les couches superficielles (I et II). Les corps cellulaires des ganglions rachidiens qui contiennent de la substance P sont de petit diamètre et correspondent à des fibres très fines. Un autre peptide, la somatostatine, contenu lui aussi dans les petites cellules du glanglion rachidien, est lié à des terminaisons médullaires plus profondes. Quelques données obtenues par iontophorèse semblent attribuer un rôle à ces médiateurs dans la transmission synaptique de messages douloureux; mais que d’autres médiateurs soient aussi impliqués n’est pas une hypothèse à rejeter (cholécystoquinine, vasoactive intestinal polypeptide, angiotensine). Il est certain que la détermination du ou des transmetteurs de la nociception, importante car elle pourrait permettre de trouver des agents bloquant les influx nociceptifs dès le premier relais médullaire, est une recherche encore à ses débuts.
2. Modulation et contrôle du message afférent
Modulation
Une des caractéristiques de la douleur chez l’homme normal est la fluctuation, en fonction des conditions comportementales, de l’efficacité du message qui peut donner naissance à cette douleur (H. K. Beecher). Il faut donc, pour expliquer ces variations d’action du même message, que des inhibitions ou des facilitations viennent agir à divers niveaux sur les voies qui le transmettent. S’il est possible que des processus circulatoires neurovégétatifs (système nerveux sympathique) modifient le fonctionnement des zones réceptrices, en revanche, un contrôle nerveux d’origine centrale, s’exerçant au niveau des récepteurs cutanés, n’a jamais été démontré. Des contrôles, qui proviennent du système cérébro-spinal, doivent donc s’exercer au niveau des relais centraux (spinaux, bulbaires et thalamiques).
Au niveau spinal, c’est sur les cellules des couches IV (qui, rappelons-le, ne reçoivent que des influx tactiles) et des couches V que l’existence des effets modulateurs a été le mieux démontrée. Ce fait a contribué à faire attribuer aux cellules des couches V le rôle de relais principal des afférences douloureuses. En 1965, R. Melzack et P. D. Wall ont suggéré, compte tenu de ces données, l’hypothèse dite du gate control , qui fait jouer un rôle de grande importance aux interactions entre messages conduits par les fibres de différents diamètres qui atteignent la moelle. Avec d’autres auteurs, ils soulignèrent l’importance des contrôles inhibiteurs descendants qui s’exercent au même niveau spinal.
Contrôle segmentaire
Les interactions qui se produisent au niveau d’un segment de moelle (zone correspondant à une vertèbre) ont été tout d’abord étudiées en observant les potentiels d’évolution lente, qui apparaissent sur les racines dorsales après la bouffée afférente et qui matérialisent inhibition et facilitation. Chez l’animal non anesthésié, ces ondes lentes (potentiels de racine dorsale) sont diphasiques, négatives, puis positives, elles durent environ 0,25 seconde.
La phase négative correspond à une dépolarisation des terminaisons afférentes et réduit, pendant toute sa durée, le transfert par la synapse médullaire des signaux qui atteignent la moelle (action dite présynaptique). Elle est donc accompagnée d’une inhibition de l’activité cellulaire au niveau des cellules IV et V qui reçoivent ces signaux. L’accord n’est cependant pas fait sur la place des cellules qui serviraient d’intermédiaires sur la voie de cette inhibition. Les uns, comme P. D. Wall, les ont placées au niveau de la substance gélatineuse de Rolando, les autres, comme J. C. Eccles et ses collaborateurs, au niveau des couches VI et VII.
La phase positive correspond à une hyperpolarisation des terminaisons. Elle a donc une action facilitatrice et accroît les effets des messages tardifs. D’après des expériences réalisées par L. M. Mendell et P. D. Wall, elle apparaîtrait seule lorsque, les fibres A étant bloquées, les fibres fines seules (C en particulier) sont électivement activées. Ce dernier point est cependant, et avec raison, fortement controversé. Il semble certain toutefois que les messages apportés par les fibres fines ont, au niveau des cellules de la couche V, un effet excitateur tardif. Ce sont ces effets excitateurs tardifs qui sont, en règle générale, supprimés par les anesthésiques. Il est certain, d’autre part, que les effets inhibiteurs et facilitateurs, démontrés au niveau cellulaire, ne doivent pas être tous d’origine présynaptique et que des effets postsynaptiques, que ne démontrent pas les potentiels de racine dorsale, doivent aussi exister.
En conclusion, même si les mécanismes présynaptiques, invoqués par la théorie du gate control , sont loin d’être tous vérifiés, cette hypothèse a eu la qualité de suggérer des expériences et de souligner le rôle que jouent les contrôles métamériques s’exerçant au niveau spinal. L’évolution des idées sur ce point est détaillée dans les articles de P. W. Nathan et P. D. Wall (1978). Le rôle des contrôles métamériques et intersegmentaires a été démontré par des études comportementales réalisées chez le macaque par D. Denny-Brown et ses collaborateurs. Les relations intersegmentaires inhibitrices et facilitatrices des réflexes de retrait, provoqués par des signaux nociceptifs, empruntent l’une et l’autre le faisceau de Lissauer qui contient les fibres qui relient entre eux les segments médullaires adjacents et se trouve placé dans la substance blanche latérale de la moelle juste adjacente à la partie supérieure de la corne dorsale.
Contrôles d’origine supraspinale
L’existence d’un contrôle ayant son origine au niveau cortical et s’exerçant au niveau spinal a été démontrée en premier lieu par K. E. Hagbarth et F. W. Kerr en 1954. Ces derniers, par la stimulation du cortex somato-moteur, ont pu inhiber les afférences conduites par la voie spinothalamique. K. E. Hagbarth et ses collaborateurs ont ensuite montré que des unités de la corne dorsale subissent les mêmes effets inhibiteurs. Des potentiels de racine dorsale apparaissent aussi à la suite de ces stimulations corticales. Ils sont essentiellement négatifs chez l’animal anesthésié et correspondent donc à une inhibition des activités afférentes; ils sont, ici encore, diphasiques lorsque l’animal n’est pas anesthésié. Des contrôles inhibiteurs précoces et facilitateurs tardifs provenant des centres supérieurs s’exercent donc sur les zones spinales de transmission. Les aires corticales qui les provoquent sont les cortex sensori-moteur et orbitaire chez le chat. Chez le singe, les contrôles spinaux sont produits aussi à partir du cortex somato-moteur. Ces contrôles ont une organisation topique; par exemple, l’aire de projection corticale des afférences du membre postérieur contrôle au niveau des cornes dorsales la zone qui relaie les afférences du même membre. Les messages qui provoquent ces contrôles passent par la voie pyramidale (E. Fetz) et par des voies relayées réticulo-spinale et rubro-spinale (E. Jankowska et T. Hongo). D’autres zones centrales modulent aussi l’activité des cellules de la couche V (fig. 2). Les stimulations de la substance grise périaqueducale et des noyaux du raphé produisent des inhibitions à ce niveau. La démonstration de cet effet a suivi celle d’une analgésie comportementale, provoquée chez le rat et le chat en stimulant certaines zones de la substance grise périaqueducale et les noyaux du raphé, par D. V. Reynolds, puis J. C. Liebskind et ses collaborateurs. La comparaison des analgésies comportementales, provoquées par stimulation du gris central avec l’action de morphinomimétiques (H. Akil et al., 1972), a permis de proposer pour ces deux effets des mécanismes communs. Cette hypothèse est étayée par l’antagonisme qu’exerce la naloxone sur l’une et l’autre action.
Origine centrale des inhibitions descendantes
La démonstration comportementale chez l’animal de l’analgésie provoquée par stimulation de la substance grise périaqueducale a conduit à négliger, pendant quelques années, le rôle inhibiteur que le cortex pourrait avoir sur les messages nociceptifs. Cela d’autant plus que des expériences de chercheurs américains (J. D. Coulter et al.) semblaient montrer que les stimulations des contrôles descendants d’origine corticale agiraient essentiellement en supprimant la composante tactile du message afférent qui atteint les cellules de la couche V, tout en respectant le message nociceptif, alors qu’au contraire les stimulations de la substance grise centrale auraient un rôle sélectif sur les messages nociceptifs. Cette hypothèse intéressante a été, par la suite, fortement controversée. Un rôle électif sur la douleur des régions périaqueducales n’a pu être démontré par les neurochirurgiens (cf. infra ). Il convient par conséquent de reconsidérer les rôles joués non seulement par la substance
grise périaqueducale, mais aussi par le cortex somato-moteur et toutes les régions capables de provoquer sa mise en jeu (voies spécifiques des colonnes dorsales, noyau ventral postérieur).
Il convient aussi de ne pas négliger que les contrôles modulateurs de la nociception pourraient s’exercer non pas seulement au niveau spinal à l’entrée des messages, mais encore dans d’autres relais centraux de la nociception.
3. Voies ascendantes et relais centraux des messages nociceptifs
Messages provenant du corps
Nous avons vu plus haut que la majorité des voies ascendantes de la nociception se trouvaient, chez les mammifères, dans le cordon antérolatéral. Des études d’anatomie comparée ont conduit G. Bishop, puis W. R. Mehler à séparer à ce niveau trois composantes que montre la figure 3:
– Deux voies spino-thalamiques non relayées sont distinguées. L’une, appelée paléo-spino-thalamique, est constituée de fibres dont le nombre s’accroît peu lorsque les mammifères s’élèvent dans l’échelle évolutive. Cette voie se termine dans plusieurs noyaux thalamiques, connus généralement sous le terme de noyaux non spécifiques et dont les principaux sont les noyaux parafasciculaire et central latéral et une partie du noyau centre médian, du noyau genouillé médian et du noyau ventral latéral. L’autre voie non relayée est appelée néo-spino-thalamique, car elle ne prend son plein développement que chez les primates. Par définition, elle relie l’étage spinal au noyau ventral postérieur du thalamus, relais des sensations somatiques spécifiques. Cette voie néo-spino-thalamique a été recherchée par les méthodes de dégénérescence chez divers mammifères. Si des terminaisons relativement denses ont été décrites au niveau du noyau ventral postérieur chez le singe et l’homme (W. R. Mehler, D. Bowsher), elles n’existeraient qu’en petit nombre (W. R. Mehler) ou seraient même inexistantes (J. Boivie) chez le chat. Chez les primates, la voie néo-spino-thalamique atteindrait aussi une zone située juste en arrière du noyau ventral postérieur, constituée essentiellement du noyau supragéniculé et faisant partie d’une zone mal définie anatomiquement, appelée groupe postérieur.
– À ces voies spino-thalamiques directes s’ajoutent des voies relayées. La majorité des longues fibres des voies antérolatérales se terminent au niveau de la formation réticulée bulbaire et mésencéphalique (J. Dejerine, A. Brodal). À partir de ces relais réticulaires, des voies vont rejoindre les mêmes noyaux thalamiques non spécifiques que nous avons cités plus haut. Enfin, des voies spino-tecto-diencéphaliques et des voies relayées de multiples fois dans la moelle existent et pourraient, elles aussi, conduire les messages nociceptifs vers le thalamus et l’hypothalamus (cf. D. Albe-Fessard et al., 1985).
Il convient de citer aussi deux voies relayées au nivau spinal et étudiées surtout chez le chat. L’une emprunte les colonnes dorsales et va rejoindre les noyaux de Goll et Burdach. L’autre est constituée par une voie ipsilatérale du cordon dorsal latéral, le faisceau spino-cervico-thalamique, ou faisceau de Morin. Cette voie prend son origine essentiellement dans la couche IV; elle suit un chemin ipsilatéral jusqu’au niveau des premières vertèbres cervicales et doublerait la voie spécifique des colonnes dorsales. Cette voie est moins développée chez les primates que chez le chat; elle n’a donc pas été représentée dans la figure 3.
Si les terminaisons centrales des différents groupes de fibres antérolatérales sont relativement bien identifiées, en revanche, la position dans la substance grise médullaire de leurs cellules d’origine et leur disposition dans le cordon antérolatéral étaient, jusqu’à une époque récente, très mal connues. Deux techniques ont permis de déterminer les cellules d’origine des divers faisceaux. L’une est neurophysiologique; pour déterminer la position d’un corps cellulaire lorsqu’on connaît les régions où passent et où se terminent les fibres qui en sont issues, il suffit de stimuler les fibres et de rechercher les corps cellulaires qui sont envahis par les influx nerveux qui parcourent antidromiquement leurs axones. L’autre, anatomique, utilise l’injection de peroxydase du raifort au niveau des lieux de terminaisons centrales et l’étude après quelques heures des divers étages spinaux. En raison de critères différents plus ou moins sévères d’antidromicité, les résultats ont été discordants chez le chat. Il semble bien cependant que, chez cet animal, aucune cellule de la moelle dorsale lombaire (peu dans la moelle cervicale) n’envoie de fibres non relayées au thalamus, alors que les cellules de la couche VIII sont à l’origine d’un faisceau spino-réticulaire. Chez le singe, au contraire, les cellules des couches I comme les cellules des couches V envoient leurs afférences vers le thalamus spécifique, aussi bien à partir des zones lombaires que cervicales. Les cellules des couches I et VIII et peut-être V envoient d’autre part des messages vers le thalamus non spécifique et la formation réticulée bulbo-mésencéphalique.
La voie néo-spino-thalamique n’existe donc que chez les primates et prend son origine dans les couches I et V, les voies paléo-spino-thalamique et spino-réticulaire ont leur origine dans la corne dorsale et la corne ventrale (fig. 3).
En résumé, deux grands groupes de voies et de structures thalamiques transmettent et reçoivent les messages nociceptifs chez le primate:
1. La voie néo-spino-thalamique conduit bien des messages nociceptifs. Elle est constituée de fibres myélinisées, et est assez rapide (50 m/s au maximum). Les signaux qu’elle transmet ont une localisation d’origine relativement précise. Elle se termine au niveau du noyau ventral postérieur et des structures juste postérieures à ce noyau.
2. Un autre ensemble de voies existe, qui relie la moelle avec ou sans relais bulbo-mésencéphalique à certains noyaux thalamiques médians dits souvent non spécifiques. Les réponses des cellules de ces noyaux lors des stimulations périphériques ont des caractéristiques très particulières. Une cellule peut être activée à partir de champs périphériques très vastes, composés par exemple de la surface entière du corps, de la moitié de celle-ci, etc. Ces convergences se produisent en cascades; les premiers neurones spinaux accomplissent une part d’entre elles, puis les bulbaires, puis les thalamiques. On verrait mal que des cellules dont l’activation ne signale que très mal la localisation de la stimulation périphérique puissent servir à apprécier des sensations douloureuses qui, chez l’homme normal, ont souvent une assez bonne localisation, même si celle-ci est sans comparaison avec la précision de représentation d’un signal spécifique. Si donc ce système non spécifique joue un rôle dans l’appréciation de la douleur, ce ne peut être que lorsqu’il s’agit de sensations pénibles mal localisées. Il se peut aussi que ces structures reçoivent un signal d’alerte annonçant qu’un processus lésant est apparu dans une zone dont la localisation est fournie par une sensation spécifique associée, relativement bien localisée. Les structures non spécifiques elle-mêmes, ainsi que les relais spinaux et réticulaires des voies qui les atteignent, subissent des contrôles descendants provenant essentiellement du cortex prémoteur et peut-être des corps striés. Si ces structures sont impliquées dans la conduction des messages dolorigènes, ces contrôles pourraient rendre compte, comme ceux que nous avons décrits pour les cellules spinales de la couche V, des modulations que subissent les messages douloureux.
Messages provenant de la face
Nous n’avons jusqu’ici examiné que la projection des signaux qui sont produits chez l’animal au niveau des membres ou du tronc. Les messages nociceptifs qui atteignent les centres par le nerf trijumeau (Ve nerf crânien) ont une dualité de projection centrale qui rappelle celle que nous venons de décrire pour les afférences provenant des membres. Ils relaient à la fois, dans le noyau principal du Ve nerf (homologue des noyaux de Goll et Burdach) et dans une colonne de substance grise qui constitue le prolongement de la corne dorsale, le noyau spinal du trijumeau. À ce niveau, les influx provenant de la face sont intégrés avec les influx entrant par les premières racines cervicales. Ce noyau spinal du trijumeau est lui-même divisé en trois sous-noyaux, oralis, interpolaris, caudalis. Des voies ascendantes allant vers le thalamus partent du noyau principal et des sous-noyaux oralis et caudalis. Des voies partant du noyau principal atteignent les relais thalamiques spécifiques (V.P.M.) ipsi- et contralatéraux; il s’agit essentiellement des projections spécifiques primaires. D’autres voies qui partent du sous-noyau oralis et du sous-noyau caudalis seraient l’équivalent des voies spino-thalamiques. Des composantes non relayées dans la formation réticulée adjacente constituent l’équivalent des voies néo-, paléo- et spino-réticulo-thalamiques décrites chez l’homme. Au niveau du noyau caudalis, on a démontré l’existence de contrôles inhibiteurs et facilitateurs qui rappellent ceux qui ont été observés pour les afférences du membre et du tronc (N. Yanagizawa et D. Denny-Brown). Il est classique d’attribuer au noyau caudalis un rôle essentiel dans la transmission des messages douloureux. Cette donnée est, en particulier, appuyée sur les effets de lésions localisées de la racine descendante chez l’homme. Celles-ci étaient spontanées (J. Déjerine) ou réalisées pour soulager des douleurs de la face (Z. Kunz). Il semble bien cependant que (tout au moins chez le chat) le noyau oralis ait un rôle important à jouer dans la transmission des influx douloureux provenant de la région buccale.
4. Projections corticales
Les voies qui relient le ventral postérieur et le thalamus médian au cortex et au corps strié ont été déterminées chez l’animal. Nous les avons schématisées dans la figure 2. Le ventral postérieur se projette sur le cortex somatique dans l’aire SI, l’aire SII. La partie antérieure du noyau ventral postérieur, le noyau ventral intermédiaire, qui reçoit chez le singe et chez l’homme les signaux provenant des muscles se projette par des voies directes et relayées au niveau du cortex moteur. Le thalamus médian se projette sur les corps striés et l’aire 6. Il s’agit d’une projection d’ensemble de ces noyaux. Existe-t-il des zones télencéphaliques privilégiées vers lesquelles vont se projeter les afférences nociceptives dont nous savons qu’elle atteignent les deux niveaux thalamiques? Nous discuterons de ce point en traitant des zones qui, chez l’homme, servent à l’appréciation consciente du signal douloureux.
5. Activation de structures centrales par des influx nociceptifs
Déterminer, chez l’animal, les caractéristiques des neurones qui reçoivent des stimulations nociceptives est plus aisé dans la moelle que dans les centres thalamo-corticaux. Pour l’étude spinale, il est possible, en effet, de sectionner les voies qui conduisent les signaux nociceptifs vers le thalamus et le cortex et d’éviter ainsi la souffrance des animaux d’expérience. Pour l’étude des structures centrales, au contraire, seules deux préparations sont utilisables: les animaux anesthésiés et les animaux éveillés en préparation chronique. Dans le premier cas, les anesthésiques doivent modifier le message nociceptif, sans doute dès le premier relais médullaire, mais aussi plus haut. Dans le second cas, les stimuli trop intenses, donc clairement nociceptifs, ne peuvent être employés pour des raisons déontologiques. Cela explique que la localisation centrale des neurones recevant les messages nociceptifs soit moins bien connue que la localisation spinale.
D’autre part, les cellules des structures thalamiques spécifiques, aussi bien que non spécifiques, sont le plus souvent activées par des stimuli dont l’intensité est trop faible pour qu’ils soient classés parmi les signaux nociceptifs. Cependant, un renforcement de la stimulation accroît les réponses; il est difficile, dans ce cas, de savoir s’il s’agit de surstimulation des premiers récepteurs ou de l’arrivée de stimulations nociceptives nouvelles.
Aussi plusieurs groupes de chercheurs ont-ils tenté d’activer sélectivement des récepteurs nociceptifs. Les deux méthodes le plus couramment mises en œuvre ont été des injections de substances algogènes au niveau des membres et la stimulation de la pulpe dentaire. La substance algogène la plus utilisée a été la bradykinine. Cette substance, injectée par voie intra-artérielle, provoque chez l’homme une sensation de douleur (R. Lim). Des cellules activées par la bradykinine ont été trouvées chez le chat dans la moelle au niveau des couches V, dans le bulbe (noyau giganto-cellulaire) et dans le thalamus (noyau parafasciculaire, centre médian et le groupe postérieur; (cf. J. M. Besson et al., 1982). Des réponses ont été décrites aussi au niveau du noyau caudé par G. Krauthamer et R. Lim.
La stimulation électrique bien localisée de la pulpe dentaire (stimulation bipolaire) est considérée, lorsqu’elle est suffisamment forte (cf. supra ), comme ne provoquant chez l’homme que des sensations douloureuses. Utilisée chez l’animal avec des paramètres et des conditions voisines de celles qui, chez l’homme, produisent des douleurs fugaces et supportables, elle a permis d’observer chez le chat des réponses cellulaires au niveau des relais bulbo-pontiques, à la fois dans le noyau principal et dans les sous-noyaux caudalis et oralis. Des réponses ont été enregistrées dans le relais thalamique spécifique (V.P.M.) et le groupe postérieur, mais aussi dans le thalamus non spécifique, noyau parafasciculaire, centre médian, noyau central latéral, dans la substance réticulée, la substance grise périaqueducale et l’hypothalamus. Au niveau du cortex cérébral, des réponses multiples ont aussi été observées (L. Vyklicky et D. J. Anderson et al., 1978).
Plus récemment, enfin, des lésions périphériques ou centrales rappelant celles qui produisent chez l’homme des douleurs insupportables ont été réalisées chez l’animal. Ces modèles devraient permettre de trouver les sites centraux d’intégration des messages douloureux. Les trois modèles les plus utilisés ont été: des rats atteints de polyarthrite inflammatoire; des rats chez lesquels la section du nerf sciatique provoquait la formation de névromes; des rats chez lesquels la section de racines dorsales provoquait des anomalies comportementales dues sans doute à des sensations voisines de celles que ressent l’homme atteint du syndrome de désafférentation sensorielle d’un membre. Ces trois modèles ont été développés pour tenter de déterminer les zones centrales activées chez l’homme par les messages de la douleur maladie (cf. D. Albe-Fessard et M.-C. Lombard, 1980).
6. Lieu et mode d’action des anesthésiques, des analgésiques et des opiacés
À la suite des travaux de l’école de H. W. Magoun, il a été longtemps classique de penser que les anesthésiques agissaient en supprimant les réponses des structures réticulaires aux messages nociceptifs.
Des recherches plus récentes ont montré que l’anesthésie ne peut être attribuée à une perte de la réactivité réticulaire, car il existe des anesthésiques qui, au contraire, accroissent ces réponses. En fait, les anesthésiques semblent avoir en commun la propriété de produire une hyperpolarisation des cellules nerveuses qui réduit leur activité de base. Ils agissent tous en supprimant les effets tardifs facilitateurs qui s’exercent au niveau de la moelle et sont, sans doute, dus aux messages conduits par les fibres fines myélinisées et les fibres C. Certains d’entre eux, les barbituriques par exemple, accroissent en outre fortement les contrôles inhibiteurs spinaux et suppriment ainsi en partie le message afférent. D’autres anesthésiques, au contraire, accroissent peu l’inhibition et permettent donc un meilleur passage à la première bouffée d’impulsion afférente qui suit une stimulation (chloralose).
L’action des analgésiques a été, elle aussi, testée au niveau de la moelle et des centres. Plusieurs semblent agir en accroissant les contrôles inhibiteurs; c’est ainsi que l’action de la morphine est expliquée.
La morphine et d’autres drogues opiacées voisines, d’origine végétale, sont donc capables de se fixer et d’agir sur des membranes cellulaires animales. Cette observation a conduit à rechercher s’il n’existait pas des produits formés chez l’animal qui se fixeraient sur les mêmes sites et joueraient un rôle analogue à celui de la morphine. On a trouvé un grand nombre de substances, toutes des peptides, qui ont des actions similaires à celles de la morphine : elles ont été appelées morphinomimétiques bien qu’elles n’aient aucune propriété structurale commune avec cette drogue [cf. OPIOÏDES]. Pour trois de ces substances, la 廓-endorphine, la leucine-enképhaline et la méthionine-enképhaline, un rôle a été démontré au niveau du système nerveux; elles sont capables de réduire la douleur et aussi d’agir sur les structures viscérales. La 廓-endorphine est produite par des groupes de neurones de l’hypothalamus; quand elle est injectée au niveau de la corne postérieure de la moelle, elle a le même mode d’action sur les neurones que la morphine et empêche la transmission à ce niveau des influx nociceptifs. Les deux enképhalines sont des neurotransmetteurs trouvés dans de nombreuses régions de l’encéphale.
D’après des études biochimiques et pharmacologiques (recensées par T. L. Yaksh et T. A. Rudy), les morphines endogènes seraient les intermédiaires des inhibitions qui agissent à plusieurs niveaux du névraxe. Au niveau de la substance grise périaqueducale, elles provoqueraient l’effet inhibiteur exercé par le noyau magnus du raphé; au niveau spinal, elles transmettraient l’inhibition qui s’exerce dans la substance gélatineuse de Rolando sur les afférences nociceptives, celles-ci auraient pour médiateur à ce niveau la substance P.
Le noyau magnus du raphé est lui-même à l’origine d’une voie bulbo-spinale qui descend dans les cordons dorso-latéraux (A. Brodal, A. Basbaum et al.) et atteint les neurones de la substance gélatineuse de Rolando.
Ainsi, d’après les recherches conduites chez l’animal, morphine et morphinomimétiques auraient deux lieux d’action, l’un spinal, l’autre supra-spinal. Il a été démontré que la morphine exerce bien une action au niveau spinal chez l’homme (B. Bussel et al.). Étudiant chez des sujets paraplégiques volontaires les effets d’injection de morphine, ces auteurs ont montré que le réflexe nociceptif de flexion (qui met en jeu chez ces patients des zones médullaires totalement déconnectées des centres supérieurs) est réduit, voire même supprimé par ces injections. Au contraire, le réflexe H, qui fait intervenir des afférences musculaires rapides non nociceptives, n’est pas modifié.
J. C. Willer, d’autre part, a recherché si une action centrale de morphinomimétiques endogènes pouvait être démontrée chez l’homme. Il a employé pour ce faire l’action de la naloxone qui, on le sait, renverse les effets de la morphine et des morphinomimétiques. De ce travail il ressort que les inhibitions par endorphines ne semblent entrer en action chez l’homme normal qu’au cours du stress. Un contrôle morphinomimétique endogène doit, en revanche, être responsable d’un certain type d’insensibilité congénitale à la douleur. Le seuil du réflexe nociceptif de flexion, normalement très élevé chez les patients qui en sont atteints, prend en effet une valeur presque normale après injection de naloxone (H. Dehen et al.).
7. Le phénomène conscient
Structures thalamiques et corticales mises en jeu
Ainsi que nous l’avons vu, les influx nociceptifs se projettent dans des aires multiples. Ces diverses régions ne doivent pas intervenir dans les seules appréciations conscientes, mais leur activation doit sous-tendre aussi d’autres phénomènes comportementaux. Nous intéressant surtout, dans ce chapitre, à la douleur sensation consciente de l’homme, nous ne traiterons pas ici des expériences utilisant chez l’animal des lésions et des stimulations centrales pour troubler les comportements nociceptifs (D. Albe-Fessard et J. Delacour); seuls les résultats d’observations réalisées chez l’homme seront rapportés. Avant de le faire, nous devons cependant donner quelques précisions sur les conditions des patients qui ont permis ces observations. Ceux-ci doivent être séparés en deux groupes:
1. Les uns subissaient une intervention tentant de corriger une motricité anormale (dyskinésie); ils avaient donc un système d’appréciation normal des influx nociceptifs.
2. Les autres subissaient une intervention pour être soulagés d’une douleur anormale. Parmi ces hommes affectés d’un syndrome douloureux, nous devons reconnaître deux sous-groupes: les douleurs du premier sous-groupe sont provoquées, chez un homme ayant un système nerveux intact, par l’hyperstimulation des récepteurs et des voies nociceptives; les douleurs du second sous-groupe apparaissent au contraire chez un individu dont le système nerveux (central ou périphérique) a été atteint par une maladie, ou un traumatisme, qui a supprimé la conduction des messages produits par les stimulations périphériques. Lorsque ces lésions ont supprimé l’une ou l’autre des sensations discriminatives (tact, chaud, froid, sens des mouvements et de la position), des douleurs sont ressenties, localisées par le patient dans la zone ayant perdu cette sensibilité. Ces douleurs sont dues à une désafférentation.
Les sensations conscientes provoquées par les stimulations centrales diffèrent, nous allons le voir, selon que les patients interrogés appartiennent à l’un de ces groupes et même de ces sous-groupes.
Si les zones mésencéphaliques et thalamiques qui reçoivent les influx nociceptifs sont multiples, elles peuvent cependant être regroupées chez le primate en deux ensembles: le système latéral comprenant le faisceau néo-spino-thalamique et ses terminaisons dans le noyau ventral postérieur (V.P.) et le groupe postérieur; le système médian comprenant les relais bulbo-mésencéphaliques et les noyaux de projection dans le thalamus médian des afférences paléo-spino-thalamiques relayées et non relayées (fig. 4).
Chez l’homme conscient non anesthésié (dyskinésique ou douloureux), des stimulations localisées et des lésions ont été pratiquées dans des régions appartenant à ces deux systèmes au cours d’opérations stéréotaxiques. Les sensations rapportées par les patients ont été comparées à celles qui ont été obtenues par stimulation de la voie antérolatérale qui, dans la moelle, conduit les afférences nociceptives vers l’un et l’autre système de projection. Cette voie a été stimulée chez des patients conscients souffrant de douleur d’hyperstimulation, au cours d’opérations visant à léser les voies spino-thalamiques et pratiquées par voie transcutanée au niveau spinal haut (2e vertèbre cervicale). Le contingent spino-thalamique (néo + paléo), lorsqu’il est stimulé à ce niveau, produit des sensations de douleur et de brûlure (5 p. 100 des cas) de chaud et de froid (94 p. 100) et des paresthésies (1 p. 100) dans des zones périphériques contralatérales bien localisées. Ces types de sensations ne peuvent se confondre avec les sensations de picotement, d’électricité et d’engourdissement, localisées dans un champ ipsilatéral, qui sont produites par la stimulation des colonnes dorsales (R. Tasker et al., 1981). Les voies spino-thalamiques conduisent donc bien les messages provoquant la douleur, mais aussi et surtout ceux qui donnent lieu aux sensations de température discriminative.
Stimulations du système latéral chez l’homme normal
Au niveau du mésencéphale, la stimulation ne produit des sensations de type spino-thalamique que lorsqu’elle est appliquée au-dessus et latéralement par rapport au lemnisque médian (fig. 4). Au contraire, lorsqu’elles sont portées au niveau du lemnisque, les stimulations provoquent des sensations semblables à celles qui sont obtenues par la stimulation des colonnes dorsales.
Au niveau du thalamus, dans tout le noyau V.P. et surtout dans sa partie inférieure et postérieure, des points donnant lieu à des réponses «spino-thalamiques» et à des réponses «colonnes dorsales» sont mélangés. Cependant, lorsqu’un point provoque au seuil un type de sensations donné, un accroissement de la stimulation ne modifie pas le caractère de celle-ci. Les deux types de représentations coexistent donc à ce niveau, mais n’utilisent sans doute pas un substrat commun.
Dans une statistique réalisée sur un nombre important de malades, R. Tasker a provoqué au niveau mésencéphalo-thalamique 14,1 p.100 de sensations «spino-thalamiques» et 85,9 p.100 de réponses «colonnes dorsales». Mais, ici encore, le nombre de fois où douleur et brûlure sont provoquées est faible (3,6 p.100 de toutes les réponses) quand on le compare au nombre de réponses thermiques. Un relais des afférences nociceptives existe donc au niveau du ventral postérieur. A-t-il dans ce noyau une localisation précise? Pour R. Tasker, des points répartis dans l’ensemble de la région postéro-inférieure du V.P. joueraient ce rôle. Pour R. Hassler, A. Halliday et V. Logue, le relais de ces afférences se trouverait au niveau de la partie parvocellulaire du V.P. (V.C. pc) qui se trouve juste à la base de ce noyau (V.P.I. de la figure 4).
À partir de ce relais thalamique spécifique, les afférences nociceptives vont se projeter vers le cortex. Ce fait a été souvent mis en doute, sur la base des résultats de la stimulation corticale chez l’homme conscient rapportés par W. Penfield et E. Boldrey (11 sensations douloureuses pour 804 autres types de sensations). En fait, même si elle est clairsemée, cette projection existe au niveau de la lèvre postérieure de la scissure de Rolando (aires cytoarchitectoniques 3-1 de l’aire somatique de projection primaire SI). Son existence est démontrée par trois ensembles de données:
a ) des lésions corticales localisées provoquées par des blessures de guerre ont produit chez des hommes normaux des analgésies localisées; J. Dejerine et J. Mouzon (1915), J. Marshall (1951) parmi d’autres ont rapporté sur ces cas;
b ) des stimulations localisées du cortex somatique provoquent des douleurs localisées chez les patients qui ne sont pas atteints de syndrome douloureux;
c ) lorsqu’une crise d’épilepsie est, chez un patient, précédée par une aura douloureuse, rapportée à une zone périphérique très localisée, J. Bancaud et J. Talairach ont pu montrer que le foyer où débute la crise se trouve dans une région localisée de l’aire SI. L’ablation de ce foyer supprime les auras douloureuses.
En résumé, un système de projection spécifique de la nociception semble exister chez l’homme normal. Ses messages relaieraient dans les cellules I et V de la moelle, rejoindraient le noyau V.P., puis le cortex SI. Ce système d’appréciation serait celui qu’utilise l’homme normal et servirait de système d’alerte. Ces faits ne concernent sans doute que les douleurs provoquées à partir des zones cutanées. D’après des données de neurochirurgiens, des lésions pratiquées au niveau du noyau ventral intermédiaire (partie antérieure du noyau ventral postérieur) suppriment des douleurs musculaires. Les influx nociceptifs provenant de la musculature se projetteraient donc à travers le ventral intermédiaire au niveau du cortex moteur.
Stimulations du système médian
Chez les patients ayant un système de projection normal des influx somatiques, ces régions ont été rarement stimulées; il semble cependant qu’au niveau du mésencéphale il soit possible de provoquer la douleur brûlure. Le nombre de points qui, dans la même région, produisent la même sensation est par contre très élevé chez les patients désafférentés. Au niveau du thalamus médian, les diverses zones stimulées se sont révélées presque totalement silencieuses chez les patients «normaux». Chez les douloureux au contraire, aussi bien au niveau du mésencéphale qu’au niveau du thalamus, les stimulations provoquent la douleur. Les résultats les plus probants proviennent de patients qui sont atteints du syndrome de douleur de désafférentation. La stimulation des noyaux thalamiques médians provoque chez ces patients douleur et brûlure rapportées à une zone périphérique qui est justement la zone ayant perdu ses afférences, celle qui, chez ces patients, est spontanément douloureuse (R. Tasker, 1982).
Plusieurs aires du mésencéphale et du thalamus médian peuvent, chez un même patient, provoquer la douleur dont il souffre, et la suppression de l’une de ces aires n’atténue pas les douleurs spontanées. La douleur de désafférentation résulte donc d’un changement dans les propriétés du thalamus médian, changement qui conduit à une hyperexcitabilité de ces régions et à une extension à ce niveau de la représentation de la zone spontanément douloureuse.
Les stimulations de la zone latérale de projection nociceptive semblent, elles aussi, provoquer la douleur de désafférentation chez les mêmes patients. Cette propriété a été reconnue par R. Hassler pour le V.P., par G. Dierssen et S. Obrador pour le V.P. et la capsule interne, par J. Talairach et ses collaborateurs pour le cortex primaire.
Par contre, la stimulation des systèmes latéraux et médians ne reproduit qu’exceptionnellement la douleur dont souffrent spontanément les patients atteints de douleurs d’hyperstimulation.
Le type d’anomalie qui est responsable, chez les patients atteints du syndrome de désafférentation, de cette extension de la représentation de la zone malade dans des régions thalamiques latérales et médianes n’est pas encore parfaitement connu. Il est cependant proposé que les synapses résiduelles des régions désafférentées soient le siège d’une hypersensibilité de déconnexion qui provoque à ce niveau l’apparition d’activités épileptoïdes. De telles activités ont pu être enregistrées chez l’homme douloureux dans le mésencéphale (B. S. Nashold et W. P. Wilson) et dans la corne dorsale (J. Loeser et A. Ward). Chez le chat, elles ont été obtenues dans la moelle après lésion des racines dorsales ou du trijumeau. Enfin, chez le rat ayant subi des sections de plusieurs racines dorsales, elles ont été observées au niveau de la corne dorsale de la moelle, du noyau ventral postérieur du thalamus et du cortex.
En résumé, le système latéral des projections nociceptives doit servir à l’appréciation normale des sensations nociceptives; il doit intervenir aussi lorsque la douleur maladie n’est due qu’à une hyperstimulation des récepteurs nociceptifs. Au contraire, dans le système médian ne doit passer normalement qu’un faible contingent des messages nociceptifs provoqués par la brûlure. Le système médian n’entre véritablement en jeu que lorsque la douleur est due à une désafférentation, et il devient dans ce cas hyperexcitable.
Du point de vue pharmacologique, l’existence des activités épileptoïdes enregistrées chez l’animal et chez l’homme a conduit à utiliser des thérapeutiques antiépileptiques dont on savait déjà qu’elles étaient efficaces pour soulager les névralgies essentielles du trijumeau (tic douloureux).
8. Traitement de la douleur par des stimulations: cas des désafférentations partielles et des hyperstimulations
Les cas de douleur de désafférentation que nous venons d’examiner sont des cas extrêmes. Des douleurs apparaissent aussi dans des zones qui ne sont que partiellement désafférentées. C’est ainsi que, lorsqu’un filet nerveux sensitif est sectionné, les régions qui avoisinent la zone présentant une anesthésie totale sont en général le siège de phénomènes algiques insupportables (D. Denny-Brown). Il paraît correct d’attribuer ces douleurs à l’absence de mise en jeu des contrôles inhibiteurs des afférences nociceptives qu’activent les fibres tactiles rapides et qui agissent soit directement au niveau spinal, soit par une boucle thalamo-cortico-spinale ou cortico-réticulo-spinale. Un manque d’inhibition associé à une hyperstimulation peut expliquer aussi les douleurs qui apparaissent dans un champ désafférenté lorsque, après la section d’un nerf périphérique, des repousses du bout central des fibres nerveuses constituent un névrome d’où partira un bombardement permanent vers la moelle. Ces observations ont conduit à proposer de traiter les douleurs de désafférentation partielle en tentant de rétablir, ou d’accroître (pour les cas d’hyperstimulation), les contrôles inhibiteurs dont nous avons montré dans le chapitre 2 qu’ils existent à tous les niveaux du système nociceptif (fig. 2).
Pour ce faire, on peut agir à divers niveaux. Le plus simple est de stimuler les zones cutanées qui avoisinent la zone douloureuse, les filets nerveux qui en partent ou bien le nerf coupé sur son fragment intact encore connecté aux centres. L’inhibition de la douleur apparaît, en général, lorsque la stimulation est juste suffisante pour produire une sensation tactile dans la région désafférentée par la maladie. Des stimulateurs, dont le patient use à volonté, sont en général placés à demeure. Fréquemment, l’analgésie dure plus longtemps que la stimulation (cf. P. D. Wall, 1978; P. Procacci et J. Maresca, 1980). Une technique plus délicate, mais fondée sur les mêmes hypothèses, consiste à placer les électrodes de stimulation directement au niveau des racines dorsales ou, mieux, des colonnes dorsales, afin de rétablir les projections ascendantes qui manquent. Le test d’efficacité est, ici encore, d’obtenir par stimulation médullaire une paresthésie dans la zone douloureuse. Lorsque la stimulation des colonnes dorsales est rendue difficile, ou bien lorsque la lésion qui a supprimé l’arrivée au centre des afférences tactiles est placée très haut, il est possible de stimuler la zone de projection thalamique qui a perdu ses afférences. Pour cela, des électrodes de stimulation doivent être implantées avec précision au niveau où se trouvait la représentation thalamique absente. La douleur disparaît dès que la stimulation provoque une sensation tactile dans le territoire désafférenté; elle réapparaît dès l’arrêt de la stimulation.
L’ensemble de ces données prouve donc bien, comme H. Head et O. Forster l’avaient prévu, que l’absence de projections du système tactile transforme les projections résiduelles en des douleurs insupportables qui disparaissent dès qu’une sensation tactile est rétablie. Le fait que cette action masquante peut être obtenue par la stimulation du thalamus prouve que le cortex doit intervenir dans ce phénomène. S’agit-il de la mise en jeu par une boucle thalamo-corticale de voies descendantes inhibant, au niveau spinal, des afférences résiduelles ou bien l’interaction se produit-elle à un niveau plus central? Il est impossible de le dire dans l’état actuel de nos connaissances.
Ainsi, lorsque la douleur est due à une hyperstimulation ou à une désafférentation partielle, le rétablissement des contrôles est efficace. Au contraire, dans le cas où une désafférentation totale existe, il est vain de tenter de rétablir des contrôles qui ne peuvent agir sur des afférences qui ne sont plus là. Dans ce cas, il conviendrait donc de pouvoir stimuler les régions capables d’inhiber les structures centrales anormalement actives (thalamus médian, cortex). Il est évident aussi que, dans les désafférentations partielles, hyperstimulation et désafférentation totale doivent coexister et que le rétablissement d’inhibition devrait soulager la première composante en laissant l’autre, la plus pénible, inchangée. Il est donc important de comprendre l’origine des hyperactivités qui apparaissent dans la moelle et l’encéphale des animaux désafférentés, afin de trouver un moyen de supprimer ces activités anormales lorsqu’elles apparaissent chez l’homme. Chez le rat, il a été observé que les cellules de la corne dorsale, totalement privées des messages d’origine périphérique, deviennent hyperactives sous l’influence d’un système facilitateur provenant du cortex (voie pyramidale ou voie relayée cortico-spinale?). Des observations voisines avaient déjà été réalisées chez le singe par C. Liu et W. Chambers. Il semble donc que la désafférentation totale libère une boucle excitatrice spino-thalamo-cortico-spinale qui s’entretiendrait elle-même et serait à l’origine des sensations pénibles rapportées par erreur dans la zone périphérique, qui se projetait, avant la lésion, dans la région thalamo-corticale primaire faisant partie de cette boucle.
Chez les patients atteints de douleur de désafférentation après arrachement du plexus brachial, le seul traitement efficace est actuellement une lésion restreinte de la corne dorsale pratiquée par les neurochirurgiens ; elle supprime les sensations très pénibles qui apparaissent au niveau de la main et du bras. Les effets de cette opération peuvent probablement s’expliquer par l’interruption de la boucle qui vient d’être décrite.
Le rétablissement des contrôles inhibiteurs descendants défectueux dont l’absence est certainement à l’origine d’une partie de douleurs d’origine centrale a été aussi tenté. Pour ce faire, des électrodes ont été implantées dans la substance grise périaqueducale dont la stimulation a des effets analgésiants chez l’animal (cf. supra , chap. 2). Les résultats de ces stimulations centrales sont diversement appréciés. Pour les uns, elles sont efficaces; pour les autres, elles sont sans action (cf. B. Meyerson, in D. Albe-Fessard et Gybels). En fait, leur peu d’effet les a fait pratiquement abandonner et les douleurs de certains patients sont, jusqu’à présent, sans thérapeutique chirurgicale. C’est, en particulier, le cas des syndromes thalamiques qui sont provoqués par une lésion des voies ou centres de projection des afférences spécifiques aux niveaux bulbaire, thalamique ou cortical.
douleur [ dulɶr ] n. f.
1 ♦ Sensation pénible en un point ou dans une région du corps. Douleur physique. Transmission nerveuse de la douleur. ⇒ endorphine, enképhaline. Sentir, ressentir, éprouver une douleur. ⇒ souffrir. Cri de douleur. ⇒ aïe; plainte. Hurler, se tordre de douleur. Douleur dans la tête, le ventre; à la tête, au ventre. ⇒ 3. mal; -algie. Douleurs dentaires. Douleur aiguë, vive, déchirante, fulgurante, irradiante, lancinante, térébrante. Douleur brusque et brève. ⇒ élancement. Douleur diffuse, sourde. Douleur exquise. Douleur ressentie sur le trajet d'un nerf. ⇒ névralgie. Douleurs rhumatismales. Douleur atroce, intolérable. Paroxysme de la douleur. Qui ne cause aucune douleur. ⇒ indolore. Être sensible à la douleur. ⇒ douillet. Remède qui calme la douleur. ⇒ analgésique, antalgique, antidouleur, calmant. « tu enfanteras des fils dans la douleur » ( BIBLE Crampon).
♢ Spécialt Les douleurs de l'accouchement ou absolt les douleurs. ⇒ contraction, 1. travail. Accouchement sans douleur.
2 ♦ Douleur (morale) : sentiment ou émotion pénible résultant de l'insatisfaction des tendances, des besoins. ⇒ souffrance. « Sois sage, ô ma Douleur, et tiens-toi plus tranquille » (Baudelaire). Recherche de la douleur. ⇒ masochisme. Éprouver une grande douleur. ⇒ affliction, 2. chagrin, déchirement, deuil, peine. Douleur cruelle. Monsieur X a la douleur de vous faire part..., formule sur un avis de décès. Réveiller, raviver une douleur ancienne. ⇒ blessure (cf. Remuer le couteau dans la plaie). Partager la douleur de qqn. ⇒ compatir; condoléances, sympathie. Chant de douleur. ⇒ lamento. — Fam. J'ai compris ma douleur : j'ai réalisé ma déconvenue. PROV. Les grandes douleurs sont muettes, on ne peut les exprimer.
⊗ CONTR. Euphorie; bonheur, joie, 1. plaisir.
● douleur nom féminin (latin dolor, -oris) Sensation pénible, désagréable, ressentie dans une partie du corps : La vive douleur causée par une brûlure. Sentiment pénible, affliction, souffrance morale ; chagrin, peine : Raviver une douleur ancienne. ● douleur (citations) nom féminin (latin dolor, -oris) Émile Chartier, dit Alain Mortagne-au-Perche 1868-Le Vésinet 1951 Toute douleur veut être contemplée, ou bien elle n'est pas sentie du tout. Propos sur le bonheur Gallimard Henri Frédéric Amiel Genève 1821-Genève 1881 Plus on aime, plus on souffre. La somme des douleurs possibles pour chaque âme est proportionnelle à son degré de perfection. Journal intime, 26 décembre 1868 Claude Aveline Paris 1901-Paris 1992 Dans chaque vie, dans chaque cœur, un jour — parfois la durée d'un instant — résonne la douleur du monde. Et l'homme est justifié. Avec toi-même, etc. Mercure de France Honoré de Balzac Tours 1799-Paris 1850 La douleur ennoblit les personnes les plus vulgaires, car elle a sa grandeur, et pour en recevoir du lustre, il suffit d'être vrai. César Birotteau Honoré de Balzac Tours 1799-Paris 1850 Il n'est pas de douleur que le sommeil ne sache vaincre. Le Cousin Pons Charles Baudelaire Paris 1821-Paris 1867 Sois sage, ô ma douleur, et tiens-toi plus tranquille. Les Fleurs du Mal, Recueillement Jean Bertaut Donnay, Calvados, 1552-Séez 1611 […] une douleur n'étant ni petite ni grande, Qu'autant que le courage est ou grand ou petit. Cantique Jacques Bénigne Bossuet Dijon 1627-Paris 1704 Ô mort ! éloigne-toi de notre pensée, et laisse-nous tromper pour un peu de temps la violence de notre douleur par le souvenir de notre joie. Oraison funèbre d'Henriette-Anne d'Angleterre, duchesse d'Orléans Benjamin Constant de Rebecque Lausanne 1767-Paris 1830 La grande question dans la vie, c'est la douleur que l'on cause, et la métaphysique la plus ingénieuse ne justifie pas l'homme qui a déchiré le cœur qui l'aimait. Adolphe Bonaventure Des Périers Arnay-le-Duc vers 1500 ?-vers 1543 Le meilleur remède que je sache pour les douleurs présentes, c'est d'oublier les joies passées, en espérance de mieux avoir. Cymbalum mundi Henri Estienne Paris 1528-Lyon 1598 Au chaudron des douleurs, chacun porte son écuelle. Les Prémices Jean-Baptiste Louis Gresset Amiens 1709-Amiens 1777 La douleur est un siècle et la mort un moment. Épître à ma sœur sur ma convalescence Victor Hugo Besançon 1802-Paris 1885 Vous avez fait, mon Dieu, la vie et la clémence ; Et chacun de vos pas est marqué par un don. C'est à votre regard que tout amour commence, Vous écriviez : Douleur, un ange lut : Pardon. Les Tables tournantes de Jersey Pierre Jean Jouve Arras 1887-Paris 1976 Les joies des hommes sont aussi horribles que leurs douleurs. Le Monde désert Mercure de France Alphonse de Prât de Lamartine Mâcon 1790-Paris 1869 Rien n'est vrai, rien n'est faux ; tout est songe et mensonge, Illusion du cœur qu'un vain espoir prolonge. Nos seules vérités, hommes, sont nos douleurs. Harmonies poétiques et religieuses, le Tombeau d'une mère Alphonse de Prât de Lamartine Mâcon 1790-Paris 1869 Ici-bas, la douleur à la douleur s'enchaîne. Le jour succède au jour, et la peine à la peine. Premières Méditations poétiques, l'Homme Marie François Pierre Gontier de Biran , dit Maine de Biran Bergerac 1766-Paris 1824 Notre âme a plus de capacité pour le plaisir que pour la douleur. Journal, 1793 Nicolas Malebranche Paris 1638-Paris 1715 […] Le plaisir est toujours un bien, et la douleur toujours un mal ; mais il n'est pas toujours avantageux de jouir du plaisir, et il est quelquefois avantageux de souffrir la douleur. De la recherche de la vérité André Malraux Paris 1901-Créteil 1976 Toute douleur qui n'aide personne est absurde. La Condition humaine Gallimard André Malraux Paris 1901-Créteil 1976 La mort n'est pas une chose si sérieuse ; la douleur, oui. L'Espoir Gallimard Alfred de Musset Paris 1810-Paris 1857 L'homme est un apprenti, la douleur est son maître, Et nul ne se connaît tant qu'il n'a pas souffert. Poésies, la Nuit d'octobre Alfred de Musset Paris 1810-Paris 1857 Rien ne nous rend si grands qu'une grande douleur. Poésies, la Nuit de mai Raymond Queneau Le Havre 1903-Paris 1976 La douleur sous sa forme radicale et dépouillée — celle qui fait l'essence du supplice — est la pierre d'achoppement et le tombeau de toutes les philosophies. Les Enfants du limon Gallimard Antoine Rivaroli, dit le Comte de Rivarol Bagnols-sur-Cèze 1753-Berlin 1801 Il est plus facile à l'imagination de se composer un enfer avec la douleur qu'un paradis avec le plaisir. Discours sur l'homme intellectuel et moral Jean-Jacques Rousseau Genève 1712-Ermenonville, 1778 L'âme résiste bien plus aisément aux vives douleurs qu'à la tristesse prolongée. Julie ou la Nouvelle Héloïse Cicéron, en latin Marcus Tullius Cicero Arpinum 106-Formies 43 avant J.-C. Tu perds ta peine, douleur ; si importune que tu sois, je n'avouerai jamais que tu sois un mal. Nihil agis, dolor ! quamvis sis molestus, nunquam te esse confitebor malum. Tusculanes, II, 25 Commentaire Cicéron prête ces mots au philosophe Posidonius. Virgile, en latin Publius Vergilius Maro Andes, aujourd'hui Pietole, près de Mantoue, 70 avant J.-C.-Brindes 19 avant J.-C. Tu m'ordonnes, reine, de renouveler une indicible douleur. Infandum, regina, jubes renovare dolorem. L'Énéide, II, 3 Eschyle Éleusis vers 525-Gela, Sicile, 456 avant J.-C. Il est bon d'apprendre à être sage à l'école de la douleur. Les Euménides, 520 (traduction P. Mazon) Eschyle Éleusis vers 525-Gela, Sicile, 456 avant J.-C. Les malheurs humains ont des teintes multiples : jamais ne se retrouve même nuance de douleur. Les Suppliantes, 327 (traduction P. Mazon) sir Winston Leonard Spencer Churchill Blenheim Palace, Oxfordshire, 1874-Londres 1965 La mort et la douleur seront nos compagnons de voyage ; les privations notre vêtement, la constance et la vaillance notre seul bouclier. Death and sorrow will be the companions of our journey ; hardship our garment, constancy and valour our only shield. Commentaire Paroles prononcées par Winston Churchill le 8 octobre 1940 devant la Chambre des Communes. George Gordon, lord Byron Londres 1788-Missolonghi 1824 Le souvenir du bonheur n'est plus du bonheur ; le souvenir de la douleur est de la douleur encore. Joy's recollection is no longer joy, While sorrow's memory is a sorrow still. Marino Faliero, II, 1 Ievgueni Aleksandrovitch Ievtouchenko Zima, Sibérie, 1933 Les douleurs de la conscience sont des choses dangereuses. Extirpons la conscience — il n'y aura plus de douleur. Les Affres de la conscience ● douleur (expressions) nom féminin (latin dolor, -oris) Familier. Comprendre sa douleur, souffrir beaucoup, physiquement ou moralement. Douleur postopératoire, douleur survenant à la suite d'une intervention chirurgicale. ● douleur (synonymes) nom féminin (latin dolor, -oris) Sensation pénible, désagréable, ressentie dans une partie du corps
Synonymes :
- mal
Sentiment pénible, affliction, souffrance morale ; chagrin, peine
Synonymes :
- calvaire
- chagrin
- déchirement
- désespoir
- désolation
- épreuve
- misère
- tourment
Contraires :
- bonheur
- plaisir
douleur
n. f.
d1./d Sensation pénible ressentie dans une partie du corps, résultant d'une impression quelconque produite avec trop d'intensité. éprouver une vive douleur.
|| Spécial. être dans les douleurs, celles de l'accouchement.
|| Cour. Avoir des douleurs, des rhumatismes.
d2./d Impression morale pénible. Avoir la douleur de perdre un être cher. Les grandes douleurs sont muettes.
⇒DOULEUR, subst. fém.
A.— Domaine de la vie physique. Souffrance plus ou moins vive, produite par une blessure, une brûlure, une lésion ou toute autre cause, qui manifeste une rupture du bien-être, de l'équilibre de la santé, la perte ou la diminution de l'intégrité physique. Une douleur sans nom; (ne pas) supporter la douleur. Épicure place le bonheur dans la jouissance du plaisir et dans l'absence de la douleur (CONDORCET, Esq. tabl. hist., 1794, p. 73). Elle essaya de se lever. Au premier pas, elle éprouva une douleur si intolérable qu'elle faillit avoir une syncope, la tête lui tournait. Elle crut qu'elle allait mourir (ROLLAND, J.-Chr., Adolesc., 1905, p. 256). Je suis plein de douleurs et brisé de toutes parts (VALÉRY, Corresp. [avec Gide], 1909, p. 419) :
• 1. Vraiment, cette souffrance était abominable. La mort, soit; mais la douleur, le dépècement de l'être, la chair ainsi torturée pendant des jours, quel était le but? Quel fou avait rêvé cette inutile barbarie?
ESTAUNIÉ, L'Empreinte, 1896, p. 297.
SYNT. Douleurs abdominales, articulaires; douleurs de l'enfantement, de l'estomac; douleur à l'épaule, à la tête; cri, gémissement, hurlement de douleur; calmer, soulager, vaincre la/sa douleur; être courbé en deux, terrassé par la douleur; s'évanouir, se tordre de douleur; être rongé, transpercé de mille douleurs; souffrir des douleurs intolérables.
— Loc. et expr. Un lit de douleur. Un lit où l'on souffre. Le pain de douleur. L'église reconnut Simone hérétique et la mit, pour salutaire pénitence, au pain de douleur et à l'eau d'angoisse (FRANCE, Contes Tournebroche, 1908, p. 85). Être dans les douleurs (de l'enfantement). Ce matin elle a senti les douleurs (FRANCE, Bonnard, 1881, p. 273).
— Proverbe. À la Chandeleur, les grandes douleurs. Une température fraîche.
— Pop., fam. Avaler, étrangler la douleur. ,,Boire un verre d'eau-de-vie`` (FRANCE 1907). Papier à douleur. Protêt. Cf. POULOT, Sublime, 1872, p. 136. Sans douleur. Sans difficulté, sans dégât, sans mal. Je saisirais la sacoche du type pendant que mon copain le ceinturerait et à nous tout le bazar, sans douleur (M. STÉPHANE, Ceux du trimard, 1928, p. 94).
B.— Domaine de la vie psychique. Souffrance de l'âme, produite par une déception, un deuil, un chagrin, une peine, qui compromet plus ou moins gravement la quiétude, le goût, le bonheur de vivre. Douleur affreuse, grande douleur. Regarde, ô éternel! notre affliction; vois s'il y a une douleur comme notre douleur, et ne ferme point ton oreille à nos cris, afin que nous n'expirions pas dans la détresse! (COTTIN, Mathilde, t. 1, 1805, p. 115). L'homme est un apprenti, la douleur est son maître (MUSSET, Nuit oct., 1837, p. 155). Sois sage, ô ma douleur et tiens-toi plus tranquille (BAUDEL., Fl. du Mal, Recueillement, 1857-61). Je suis triste; il n'y a pas d'autres douleurs que celles-là, perdre ce qu'on aime (HUGO, Corresp., 1871, p. 295). On lui a dit, dès son âge le plus tendre (...) que les grandes douleurs sont muettes (BLOY, Journal, 1900, p. 25) :
• 2. La grande question dans la vie, c'est la douleur que l'on cause, et la métaphysique la plus ingénieuse ne justifie pas l'homme qui a déchiré le cœur qui l'aimait.
CONSTANT, Adolphe, 1816 ds MARTIN DU GARD, Notes sur André Gide, 1951, p. 1393.
SYNT. Douleur affective, morale; douleur de l'abandon, de l'absence, de la défaite, de l'exil, de la séparation; les douleurs de l'amour; avoir la douleur de faire part de, de vivre, de voir; être fou de douleur; connaître, cultiver la douleur; ressentir une/de la douleur; partager la douleur de qqn; mourir de douleur.
♦ P. méton. Longue, mince, en grand deuil, douleur majestueuse, Une femme passa (BAUDEL., Fl. du Mal, Recueillement, 1857-61 p. 161).
— Loc. et expr. La coupe, le feu de la douleur. Au fond de l'océan des douleurs et des outrages où elle fut plongée (DE GAULLE, Mém. guerre, 1959, p. 306). Pour comble de douleur. Être dans ses grandes douleurs. Louis XVIII était dans ses grandes douleurs (CHATEAUBR., Mém., t. 2, 1848, p. 617). Se mourir de douleur. Le père Dantès se mourait de douleur et d'inquiétude (DUMAS père, Monte-Cristo, t. 1, 1846, p. 108). Notre-Dame des Sept Douleurs. Benizzi, auteur de la touchante dévotion des Sept-Douleurs de la Vierge (MONTALEMBERT, Ste Élisabeth, 1836, p. LIX).
— Proverbes, maximes. Douleur aux vaincus; faute d'argent, c'est douleur non pareille; pour un plaisir, mille douleurs.
C.— Souffrance affectant le corps et l'âme. Douleur affreuse, immense. Louis Lambert souffrit donc par tous les points où la douleur a prise sur l'âme et sur la chair (BALZAC, L. Lambert, 1832, p. 59). Il s'abandonna, mit sa tête contre la poitrine de cet ami, et pleura toutes ses douleurs (LARBAUD, F. Marquez, 1911, p. 83) :
• 3. Morts pour la France, mais triomphants comme elle (...); ramenés par tous les chemins de nos douleurs et de notre victoire; voici donc ces morts revenus!
DE GAULLE, Mémoires de guerre, 1959, p. 623.
SYNT. Douleur atroce, cruelle, cuisante, déchirante, extrême, folle, fulgurante, horrible, infinie, inouïe, intolérable, lancinante, poignante, violente.
— Expr. Un souffre-douleur. Un bouc émissaire, celui qui subit les avanies, les vexations, les mauvais traitements. Toutes, la face levée, interpellaient violemment Adèle, qui était leur souffre-douleur, la bête sale et gauche sur laquelle la maison entière tapait (ZOLA, Pot-Bouille, 1882, p. 106). L'Homme des Douleurs. Jésus lui-même, puisqu'il est l'« Homme des Douleurs » (BLOY, Journal, 1894, p. 145).
— [P. réf. à la philos. stoïcienne] Douleur, tu n'es pas un mal. « La douleur est un bien »; quelques philosophes de l'Antiquité ont affirmé qu'elle n'étoit pas un mal (STAËL, Allemagne, t. 5, 1810, p. 112).
Rem. On rencontre ds la docum. dolorifique, adj. Qui cause de la douleur. Les sensations locales dolorifiques (RICŒUR, Philos. volonté, 1949, p. 88). Attesté ds Lar. 19e-20e, LITTRÉ, GUÉRIN 1892.
Prononc. et Orth. :[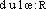 ]. Enq. :/
]. Enq. :/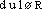 /. Ds Ac. dep. 1694. Étymol. et Hist. Ca 1050 dolur (Vie de St Alexis, éd. C. Storey, 157). Du lat. class. dolor, -oris « souffrance, douleur ». Fréq. abs. littér. :12 544. Fréq. rel. littér. :XIXe s. : a) 25 484, b) 16 797; XXe s. : a) 17 062, b) 12 337. Bbg. DARM. Vie. 1932, p. 188. — GIR. t. 2 Nouv. Rem. 1834, pp. 32-33. —LAVIS (G.). L'Expr. de l'affectivité dans la poésie lyrique fr. du Moy. Âge. Paris, 1972, passim. — QUEM. 2e s. t. 1 1970 —ROG. 1965, p. 121. — SCHOLLER (H.). Studien im semantischen Bereich des Schmerzes... Paris, 1959, passim. — STEFENELLI (A.). Lexikalische Variatio in Chrétiens Yvain. Z. rom. Philol. 1965, t. 81, pp. 250-287.
/. Ds Ac. dep. 1694. Étymol. et Hist. Ca 1050 dolur (Vie de St Alexis, éd. C. Storey, 157). Du lat. class. dolor, -oris « souffrance, douleur ». Fréq. abs. littér. :12 544. Fréq. rel. littér. :XIXe s. : a) 25 484, b) 16 797; XXe s. : a) 17 062, b) 12 337. Bbg. DARM. Vie. 1932, p. 188. — GIR. t. 2 Nouv. Rem. 1834, pp. 32-33. —LAVIS (G.). L'Expr. de l'affectivité dans la poésie lyrique fr. du Moy. Âge. Paris, 1972, passim. — QUEM. 2e s. t. 1 1970 —ROG. 1965, p. 121. — SCHOLLER (H.). Studien im semantischen Bereich des Schmerzes... Paris, 1959, passim. — STEFENELLI (A.). Lexikalische Variatio in Chrétiens Yvain. Z. rom. Philol. 1965, t. 81, pp. 250-287.
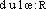 ]. Enq. :/
]. Enq. :/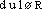 /. Ds Ac. dep. 1694. Étymol. et Hist. Ca 1050 dolur (Vie de St Alexis, éd. C. Storey, 157). Du lat. class. dolor, -oris « souffrance, douleur ». Fréq. abs. littér. :12 544. Fréq. rel. littér. :XIXe s. : a) 25 484, b) 16 797; XXe s. : a) 17 062, b) 12 337. Bbg. DARM. Vie. 1932, p. 188. — GIR. t. 2 Nouv. Rem. 1834, pp. 32-33. —LAVIS (G.). L'Expr. de l'affectivité dans la poésie lyrique fr. du Moy. Âge. Paris, 1972, passim. — QUEM. 2e s. t. 1 1970 —ROG. 1965, p. 121. — SCHOLLER (H.). Studien im semantischen Bereich des Schmerzes... Paris, 1959, passim. — STEFENELLI (A.). Lexikalische Variatio in Chrétiens Yvain. Z. rom. Philol. 1965, t. 81, pp. 250-287.
/. Ds Ac. dep. 1694. Étymol. et Hist. Ca 1050 dolur (Vie de St Alexis, éd. C. Storey, 157). Du lat. class. dolor, -oris « souffrance, douleur ». Fréq. abs. littér. :12 544. Fréq. rel. littér. :XIXe s. : a) 25 484, b) 16 797; XXe s. : a) 17 062, b) 12 337. Bbg. DARM. Vie. 1932, p. 188. — GIR. t. 2 Nouv. Rem. 1834, pp. 32-33. —LAVIS (G.). L'Expr. de l'affectivité dans la poésie lyrique fr. du Moy. Âge. Paris, 1972, passim. — QUEM. 2e s. t. 1 1970 —ROG. 1965, p. 121. — SCHOLLER (H.). Studien im semantischen Bereich des Schmerzes... Paris, 1959, passim. — STEFENELLI (A.). Lexikalische Variatio in Chrétiens Yvain. Z. rom. Philol. 1965, t. 81, pp. 250-287.
douleur [dulœʀ] n. f.
ÉTYM. V. 1050, dolur; lat. dolor, oris « souffrance, douleur », de dolere. → Dolent.
❖
1 Sensation ou impression pénible (une, des douleurs); l'ensemble de ses sensations (la douleur de…, la douleur). ⇒ Mal, souffrance, supplice, torture; douloureux. || La douleur (en général). || Manifestations extérieures de la douleur. ⇒ Cri, convulsion, crispation, gémissement, grimace, hurlement, larme, plainte, sanglot, soupir, spasme. || Exclamation de douleur. ⇒ Aïe, ahou. || Pleurer, gémir, hurler, se tordre, devenir fou de douleur. || L'acuité, les affres, les tourments de la douleur. || Adoucir, atténuer, apaiser, soulager, calmer, étourdir la douleur. || Supprimer la douleur en la niant (cit. 4). || Réveiller, raviver, aggraver, irriter, exaspérer, exacerber la douleur. || Supporter la douleur. || Se raidir, se cuirasser contre la douleur (⇒ Stoïcisme). || « Douleur, tu n'es pas un mal », maxime des stoïciens. || Le dolorisme, doctrine qui attribue une grande vertu à la douleur. — Le plaisir (cit. 14, 16.1) et la douleur.
♦ Par ext. Fam. || Sans douleur : sans difficulté. || Tout s'est bien passé, sans douleur.
♦ La douleur, les douleurs du corps, du cœur, de l'âme. → ci-dessous, cit. 22.
♦ La douleur, une douleur physique : sensation pénible en un point ou dans une région du corps. || Sentir, ressentir, éprouver une douleur à la tête, à l'estomac, au genou. || Douleur causée par un trouble de l'organisme, une lésion. || Douleur cutanée. ⇒ Piqûre; compression, pincement; brûlure, irritation; cuisson, prurit. || Douleur interne, profonde. || Douleur diffuse, sourde. ⇒ Oppression. || Douleur aiguë, vive; cinglante, cuisante, déchirante, fulgurante, irradiante, lancinante, pénétrante, poignante, térébrante, pulsative, profuse. || Douleur exquise. || Douleur brusque et brève. ⇒ Élancement; → Coup, cit. 3. || Douleur atroce, horrible, insupportable, intolérable. ⇒ Enfer, géhenne, supplice, torture (s'emploient aussi au sens 2). || Le paroxysme de la, d'une douleur. || Être en proie à des douleurs. ⇒ Dolent, malade, souffrant. || Douleur dans la tête, le ventre. ⇒ Mal; -algie. || Douleur ressentie sur le trajet d'un nerf. ⇒ Névralgie. || Douleur localisée. ⇒ Barre, brûlure, colique, courbature, effort, inflammation, migraine, point, rage (de dents), rhumatisme, tranchée. || Douleurs erratiques, qui n'ont pas de siège fixe dans le corps. Spécialt (surtout au plur.). || Être dans les douleurs (de l'accouchement); les premières, les grandes douleurs. ⇒ Contraction. || Une femme dans les douleurs, (vx) en douleurs. ⇒ Travail. — Nom scientifique de certaines douleurs. ⇒ Angor, céphalée, pyrosis, ténesme; et les suff. -algie (arthralgie, causalgie, métralgie…), 1. algo-, -odynie; et aussi algési-. — Provoquer la douleur. ⇒ Endolorir. || Qui ne cause aucune douleur. ⇒ Indolore. || Être sensible à la douleur, faible devant la douleur. ⇒ Douillet. || Insensibilité à la douleur. ⇒ Analgésie, analgie, antalgie. || Sensibilité à la douleur. ⇒ Algésie. || Remède qui fait disparaître la douleur. ⇒ Analgésique, anodin (remède), antalgique, narcotique. || La douleur s'est dissipée, est passée.
1 Ni la douleur ne lui est (à l'homme) toujours à fuir, ni la volupté toujours à suivre.
Montaigne, Essais, II, XII, p. 183.
1.1 (…) il n'est aucune sorte de sensation qui soit plus vive que celle de la douleur; ses impressions sont sûres, elles ne trompent point comme celles du plaisir, perpétuellement jouées par les femmes et presque jamais ressenties par elles (…)
Sade, Justine…, t. I, p. 196.
2 Dans notre vallée de larmes, ainsi qu'aux enfers, il est je ne sais quelle plainte éternelle, qui fait le fond ou la note dominante des lamentations humaines; on l'entend sans cesse, et elle continuerait quand toutes les douleurs créées viendraient à se taire.
Chateaubriand, Mémoires d'outre-tombe, t. II, p. 126.
3 À la femme, il dit : « Je multiplierai tes souffrances et spécialement celles à ta grossesse; tu enfanteras des fils dans la douleur (…) »
Bible (Crampon), Genèse, III, 16.
4 Ce fut le dernier jour d'avril que la jeune femme accoucha. Les douleurs la prirent l'après-midi, vers quatre heures (…)
Zola, l'Assommoir, t. I, IV, p. 125.
5 Si l'on s'efforce de définir les diverses sensations qui affectent douloureusement l'organisme humain, on peut espérer d'y réussir. Quand nous disons par exemple qu'une douleur est aiguë ou qu'elle est sourde, qu'elle est lancinante ou fulgurante, nous nous faisons entendre assez bien.
France, Pierre Nozière, III, III, p. 234.
6 Il souffre. De partout : de la bouche, des jambes, du dos… Des frissons de fièvre lui parcourent les reins, et lui tirent, chaque fois, une plainte sourde. Cependant, ce ne sont plus ces douleurs fulgurantes qui lui lacéraient le corps, après la chute, après l'incendie. On a dû s'occuper de lui, panser ses blessures.
Martin du Gard, les Thibault, t. VIII, p. 159.
♦ ☑ Loc. Un lit de douleur, où l'on souffre.
2 Douleur (morale) : sentiment ou émotion pénible résultant de l'insatisfaction des tendances, des besoins, d'un manque, d'une frustration… ⇒ Souffrance. || Éprouver une grande douleur. || Douleur active, passive. || Aspects de la douleur morale. ⇒ Affliction, amertume, angoisse, brisement, chagrin, componction, consternation, contrition, crève-cœur, déchirement, déplaisir (vx), désespoir, désolation, détresse, deuil, peine, repentir, tristesse; (métaphore) blessure, plaie (béante, saignante). || La douleur de l'absence (→ Coup, cit. 51). || Douleur qui serre, transperce (→ Abandonner, cit. 19), fait saigner le cœur. || Douleur cruelle, cuisante, déchirante (cit. 2), poignante. || Douleur mortelle. || Cicatrisation d'une ancienne douleur. || Douleur contenue (cit. 9), muette. || Se complaire (cit. 8) dans la douleur. || Se laisser aller à la douleur. || Laisser éclater sa douleur. || Confier sa douleur à qqn. || Être comblé, accablé (cit. 10) de douleur; plongé, abîmé, perdu dans sa douleur; envahi, écrasé, épuisé, assommé, submergé par la douleur. || Raviver une douleur (→ Remuer, retourner le couteau, le poignard dans la plaie). || Consoler la douleur de qqn. || Dérivatif à la douleur. || Ressentir, partager les douleurs d'autrui. ⇒ Compatir; aussi condoléance(s); → Dépersonnalisation, cit. 1. || Accepter la douleur (→ Porter sa croix). || Vie de douleur. ⇒ Calvaire, couronne (d'épines), géhenne. || Toucher le fond de la douleur (→ Boire le calice, la coupe jusqu'à la lie). || Douleur sans fiel. — Formule. || « X…, Y… ont la douleur de vous faire part… », formule pour un avis de décès. — J'ai eu la douleur de perdre ma mère. || La douleur qui vous a frappé. || Chant de douleur. ⇒ Complainte, lamento. — Notre-Dame des sept Douleurs.
7 Ta douleur, Du Périer, sera donc éternelle (…)
Malherbe, Consolation à M. Du Périer.
8 La douleur que l'on cache est la plus inhumaine.
Mathurin Régnier, Dialogue, Cloris et Philis.
9 La douleur qui se tait n'en est que plus funeste.
Racine, Andromaque, III, 3.
10 (…) dans toutes les misères de ma vie, je me sentais constamment rempli de sentiments tendres, touchants, délicieux, qui, versant un baume salutaire sur les blessures de mon cœur navré, semblaient en convertir la douleur en volupté (…)
Rousseau, Rêveries…, 8e promenade.
11 (…) mes motifs de consolation ne servirent qu'à nourrir son désespoir. J'étais comme un homme qui veut sauver son ami coulant à fond au milieu d'un fleuve sans vouloir nager. La douleur l'avait submergé.
Bernardin de Saint-Pierre, Paul et Virginie, p. 145.
12 (…) les douleurs récentes font reverdir les vieilles douleurs.
Chateaubriand, Mémoires d'outre-tombe, t. II, p. 71.
13 Ici-bas, la douleur à la douleur s'enchaîne,
Le jour succède au jour, et la peine à la peine.
Lamartine, Premières méditations, « L'homme ».
14 Rien ne nous rend si grands qu'une grande douleur,
Mais, pour en être atteint, ne crois pas, ô poète !
Que ta voix ici-bas doive rester muette.
A. de Musset, Poésies nouvelles, « Nuit de mai » (→ Chant, cit. 12).
15 C'était un mal vulgaire et bien connu des hommes;
Mais, lorsque nous avons quelque ennui dans le cœur,
Nous nous imaginons, pauvres fous que nous sommes,
Que personne avant nous n'a senti la douleur.
A. de Musset, Poésies nouvelles, « Nuit d'octobre ».
16 L'homme est un apprenti, la douleur est son maître,
Et nul ne se connaît tant qu'il n'a pas souffert (…)
Pour vivre et pour sentir l'homme a besoin de pleurs (…)
A. de Musset, Poésies nouvelles.
17 Sois sage, ô ma Douleur, et tiens-toi plus tranquille.
Baudelaire, les Nouvelles Fleurs du mal, VII, « Recueillement ».
18 La douleur abaisse, humilie, porte à blasphémer.
Renan, Souvenirs d'enfance…, VI, 5.
18.1 À voir Hartbert inanimé, la douleur du marin fut terrible. Il sanglotait, il pleurait, il voulait se briser la tête contre les murailles.
J. Verne, l'Île mystérieuse, t. II, p. 684.
19 C'est lui (Dieu) qui donne la Douleur, parce qu'il n'y a que Lui qui puisse donner quelque chose, et la Douleur est si sainte qu'elle idéalise ou magnifie les plus misérables êtres !
Léon Bloy, la Femme pauvre, p. 72.
20 Dostoïevski était né pour la douleur, et pour s'élever dans la douleur, au-dessus de tout l'égoïsme et de toute la misère morale, où la douleur enferme généralement les natures médiocres.
André Suarès, Trois hommes, « Dostoïevski », V, p. 259.
21 (…) selon l'Église, ce n'est pas la douleur en soi qui rachète, mais la douleur acceptée, consentie, subie, en union avec le Christ, dans un esprit de pénitence et de repentir.
F. Mauriac, Souffrances et Bonheur du chrétien, p. 36.
22 Je vous les dirai quand même, un jour, si j'y pense, et que je le puisse, mes étranges douleurs, en détail, et en les bien distinguant (…) Je vous dirai celles de l'entendement, celles du cœur et affectives, celles de l'âme (très jolies, celles de l'âme), et puis celles du corps, les internes ou cachées d'abord, puis celles en surface (…)
S. Beckett, Premier amour, p. 25.
♦ ☑ Prov. Faute d'argent (cit. 17), c'est douleur non pareille : rien n'est pire que le manque d'argent. — ☑ Les grandes douleurs sont muettes (cit. 13), on ne peut les exprimer.
❖
CONTR. Béatitude, bonheur, calme, contentement, euphorie, joie, jubilation, plaisir.
COMP. Souffre-douleur.
Encyclopédie Universelle. 2012.